背景
子宫内膜癌(endometrial cancer,EC)是全球第六大女性最常见的癌症,据报道2020年新发病例417,000例,新发死亡病例97,000例。EC在北美、欧洲、密克罗尼西亚/波利尼西亚、澳大利亚/新西兰等地更为普遍,而在非洲及中南亚地区较为少见。一般来说,发生EC的危险因素包括无孕产史、不规律月经、不孕症、雌激素暴露、激素药物的使用、较高的BMI、糖尿病、遗传因素(如Lynch 综合征)。几十年来,我们根据病理结果如组织学类型、分期、分级、肌层浸润(MI)、淋巴管间隙侵犯(LVSI)、宫颈间质浸润(CSI)来确定EC的复发风险。然而,基于病理结果的风险分层在妇科病理学专家中可重复性不一。因此,传统的风险分层可能导致一些患者没有得到充分的治疗。随着基因组分析技术的发展,与EC预后和治疗药物有关的分子异常和分子分型越来越清晰。来自东京智庆大学医学院的Junya Tabata等人近期发表在Gynecology and Obstetrics Clinical Medicine的一篇综述Molecular typing guiding treatment and prognosis of endometrial cancer阐述了分子分型下各类EC的分子生物学特征和潜在治疗靶点,并总结了相关的临床研究(见表1)。
Bokhman于1983年首次提出将EC分为两种类型:Ⅰ型(子宫内膜样),占80%的患者,和Ⅱ型(非子宫内膜样),占20%的患者。
(一)Ⅰ型EC在组织学上是中高度分化子宫内膜样子宫内膜癌(endometrioid endometrial carcinoma,EEC),与长期雌激素刺激相关,并经常伴有子宫内膜增生。Ⅰ型EC与PTEN、ARID1A抑癌基因突变和CTNNB1、PIK3CA、KRAS原癌基因突变显著相关。此外,大约三分之一的肿瘤中存在微卫星不稳定(MSI)。EEC是最常见的EC类型,PTEN突变频率较高(52%~78%)。PTEN是一种抑癌基因,与EEC的前体病变复杂不典型增生(CAH)的发病机制有关。此外,PTEN是PI3K/AKT/mTOR通路的负调控因子。PTEN突变可以激活PI3K/AKT/mTOR通路,导致CAH向EEC的进展。大约25%的EEC中存在CTNNB1功能获得性突变。大约40%-50%的EEC病例中可以观察到ARID1A基因的失活突变,这也与CAH向EEC的进展有关。
(二)典型的Ⅱ型EC包括浆液性癌(serous endometrial carcinoma,SEC)、透明细胞癌(clear cell endometrial carcinoma,CCEC)和癌肉瘤(UCS),其组织学上以低分化为特征。它们与TP53突变和ERBB2致癌基因的扩增显著相关。
SEC在大多数情况下显示TP53突变和频繁的拷贝数改变;在26%~45%的SEC中发现了HER2的扩增或过表达;MSI非常罕见。浆液性子宫内膜上皮内癌(SEIC)通常先于SEC,可能继发于子宫内膜p53特征性改变。
CCEC是一种罕见的组织学类型,占EC的1%~6%。与SEC相比,TP53突变在CCEC中相对罕见,约为40%。PIK3CA和ARID1A的突变在CCEC中也很常见,分别约为14%~36%和16%~26%。MSI约占11%~19%。
UCS由高级别上皮细胞和间充质成分混合组成。大多数在UCS中显著发生的突变也是在EEC中发生的突变。最常见的是TP53突变,发生在91%的UCS病例中。近一半的UCS有一个以上的PI3K通路基因发生突变:22%~41%、11%~41%和6%~17%的PIK3CA、PTEN和PIK3R1基因发生突变。与大多数其他的PTEN和TP53突变相互排斥的EC亚型相比,大多数USC既具有PTEN突变也有TP53突变。
(三)大约5%的EC病例是由与Lynch综合征(LS)、聚合酶校正相关息肉综合征(PPAP)和Cowden综合征等相关疾病相关的遗传性基因突变引起的。LS是一种常染色体显性遗传病,占EC的2%~6%。由错配修复基因突变引起,特别是MLH1、MSH2、MSH6和PMS2。PPAP是一种常染色体显性遗传病,由POLE和POLD1外切酶结构域的种系错义突变引起,易导致EC、腺瘤性息肉、结直肠癌和其他恶性肿瘤。Cowden综合征是一种常染色体显性遗传病,其特征是PTEN突变和多组织多发性错构瘤。在许多组织中,恶性肿瘤的风险会增加,尤其在子宫内膜、乳房、甲状腺、结直肠和肾脏中。
癌症基因组图谱(TCGA)于2013年对373例EC[EEC(G1/G2/G3)、SEC和混合性EC]病例进行了包括全基因组或外显子组测序、DNA拷贝数分析、RNA测序、microRNA测序、DNA甲基化分析和反向蛋白阵列分析,将EC分为四个分子亚型:POLE超突变型(POLEmut)、高度微卫星不稳定型(MSI-H)、高拷贝数型(CN-H),低拷贝数型(CN-L)。有研究证实了这种分子分型与预后的密切关系。在这四种分类中,POLEmut预后最好,CN-H预后最差,MSI-H和CN-L预后中等。随后,有两个研究小组开发了一种使用替代标记的算法,使分类在临床环境中更实用和更经济。他们利用p53、MMR相关蛋白的免疫组化和通过POLE基因外切酶结构域突变测序开发了算法。将EC分为由POLE-mut、错配修复缺陷(MMRd)型、p53突变型(p53abn)和无特意分子谱型(NSMP)。2020年WHO女性生殖器肿瘤第五版建议将分子分型纳入病理报告。此外,在2020年ESGO/ESTRO/ESP指南中,分子分型被纳入风险分层,以确定术后辅助治疗的方法。
(一)POLEmut EC在约10%的EC病例中被检测到,通常与年轻、低BMI、子宫内膜样组织学和早期的临床病理特征相关。POLE基因编码DNA聚合酶ε的催化亚基,并与DNA的复制和修复有关。POLE突变被称为超突变是因为它们可以积累几个突变,每兆碱基(MB)有超过100个变异。组织学上,EEC G3级占POLEmut病例的56.9%,其次是SEC和CCEC,各占11.8%。而EEC G1级和G2级仅占7.8%。一项对来自9项研究的3185例EEC病例进行的荟萃分析显示EEC G3级病例大多数为POLEmut或MMRd EC,G1和G2病例很少归为NSMP型。虽然大多数POLEmut EC病例表现出病理侵袭性特征,如高级别和LVSI,但它在四种分子亚型中预后最好。在TCGA分析中发现的所有17个POLEmut EC均无复发,在PORTEC-3分析中发现的93个POLEmut EC中只有1例复发。因此,由于POLEmut EC预后良好,可以考虑免去术后辅助治疗。此外,由于POLEmut EC的高免疫原性,免疫检查点抑制剂(ICI)可能是复发性或晚期POLEmut EC治疗的候选药物。另外发生TP53突变的POLEmut EC也已被报道。在一项对3518例ECs的研究中,所有POLEmut-p53abn病例均表现出与POLEmut EC相似的分子特征和预后,结果提示p53abn可能是POLEmut病例的继发性改变,这意味着POLEmut-p53abn病例应与POLEmut病例一样进行治疗。
(二)MMRd EC的特征是存在MMR功能缺陷。MMR功能缺陷可以通过微卫星不稳定性检测或DNA错配修复相关基因的免疫组化染色来确定,如MLH1、MSH2、MSH6、PMS2,约30%的EC缺乏导致突变积累的机制。因此,MMRd EC显示出相对较高的肿瘤突变负担(TMB),每MB检测到超过10个突变。在遗传学上,PTEN和PIK3CA突变在MMRd EC中更为常见,分别发生在88%和54%的病例中。37%的病例中报告了ARID1A突变。MMRd EC与POLEmut EC一样,具有高度免疫原性,肿瘤突变抗原(新抗原)的增加与生存期延长相关。新抗原的产生可上调肿瘤浸润淋巴细胞,特别是CD8+细胞毒性T细胞,并增加T细胞介导的抗肿瘤反应。此外,与POLEmut EC类似,已经发现了同时发生TP53突变的MMRd EC。然而,这些病例的预后与MMRd EC相似,提示TP53突变是一个继发性事件。
(三)p53abn EC约占EC的12.2%~25.9%,预后与SEC相似,在四种分子分型中预后最差,占所有EC死亡病例的一半。在TCGA鉴定的60个p53abn EC中,44例(73.3%)的组织学类型为浆液性癌或混合性。p53abn EC占SEC的93%,UCS的85%,CCEC的38%,EEC G3的22%,EEC G1和G2的5%。p53abn EC具有高拷贝数和低突变负担的遗传特征。在90%以上的病例中发现TP53基因突变,随后PIK3CA(47%)、FBXW7(22%)、PPP2R1A(22%)和ERBB2局灶性扩增导致HER2过表达(25%)。相反,经常在其他分子类型中检测到的PTEN突变,只在大约10%的p53abn EC病例中存在。TCGA基因组分析表明,p53abn EC的分子图谱与高级别浆液性卵巢癌(HGSOC)和基底样乳腺癌相似。这些HGSOC和基底细胞样乳腺癌经常有同源重组缺陷(HRD)。因此多聚ADP核糖聚合酶抑制剂(PARPi)可能是这类p53abn EC的潜在治疗药物。
(四)NSMP EC缺乏特定的分子特征,如POLE突变、TP53突变和MMRd,遗传上拷贝数和TMB均较低,约占所有EC的一半。NSMP EC预后中等。NSMP p53wt EC的临床病理特征包括组织学分级G1、G2、较高的BMI和糖尿病。大约一半的NSMP型患者雌激素受体(ER)和孕激素受体(PR)高表达,提示它们可以从激素治疗中获益。在遗传方面,很少检测到POLE和TP53基因异常,而体细胞突变,如PTEN、PIK3CA、CTNNB1和ARID1A基因经常出现。其中在大约一半的病例可以检测到CTNNB1基因第3外显子的突变,而有突变的患者比没有突变的患者更可能复发且预后更差。此外,L1CAM的过表达与远处转移和预后较差密切相关。因此,可能存在某些潜在的NSMP异质性群体的生物标志物,如CTNNB1突变和L1CAM表达。
(一)常规治疗:放疗、化疗、放化疗
PORTEC-3研究的结果可作为参考。在该研究中,p53abn EC同步放化疗组和单纯放疗组的5年无复发生存率(RFS)分别为58.6%和36.2%(p = 0.021),提示化疗可能对p53abn EC有效,并且在亚组分析的早期病例中也观察到类似的趋势。相比之下,在POLEmut EC(100%vs97%,p = 0.637)、MMRd EC(68%vs76%,p = 0.428)或NSMP EC(80%vs68%,p = 0.243)中放化疗和单纯放疗的5年RFS预后没有显著差异。然而在某些研究中,放疗对MMRd 型EC是有益的。最近的一项多中心回顾性研究比较了放化疗与单纯化疗在晚期MSI-H EC中的疗效,发现增加放疗可延长其无病生存期(DFS)。
(二)免疫检查点阻断治疗
考虑到其高免疫原性,ICI可能对晚期或复发性POLEmut和MMRd EC有效。ICI对MMRd/MSI-High (MSI-H)实体肿瘤的疗效已被评估,据报道,对nivolumab(纳武利尤单抗)(抗PD-1)、avelumab(阿维单抗)(抗PD-L1)、durvalumab(度伐利尤单抗)(抗PD-L1)和dostarlimab(多塔利单抗)(抗PD-1)的反应约为25%~47%。一项临床试验(KEYNOTE-158)应用pembrolizumab(帕博利珠单抗)单药治疗既往治疗失败的MMRd/MSI-H非结直肠癌患者,其中包括49例EC患者,总缓解率(ORR)为57.1%。在最近的GARNET研究中,关于dostarlimab疗效,MMRd组ORR为43.5%(95% CI 34.0–53.4%),11例患者完全缓解、36例患者部分缓解;而在错配修复完整型(MMRp)组中ORR为是14.1%(95% CI 9.1–20.6%),3例完全缓解和19例部分缓解。虽然免疫检查点阻断治疗对晚期和复发的MMRd EC有效,但由于一线治疗获益的数据有限,在新诊断的EC中,ICI是否对标准治疗有附加作用尚不清楚。TransPORTEC研究小组领导的RAINBO项目正计划解决这个问题。
Lenvatinib(乐伐替尼)是一种靶向血管内皮生长因子1-3的激酶抑制剂,目前已显示出对甲状腺癌、肝细胞癌和肾细胞癌的疗效。KEYNOTE-146是一项IB/II期试验,研究pembrolizumab 和lenvatinib 联合治疗晚期实体肿瘤患者的疗效。2020年发表了108例EC的结果,总应答率为38.0%,其中MMRd组为63.6%,MMRp组为36.2%。
(三)靶向同源重组缺陷
同源重组修复机制是DNA双链断裂修复的主要机制。PARPi是利用合成致死概念(如与乳腺癌易感基因BRCA1/2形成合成致死作用杀死肿瘤细胞),以及在DNA损伤处捕获PARP两种机制发挥作用,常用于治疗晚期和铂敏感的复发性卵巢癌。因此,HRD可能是治疗伴随HRD的p53abn EC的潜在靶点。根据TCGA分析,SEC的分子图谱与HGSOC和基底样乳腺癌相似,约有一半的HGSOC病例和基底样乳腺癌存在HRD。46%的TP53基因异常的EC有HRD。Lin Dong等人研究了60例SEC,发现22例(36.7%)HRR相关基因异常患者,如ATM、BRCA1、BRCA2。此外,他们还报道在p53abn人群中,HRD患者的PFS和DSS(疾病特异性生存期)比HRP(同源重组熟练)患者更长。但是一项使用Myriad myChoice调查EC HRD评分的研究报告称HRD评分较高的EC预后较差。Siedel等人报道,高评分HRD的细胞系比低HRD评分的细胞系对olaparib(奥拉帕尼)更敏感。
(四)靶向PI3K/AKT/mTOR途径
PI3K和mTOR信号通路调节细胞生长、存活、蛋白质合成和血管生成,在EC中通常会发生改变。TCGA和其他分子研究已经发现通路组成成分的突变,包括PTEN、PIK3CA、PIK3R1和KRAS,经常在EC中发现。mTOR抑制剂,如ridaforolimus[42-(二甲基亚膦酰)雷帕霉素]、everolimus(依维莫司)和temsirolimus(替西罗莫司)已显示出对EC的一些临床疗效,并正在研究中。一项研究表明,抗血管生成药物bevacizumab(贝伐单抗)和temsirolimus联合治疗是有效的,尽管它会引起肠穿孔等不良事件。一项II期临床试验显示在至少接受过2种细胞毒性治疗方案的复发性EC患者中,everolimus 和来曲唑的治疗按RECIST1.0标准临床获益率(CBR)为40%,客观缓解率为32%。也曾报道过everolimus 和来曲唑在治疗既往未接受过化疗的复发性EC患者时的高PFS(28个月)。二甲双胍可以下调AKT/mTOR通路,并可能改善EC对mTOR抑制剂治疗的反应。一项使用everolimu、来曲唑、二甲双胍治疗晚期或复发性EEC的II期临床试验显示50%的临床获益率和28%的总缓解率。PR阳性肿瘤对治疗的反应更好。
(五)靶向HER2/Neu
HER2的扩增或过表达经常在SEC中出现,并与较差的预后相关。trastuzumab(曲妥珠单抗,Tr)是一种针对HER2的人源化单克隆抗体,临床试验表明其与复发性、转移性和晚期SEC的预后改善相关。有临床研究显示对于复发性和晚期SEC,在TC化疗方案中加入Tr有获益,TC+Tr组的中位PFS为12.9个月,TC组为8.0个月。曲妥珠单抗可以抑制HER2蛋白同源二聚体,而帕妥珠单抗抑制异源二聚体。因此,在TC+Tr的治疗中加入帕妥珠单抗应该会增加其抗肿瘤活性,这已在乳腺癌中得到证实。最近,德喜曲妥珠单抗(T-DXd),一种靶向HER2的抗体偶联药物,被证明对HER2阳性的复发性胃癌有效。因此,目前正在设计一项II期临床试验来评估T-DXd在HER表达肿瘤中的有效性和安全性,其中就包括EC。
(六)靶向ARID1A
ARID1A是编码BAF250a蛋白质(SWI/SNF染色质重塑复合物的一个组成部分)的基因。该复合物在基因转录中发挥作用,并参与各种细胞过程,如组织分化、增殖和DNA修复。在EEC中经常检测到ARID1A失活突变,并与不良预后相关;然而,在G3级EEC中ARID1A表达缺失却与较长的无复发生存期(RFS)相关。在非典型子宫内膜增生的局灶区域也观察到ARID1A表达缺失,这表明ARID1A在子宫内膜肿瘤发生中发挥抑制作用。因此,ARID1A突变是预测EC的一种很有前景的生物标志物,也可用于开发新的治疗方法。EZH2与ARID1A共同靶向PIK3IP1基因,有研究表明,抑制EZH2后,PI3K1P上调,PI3K/AKT通路受到抑制导致细胞发生合成致死。所以抑制EZH2或可成为治疗携带ARID1A突变肿瘤的新策略。
(七)关于辅助治疗的降级
因POLEmut EC术后治疗的预后非常好,所以可以考虑其术后辅助治疗。使用POLE突变小鼠来源的胚胎干细胞(mES)进行的实验表明,POLE突变并没有提高mES细胞对放疗和化疗的敏感性。同样,在PORTEC-3试验中,比较了高危EC患者术后放化疗组与放疗组的预后,POLEmut患者的5年生存率分别为100%和97%。在ESGO指南中,术后无残留的POLEmut EC被认为是低风险,不需要辅助治疗。
(八)激素治疗
虽然激素治疗ER/PR阳性EC的疗效已在临床试验中得到了检验,但其结果还不足以纳入标准治疗。相比之下,激素治疗在乳腺癌的标准治疗中很重要。对乳腺癌中分子特征与激素治疗效果之间关系的研究正在深入进行,在EC中也需要此类研究。鉴于NSMP EC与PI3K/Akt/mTOR通路突变相关,使用来曲唑联合mTOR抑制剂everolimus和二甲双胍治疗的临床试验结果已被报道。
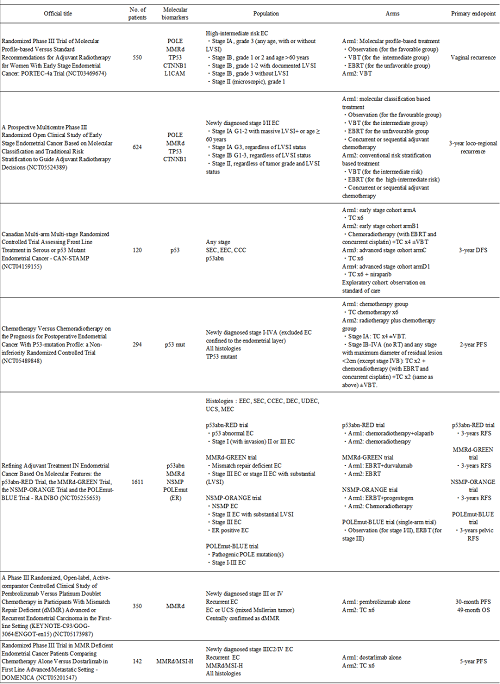
表1 正在进行的关于靶向分子特异性EC的临床Ⅲ期研究总结
翟茁钰 编译

本文内容来自Elsevier合作期刊Gynecology and Obstetrics Clinical Medicine(GOCM)第三卷第一期发表的“Molecular typing guiding treatment and prognosis of endometrial cancer.”
DOI:https://doi.org/10.1016/j.gocm.2023.01.011
引用格式:Tabata J, Takenaka M, Okamoto A, et al. Molecular typing guiding treatment and prognosis of endometrial cancer. Gynecol Obstet Clin Med.2023;3(1).in press.
原文摘要:

 妇产科在线APP下载
妇产科在线APP下载













