前言
3月2日,山东大学陈子江院士团队在知名期刊Journal of Clinical Investigation(IF:19.5)上发表了题为“TP63 gain-of-function mutations cause premature ovarian insufficiency by inducing oocyte apoptosis”的一项研究。该研究揭示TP63基因突变在POI发病中的作用及机制。陈子江院士团队将本研究的背景、研究目的、研究方法及结论与读者分享,为大家带来一些科研启发。
山东大学生殖医学研究中心博士研究生黄橙紫和硕士研究生赵思敏为共同第一作者,陈子江院士和赵世斗教授为共同通讯作者。
背景与研究目的
早发性卵巢功能不全(POI)是指女性在40岁之前出现卵巢功能减退,严重影响女性生育力。半数以上的POI患者病因不明,通过遗传学筛查明确其病因是实现POI早诊早治的关键。TP63基因是p53家族的成员,其编码的TAp63α特异性表达于原始卵泡的卵母细胞中[1]。在卵母细胞发生DNA损伤后,TAp63α激活从而启动细胞凋亡,起到质量控制因子的功能[2]。既往研究发现了与POI相关的TP63突变,但由于只有少数病例报道且缺乏功能研究,该基因突变对于POI疾病的贡献度、基因型与表型的相关性及其临床意义仍不清楚。本研究在大规模POI全外显子组测序(WES)数据库中筛选TP63基因突变,并进行全面系统的功能验证,探讨不同突变类型对表型的影响,揭示TP63基因突变在POI发病中的作用及机制。
方法
基于团队前期构建的1030例POI-WES数据库,对TP63基因进行突变筛查和功能分析。然后,通过Luciferase reporter assay、BN-PAGE、TUNEL等体外实验检测突变的致病性;其次,分别构建转录抑制结构域(TID)缺失(p63+/ΔTID)和点突变(p63+/R647C)小鼠,通过生育力测试、卵泡计数等观察突变小鼠的生殖系统表型。同时,通过免疫荧光染色、Western blot等检测下游凋亡通路的激活。此外,由于p63+/R647C小鼠生殖缺陷表型较轻,进一步对该小鼠卵母细胞进行第一极体排出率观察、纺锤体形态染色、线粒体膜电位检测等。最终,通过体外及体内实验共同揭示TP63功能获得性突变导致POI的作用机制。
主要结局
在11名POI患者中共发现9个TP63基因杂合突变,其中大部分突变集中在TAp63α的C端,为TID之前的截短突变或位于TID核心区域内的点突变(图1A,红色所示)。首先,对9个杂合突变进行体外功能研究,发现影响TID的6个突变体与N端转录激活结构域(TAD)的结合受损,导致突变体形成开放的激活型四聚体,从而引起下游靶基因NOXA、PUMA和BAX表达增加和细胞凋亡。其次,发现p63+/ΔTID雌鼠不育,p63+/R647C雌鼠生育力下降。p63+/ΔTID和p63+/R647C雌鼠均出现卵泡过早耗竭的POI样表型,但p63+/R647C小鼠表型较轻。p63+/ΔTID小鼠卵泡于生后10天(P10)完全消失(图1B),p63+/R647C小鼠卵泡P10时减少至野生型小鼠的约50%。进一步研究发现,p63+/ΔTID和p63+/R647C小鼠卵母细胞凋亡比例显著增加,p63+/ΔTID卵巢中凋亡基因Bax、Puma、Noxa表达增加。同时,除了在p63+/R647C小鼠中观察到卵母细胞丢失外,其剩余存活卵母细胞的第一极体排出率降低,异常纺锤体率增高且线粒体膜电位下降,提示卵母细胞质量受损,这表明具有不同转录活性的不同突变类型决定了卵母细胞的耗竭速度和表型差异。总之,该研究表明TP63是一个比较常见的POI致病基因,对突变携带者的遗传咨询和生育指导具有重要意义。
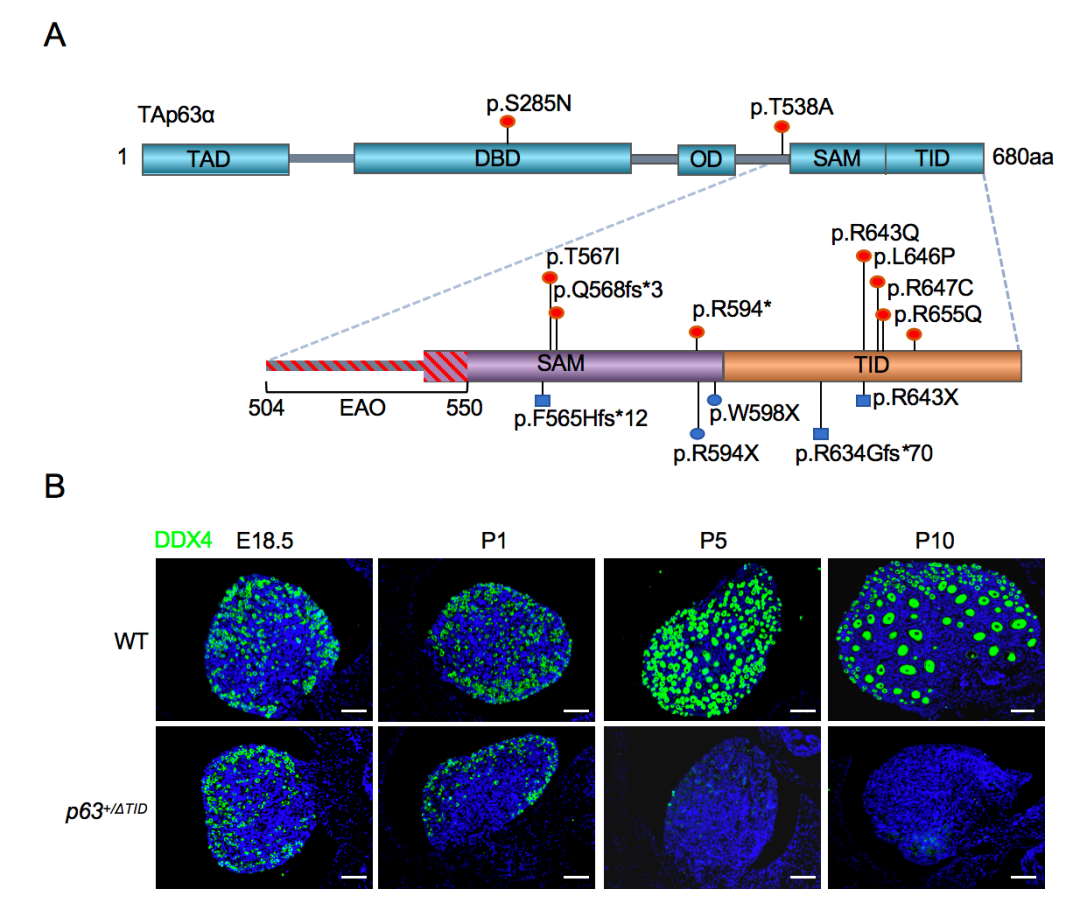
图1 TP63基因突变及p63+/ΔTID小鼠卵泡过早耗竭
结论
本研究明确了6个TP63基因突变导致TAp63α蛋白C端的TID功能受损,引发TAp63α蛋白从封闭的失活二聚体构象转变为开放的激活型四聚体,自发激活下游凋亡相关靶基因的表达,进而诱导卵母细胞凋亡,最终导致POI(图2)。该研究不仅揭示了功能获得性基因突变导致POI的新机制,更为女性特别是肿瘤放化疗患者的生育力保护提供了理论依据和干预靶点。
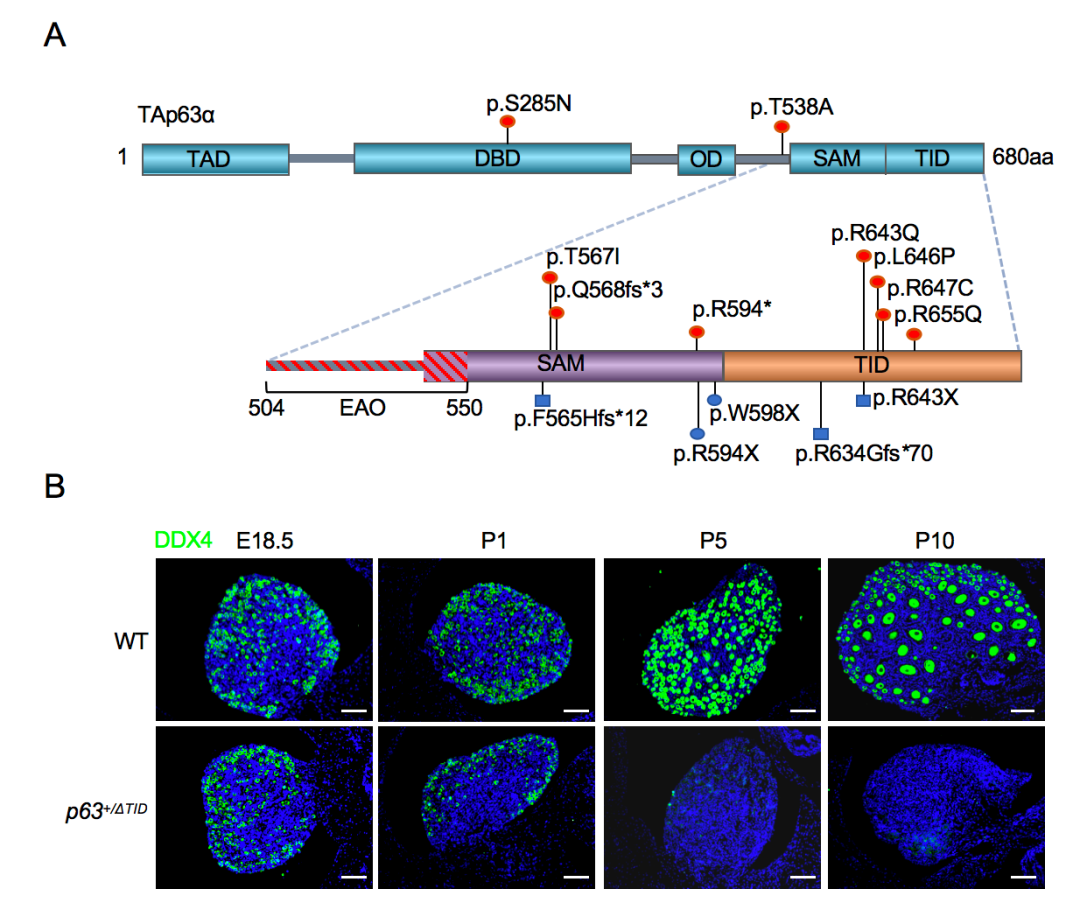
图2 突变型TAp63α致病模式图
参考文献
1.Suh EK, et al. p63 protects the female germ line during meiotic arrest. Nature. 2006;444(7119):624-628.
2.Tuppi M, et al. Oocyte DNA damage quality control requires consecutive interplay of CHK2 and CK1 to activate p63. Nat Struct Mol Biol. 2018;25(3):261-269.
 妇产科在线APP下载
妇产科在线APP下载












