作者:周晖a,刘昀昀a,罗铭b,林仲秋a
作者单位:中山大学孙逸仙纪念医院,a.妇科,b.放疗科,广东 广州 510120
通讯作者:林仲秋,电子信箱:lin-zhongqiu@163.com
子宫颈癌是全球女性第4大常见癌症,是发展中国家女性癌症死亡的主要原因。2020年1月14日,美国国立综合癌症网络(NCCN)公布了“2020宫颈癌临床实践指南第一版”。为使大家更好地了解新版指南,现对其进行简要解读。指南讨论的范围包括子宫颈鳞癌,腺鳞癌和腺癌。不包括神经内分泌癌,小细胞肿瘤,透明细胞癌,肉瘤和其他组织学类型。
1 新版指南主要更新
1.1 初治子宫颈癌手术方法 B型和C1型子宫切除术删除微创术式。早期子宫颈癌患者保留生育功能根治性子宫颈切除术仍推荐经阴道或开腹或微创手术(微创为2B类),但缺乏肿瘤预后的相关数据。
1.2 手术途径 明确推荐开腹手术是根治性子宫切除术的标准方法(1类证据)。删除旧指南中提到的对于早期子宫颈癌患者经充分了解生存结局和肿瘤风险后可采用不同手术入路的临床试验。
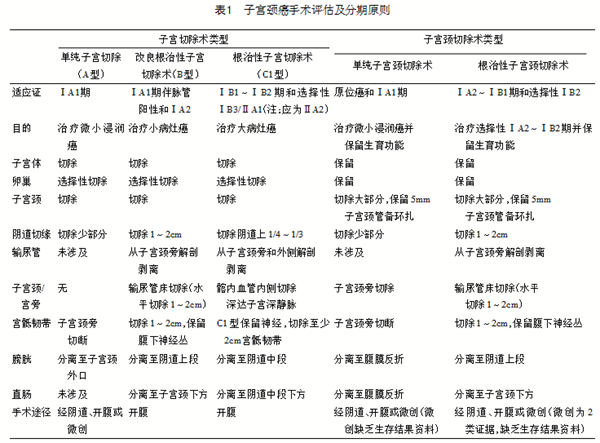
1.3 推荐的各型子宫切除术手术方式如下 (1)筋膜外子宫切除术(A型):经阴道或开腹或微创。(2)改良根治性子宫切除术(B型):开腹。(3)根治性子宫切除术(C1型):开腹。
1.4 新增 前哨淋巴显影中吲哚青绿(ICG)被证明不亚于异磺胺蓝染料。超分期步骤目前缺乏标准。
1.5 术后检查 术后发现高危因素如盆腔淋巴结和(或)切缘和(或)宫旁阳性的患者,在进行下一步辅助治疗前需行影像学检查对肿瘤转移进行全身评估。
1.6 其他手术路径 FIGO 2018 ⅠB3/ⅡA2/ⅢCr期手术分期方法删除腹膜外或腹腔镜切除路径。
1.7 新增 存在远处转移的患者,如果原发灶已被控制,转移灶在1~5个者可考虑消融治疗(2B类)。
1.8 病理评估 不再考虑肿瘤侵犯水平宽度。
1.9 基因检测 建议对复发、进展或转移性患者进行MMR/MSI或PD-L1和(或)NTRK基因融合检测。
1.10 新增脚注 根据2018国际子宫颈腺癌标准和分类(IECC)定义的形态学特征(管腔有丝分裂和细胞凋亡)区分HPV相关和非相关腺癌。子宫颈腺癌浸润的组织学类型评估是一个新兴的概念,文献报道了3种具有临床意义组织学类型。A型浸润具有极好的生存率,且无淋巴结转移或复发(表现为边界清楚的腺体、圆形轮廓、无单个细胞、无间质增生反应、无淋巴脉管浸润)。
1.11 脚注修订 前哨淋巴结超分期通常需要对SLN进行连续切片,并复查多个HE染色切片,同时所有切片进行或不进行细胞角蛋白免疫组化染色。前哨淋巴结超分期尚无标准方法。
1.12 影像学评估 推荐对≥ⅠB1期的无生育要求患者进行正电子发射计算机断层显像(PET-CT)(首选)或胸部/腹部/盆腔CT或正电子发射磁共振成像(PET-MRI)检查。ⅠB1~ⅠB2保留生育功能患者行PET-CT(首选)或胸部/腹部/盆腔CT。
1.13 复发或转移性化疗 一线首选方案去除顺铂/紫杉醇、卡铂/紫杉醇、拓扑替康/紫杉醇/贝伐单抗、拓扑替康/紫杉醇,均列入其他推荐方案中。二线化疗新增:拉罗曲替尼或恩曲替尼可用于NTRK基因融合阳性肿瘤(2B类)。
1.14 ⅠB1、ⅠB2和ⅡA1 采用盆腔EBRT+近距离放射治疗±含铂同步化疗方案中删除(A点总剂量:80~85Gy)ⅠB3和ⅡA2期采用盆腔EBRT+同步放化疗”+近距离放射方案中删除(总A点剂量≥85Gy)。
1.15 同步化疗 顺铂加氟尿嘧啶不再推荐作为同步化疗方案。
1.16 细胞学复查 可用于检测下生殖道不典型增生及免疫功能低下患者,但其在预测复发尤其无症状患者的价值有限。
2 手术分期
采用2018国际妇产科联盟(FIGO)手术分期(详见本刊2019年第3期FIGO指南解读),影像学和手术病理评估均纳入分期。
3 手术原则
3.1 锥切和单纯子宫切除术(即筋膜外子宫切除术) 保留生育功能者,ⅠA1期淋巴脉管间隙无浸润可行锥切,切除部分子宫颈及子宫颈管组织。切缘至少有3mm的阴性距离。锥切切缘阴性是指无浸润性病变或高度鳞状上皮内病变,至少3mm阴性。推荐冷刀锥切,也可以采用环形电切术(LEEP),应尽量整块切除,保持标本的完整性。小心操作以减少电器械对组织边缘的影响。切除组织的形状和深度需与病灶大小、形状和病变部位相适应。位于子宫颈管的可疑浸润性腺癌与原位腺癌,锥切应设计成一个窄长锥形,延伸至子宫颈内口以避免遗漏子宫颈管病变。不保留生育功能者,经锥切确诊的ⅠA1期淋巴脉管间隙无浸润者可行单纯子宫切除术。ⅠA1期伴有淋巴脉管间隙浸润者,保留生育者可行锥切加前哨淋巴结显影。不保留生育按ⅠA2处理,行改良根治性子宫切除术加双侧盆腔淋巴结切除术(或前哨淋巴结显影)。
3.2 根治性子宫切除术加双侧盆腔淋巴结切除术(或前哨淋巴结显影) 是ⅠA2到ⅠB2及部分ⅠB3~ⅡA1期的首选治疗方法。相比筋膜外子宫切除术切除了更多宫旁组织,包括部分主韧带、宫骶韧带和阴道上段和盆腔淋巴结,必要时切除腹主动脉旁淋巴结。根治性子宫切除术的标准术式是开腹入路(1类)。前瞻性随机对照试验表明,微创根治性子宫切除术与开腹根治性子宫切除术相比,无病生存率(DFS)和总体生存率(OS)较低。此外,最近的2项研究还表明,对于ⅠA2~ⅠB1期子宫颈癌,微创根治性子宫切除术与开腹手术相比OS更低。QM分型描述了三维(3D)切除程度和神经保留,详见表1。
3.3 腹主动脉淋巴结切除 通常限于肠系膜下动脉(IMA)的水平。可根据临床和影像学结果调整手术范围。主动脉旁淋巴结受累与原发肿瘤>2cm、转移到髂总淋巴结密切相关。GOG 85,GOG 120和GOG 165的结果数据分析显示,对腹主动脉旁淋巴结阳性的患者来说,手术分期比影像学分期的预后更好。有研究提示在主动脉旁淋巴结受累患者中,将放射野延伸至主动脉旁区域有益,尤其是对于小的淋巴结转移的患者。正在进行比较手术还是影像分期评估主动脉旁淋巴结受累的临床研究,专家组建议对≥ⅠB1期患者进行主动脉旁淋巴结切除。
3.4 根治性子宫颈切除术 适用于ⅠA2到ⅠB1保留生育功能者。经阴道广泛子宫颈切除加腹腔镜下淋巴结切除(或前哨淋巴结显影)适用于经仔细筛选的ⅠA2期或ⅠB1期需要保留生育功能的患者。宫旁和阴道上段的切除范围同B型根治性子宫切除术,但保留子宫体。已报道有300多例妊娠,中孕流产率为10%,72%的患者可维持到孕37周或以上。经腹根治性子宫颈切除术与经阴道途径相比能切除更多的宫旁组织,适用于部分ⅠB1~ⅠB2期病例,手术范围类似C型根治性子宫切除术。
3.5 ⅡB期及以上的晚期病例 通常不采用手术治疗。大多数美国的晚期患者采用放化疗。在有些国家,部分ⅡB期病例可能首选根治性子宫切除术或新辅助化疗后进行根治性子宫切除术。
3.6 放疗后盆腔中心性复发或病灶持续存在者 采用盆腔器官廓清术仍有治愈的可能。术前需明确是否存在远处转移。如复发局限于盆腔,可进行手术探查。未侵犯盆壁及淋巴结者可切除盆腔器官。根据肿瘤的位置采用前后或全盆腔器官廓清术。若有足够的手术切缘,可保留盆底肌肉和肛门括约肌。表2总结了盆腔器官廓清术的不同类型及切除范围。盆腔器官廓清术很少用于初治,仅用于不宜盆腔放疗或因既往患有其他疾病,已接受过盆腔放疗或局部晚期子宫颈癌不适合盆腔放疗的患者。

3.7 前哨淋巴结显影 该技术已经被应用于经选择的Ⅰ期宫颈癌患者手术程序中。前瞻性研究结果支持在早期子宫颈癌患者中检测SLN的可行性,并建议在大部分早期病例中可以安全地避免系统的盆腔淋巴结切除。尽管SLN可用于病灶直径达4cm的患者,但肿瘤直径<2cm时的检测率和显影效果最好。操作时可直接在宫颈的3和9点或3、6、9、12点位置注射染料或放射性胶体99Tc。通过注射吲哚菁绿(ICG)者用荧光摄像头显影;注射99Tc者使用γ探测器探测;注射染料者直接肉眼观察,从而在术中识别前哨淋巴结。前哨淋巴结通常位于髂外血管内侧、侧脐韧带外侧或闭孔窝上部。前哨淋巴结通常由病理学家进行超分期,从而可以更高程度地检测可能会改变术后处理的微转移。关键技术是严格按照以下检测流程:切除所有显影的淋巴结(这些淋巴结如HE染色无转移,病理专家需采用更高级的检测技术)→切除任何可疑淋巴结(不论有无显影)→一侧没有显影淋巴结时,切除该侧淋巴结→肿瘤和宫旁组织整块切除。这些结果可为术后的辅助治疗提供依据。Meta分析结果显示89%~92%的SLN检测率和89%~90%的灵敏度。Ⅲ期临床试验表明,采用ICG能识别出比蓝色染料更多的SLN(总体和双侧)。
4 放射治疗原则
放疗是局部晚期、晚期和不能耐受手术者的最佳治疗方法,以及根治性子宫切除术后的辅助治疗方法。
4.1 一般原则 CT为基础的治疗计划和适形挡块是外照射(盆腔外照射)的标准。MRI是判断晚期肿瘤患者软组织和宫旁浸润最好的方法。PET则有助于确定不能手术的子宫颈癌患者淋巴结转移范围和术后患者是否有淋巴结残留。近距离放疗是所有不适合手术的原发子宫颈癌患者的根治性治疗中的关键部分,通过腔内±和(或)组织间插植的方式实施。对于大多数接受盆腔外照射的子宫颈癌患者,放疗期间予同期含铂方案化疗,8周内完成治疗效果最佳。
4.2 一般治疗信息 靶体积:适形放疗中已定义了关于大体肿瘤体积(GTV),临床靶体积(CTV),计划靶体积(PTV),危及器官(OARs),内部器官运动,以及剂量-体积直方图(DVH)等用于适形放疗,特别是调强放疗(IMRT)中。特别注意细节和可重复性(包括考虑靶区和正常组织定义、患者和内部器官运动、软组织变形,以及严格的剂量学和物理质量保证,这些对于正确地实施IMRT和相关的高度适形技术是必要的。常规的图像引导,如锥形束CT(CBCT),应该用于每天判断内部软组织运动。盆腔外照射EBRT应该包括大体肿瘤(如果有)、宫旁、宫骶韧带以及距大体肿瘤足够的阴道范围(至少3cm)、骶前淋巴结以及其他危险的淋巴结区域。对于手术及影像学阴性淋巴结的患者,照射范围应该包括髂内外、闭孔和骶前淋巴结区域以及盆腔。对于认为淋巴结转移的更高危的患者(大肿瘤;可疑或确定为低位真骨盆区域淋巴结),放射治疗区域需升高到包括髂总淋巴结区域。对于确定为髂总和或腹主动脉旁区域淋巴结,建议盆腔扩大野和腹主动脉旁淋巴结区域照射,直到肾血管水平,或者根据累及的淋巴结范围向头侧扩展。对于下1/3阴道侵犯的患者,放射区域需要包括双侧腹股沟区。盆腔外照射是提供多个适形照射野或者实施调强容积技术,如IMRT/VMAT/Tomotherapy。IMRT有助于减少术后照射区域和必要时照射腹主动脉旁淋巴结区域时减少肠道和其他关键器官的剂量。这些技术在需要更高剂量治疗淋巴结引流区域有阳性淋巴结时也非常有用。然而,适形外照射技术(如IMRT或者立体定向放射治疗,SBRT)不能常规作为有完整子宫患者的中心病变的近距离放疗的替代治疗。在完成初始全盆腔照射后,对于有宫旁侵犯/盆壁侵犯的选择性的病例可补充宫旁5~10Gy。IMRT可计划给予大的阳性淋巴结更高剂量,而同时给其他对应的微浸润更低的剂量,这就叫做同时补量(SIB)。运用IMRT结合SIB可在更短时间范围内予大的阳性淋巴结更高剂量,同时避开正常组织。总的说来,一个SIB靶区可以加量至约2.1~2.2Gy/次,这依据靶区及危及器官的体积而定。外照射加量经常是必要的,淋巴结靶区剂量是54~63Gy,需要特别注意近距离放疗对靶区的贡献,在评估邻近正常组织剂量时要慎重考虑正常组织剂量。SBRT是一种可以对盆腔外照射以1~5次实施非常高剂量照射的方式,可用于独立的转移灶。可以考虑运用于再照射区域内局限性的病变。
4.3 放疗剂量 覆盖微小淋巴结病变的剂量需要外照射剂量约40~45Gy(每天按传统分割1.8~2.0Gy,可能IMRT方式时SIB),可给予未切除的局限性的大的淋巴结病变予高度适形的额外推量10~20Gy,但需考虑近距离放疗对这部分的剂量贡献。对于大多数接受盆腔外照射的子宫颈癌患者,在放疗期间给予同期含铂方案化疗。
4.4 初治病例的根治性放疗 没有接受手术有完整子宫的患者,原发肿瘤及有转移风险的区域淋巴结通常给予根治性盆腔外照射至大约45Gy(40~50Gy)。盆腔外照射的体积要根据手术中或者放射影像学上淋巴结的状况来决定。接着用近距离放疗推量原发宫颈肿瘤,用图像引导(首选)推量30~40Gy或者至A点 [低剂量率(LDR)相当的剂量],使小肿瘤的A点总剂量达到80Gy,或者大肿瘤的A点≥85Gy。对于非常小的肿瘤(如可手术ⅠA1或ⅠA2),EQD2 D90的剂量可考虑为75~80Gy。大体上不可切除的淋巴结可通过高度适形的(或者减少体积的)盆腔外照射予额外推量10~15Gy。对于图像引导的盆腔外照射时使用更高剂量,特别EBRT时,必须注意避开正常组织或者严格限制正常组织剂量。通常建议标准分割的IMRT剂量为45~50Gy。
4.5 子宫切除术后的辅助放疗 子宫切除术后病理学检查发现高危或中危因素时需补充术后辅助放疗。放射野至少需包括阴道断端下3~4cm、宫旁组织和邻近的淋巴结引流区(如髂内、外淋巴结区)。如有淋巴结转移时,放射野的上界还需要相应延伸。大的不可切除的淋巴结可通过高度适形的(或者减少体积的)盆腔外照射予额外推量10~15Gy。对于未切除的大淋巴结病变应该用高度适形的盆腔外照射额外推量10~20Gy。盆腔外照射时使用更高剂量,必须注意避开或者严格限制正常组织(在高剂量区域)剂量。
4.6 术中放疗(intraoperative radiation therapy,IORT) IORT是指在开腹手术时,对有肿瘤残留风险的瘤床或无法切除的孤立残留病灶进行单次大剂量放疗。尤其适合放疗后复发的病例。IORT时,可将高危区域内的正常组织移开。IORT通常使用电子线,可根据风险区域的大小选择不同的施用器来限制照射的面积和深度,避免周围正常组织接受不必要的照射。
4.7 近距离放疗及剂量 近距离放疗是所有不适合手术的原发子宫颈癌根治性治疗的关键部分。通常采用宫腔内和阴道施源器。根据患者及肿瘤解剖状态,有完整子宫的患者近距离放疗的阴道部分使用卵圆形、环状或者圆柱状施源器(结合宫腔内施源器)。对于更晚期患者或者没有足够退缩者,组织间插植使得提高靶区剂量并且最大限度减小正常组织剂量成为可能。近距离放疗后立即行MRI检查有助于勾画残留肿瘤形状。近距离放疗通常安排在外照射后,因足够的原发肿瘤退缩可以得到更满意的近距离放疗施源器形状。对于仔细选择的、非常早期的患者(如ⅠA2),单纯近距离放疗(无盆腔外照射)也可作为一种选择。少数近距离放疗无法进行者可使用个体化插植。在选择性的术后患者(特别是那些有阳性或者手术切缘接近阴道黏膜的),阴道圆柱状施源器可以作为盆腔外照射的补量。经典的分割计划是阴道黏膜表面或者黏膜下5mm处5.5Gy×2次或者阴道黏膜表面6Gy×3次。SBRT不能常规作为近距离放疗的替代治疗。A点代表宫旁参考点,经典的A点剂量是早期患者5.5Gy×5次,大肿瘤或者那些确定治疗反应不佳的患者是6Gy×5次。治疗的目标应该包括对于高危CTV(HR-CTV)相对2Gy的等效剂量(EQD2)是D90为80~85Gy;但是对于大肿瘤或者治疗反应不佳的剂量目标是HR-CTV D90≥87Gy。正常组织限量应该根据已公布的指南来施行:2-cc直肠剂量≤65~75Gy,乙状结肠2-cc剂量≤70~75Gy,和2-cc膀胱剂量≤80~90Gy。如果不能达到这些参数,可以考虑组织间插植作为补充剂量。建议的盆腔外照射剂量是按1.8~2.0Gy/(次·d)的分割方式。对于近距离放疗,设定A点剂量是按40~70cGy/h的实施的LDR。临床医生使用高剂量率近距离放疗要根据线性2次模型将HDR剂量转换为生物学上LDR等效剂量(http://www.americanbrachytherapy.org/guidelines/)。结合盆腔外照射时有多种近距离放疗治疗方案。但是,最常用的HDR是5次插入宫腔和阴道近距离放疗,每次6Gy。这个方案是5次HDR为30Gy,相当于LDR时A点的等效剂量40Gy(肿瘤替代剂量)。另外,一个合理的选择是在欧洲经过深度研究的高危CTV区域28Gy/4F。
5 全身治疗(化疗)原则
5.1 同期放化疗 药物一般采用顺铂单药,不耐受者可采用卡铂。
5.2 一线联合化疗 顺铂一直被认为是转移性子宫颈癌最有效的药物。以顺铂为基础的联合方案如顺铂+紫杉醇+贝伐单抗(证据等级1)、顺铂+紫杉醇(证据等级1)、顺铂+拓扑替康(证据等级2A)已广泛用于临床研究。联合方案反应率、无进展生存期均优于顺铂单药。美国食品和药物管理局(FDA)已经批准顺铂/拓扑替康用于晚期子宫颈癌。顺铂+紫杉醇联合或卡铂+紫杉醇联合方案因毒性较低更易于管理。GOG204对4种顺铂双药方案(顺铂+紫杉醇,顺铂+拓扑替康,顺铂+吉西他滨,顺铂+长春瑞滨)进行了比较,顺铂+紫杉醇优于其他方案,而且血小板减少症和贫血症发生率更低。GOG 240研究了含贝伐单抗的联合化疗方案(顺铂+紫杉醇+贝伐单抗或拓扑替康+紫杉醇+贝伐单抗)。接受贝伐单抗的患者总生存期有改善。虽然贝伐单抗导致了更高的毒性(例如:高血压、血栓栓塞事件和胃肠瘘),但未导致具有统计学意义的生存质量的降低。含贝伐单抗在内的联合用药是治疗持续性、复发性或转移性子宫颈癌的首选方案。
日本临床肿瘤研究组(JCOG)0505Ⅲ期临床研究结果显示,卡铂+紫杉醇(证据等级2A)较顺铂+紫杉醇用于转移或复发性子宫颈癌的总生存期相当而且具有更好的耐受性,便于毒性反应的管理。但在之前未接受过铂类药物的患者中,TP方案(紫杉醇+顺铂)的总生存期高于TC方案(紫杉醇+卡铂)。因此,NCCN专家组推荐卡铂+紫杉醇可作为先前接受过顺铂治疗的患者的首选。专家组将顺铂/吉西他滨从一线化疗去除。非铂化疗尚处于研究中,通常用于铂不耐受患者。
5.3 单药化疗 顺铂是最有效的化疗单药,被推荐作为一线单药治疗复发或转移性子宫颈癌患者。对于无法接受手术或者放射治疗的复发患者,顺铂、卡铂或紫杉醇都是合理的一线单药方案。
5.4 二线化疗的药物包括 帕姆单抗(用于PD-L1阳性或MSI-H/dMMR肿瘤)、贝伐单抗、白蛋白紫杉醇、多西他赛、5-FU、吉西他滨、异环磷酰胺、伊立替康、丝裂霉素、拓扑替康、培美曲塞和长春瑞滨。
5.5 其他药物 靶向治疗和生物制剂在特定病例中具有明确作用。使用这类药物仍然需要更多的临床研究数据支持。
6 影像学检查原则
除了胸部CT不要求增强,指南中提及的MRI及CT均为增强检查,除非有禁忌证。
6.1 初始检查影像学检查推荐
6.1.1 Ⅰ期 非保留生育功能者考虑胸部平片,若有异常,则行CT平扫检查;可选择性行MRI检查以评估局部病灶范围,特别是ⅠB2~ⅠB3期。B1期及以上建议全身PET-CT或胸部/腹部/盆腔CT检查;全子宫切除术后意外发现子宫颈癌的患者考虑行全身PET-CT或胸部/腹部/盆腔CT检查以评估转移情况,行盆腔MRI评估盆腔残留病灶;保留生育功能者考虑胸部平片,若有异常,可行CT平扫检查。首选盆腔MRI以评估测量病灶范围以及病灶和子宫颈内口的距离。不适宜MRI检查者用经阴道超声检查。ⅠB1~ⅠB2期考虑行全身PET-CT(首选)或胸部/腹部/盆腔CT检查。根据临床症状及可疑转移病灶可选择其他影像学检查进行诊断。
6.1.2 Ⅱ~Ⅳ期 全身PET-CT或胸部/腹部/盆腔CT检查以评估转移情况;盆腔MRI增强检查评估局部病灶范围;根据临床症状及可疑转移病灶选择其他影像学检查进行诊断;全子宫切除术后意外发现子宫颈癌的患者考虑全身PET-CT或胸部/腹部/盆腔CT检查以评估转移情况,行盆腔MRI评估盆腔残留病灶。
6.2 随访时影像学检查推荐
6.2.1 Ⅰ期 非保留生育功能患者的影像学检查选择应根据临床症状及复发/转移而决定;ⅠB3期患者或术后有高/中危因素接受辅助放疗及放化疗的患者,在治疗结束3~6个月后可行全身PET-CT检查;保留生育功能者术后6个月考虑行盆腔MRI平扫+增强检查,之后的2~3年间每年1次;若怀疑复发,根据临床症状及复发/转移选择其他影像学检查。
6.2.2 Ⅱ~Ⅳ期 治疗结束后3~6个月内行全身PET-CT检查(首选)或胸部/腹部/盆腔CT平扫+增强检查;治疗结束后3~6个月后选择性行盆腔MRI平扫+增强检查;根据临床症状及复发/转移选择其他影像学检查。Ⅳ期患者根据症状或下一步处理决策选用相应的检查方法。可疑复发转移者均建议PET-CT及选用MRI。
7 各期子宫颈癌的初始治疗方法
ⅠA期子宫颈癌需经锥切诊断。首选冷刀锥切,LEEP也可接受,只要获得足够的切缘和整块切除,有适应证者加子宫颈搔刮术(ECC)。早期鳞癌卵巢转移发生率低,<45岁的绝经前患者可选择保留卵巢。前哨淋巴结显影在肿瘤直径<2cm者检出率和准确性最高。
7.1 保留生育功能 推荐用于<2cm的鳞癌,普通腺癌并非绝对禁忌。目前尚无数据支持小细胞神经内分泌肿瘤、胃型腺癌(即微偏腺癌或恶性腺癌)等病理类型的患者保留生育功能。也不推荐伴有高危和中危因素的患者保留生育功能。生育后是否切除子宫由患者和医生共同确定,但强烈建议术后持续性异常pap涂片或HPV感染的患者在完成生育后切除子宫。建议咨询生殖内分泌专家。
7.1.1 ⅠA1期无淋巴脉管间隙浸润 该期淋巴结转移率<1%,不需要切除淋巴结。建议先锥切。如锥切切缘阴性,术后可随访观察。如切缘阳性,建议再次锥切或行子宫颈切除术。
7.1.2 ⅠA1期伴淋巴脉管间隙浸润和ⅠA2期 可选择:(1)锥切+盆腔淋巴结切除,可考虑行前哨淋巴结显影。锥切切缘阴性者术后随访观察。切缘阳性者,再次锥切或行子宫颈切除术。(2)直接行根治性子宫颈切除术+盆腔淋巴结切除,可考虑行前哨淋巴结显影。
7.1.3 ⅠB1和选择性ⅠB2期 根治性子宫颈切除术+盆腔淋巴结切除±主动脉旁淋巴结切除,可考虑行前哨淋巴结显影。保留生育功能原则上推荐选择肿瘤直径≤2cm者,可选择经阴道或经腹行根治性子宫颈切除术。肿瘤直径2~4cm者,推荐行经腹根治性子宫颈切除术。
7.2 不保留生育功能
7.2.1 ⅠA1期无淋巴脉管间隙浸润 先锥切诊断。锥切切缘阴性并有手术禁忌证者,可观察随访。无手术禁忌证者行筋膜外子宫切除术。切缘阳性者最好再次锥切以评估浸润深度排除ⅠA2/ⅠB1期。不再次锥切直接手术者,切缘为HSIL行筋膜外全子宫切除,切缘为癌者行改良根治性子宫切除术+盆腔淋巴结切除术(淋巴切除证据等级2B),可考虑行前哨淋巴结显影。
7.2.2 ⅠA1期伴淋巴脉管间隙浸润和ⅠA2期 可选择:(1)改良根治性子宫切除术+盆腔淋巴结切除术,可考虑行前哨淋巴结显影。(2)有手术禁忌证或拒绝手术者,可盆腔外照射+近距离放疗。
7.2.3 ⅠB1/ⅠB2和ⅡA1期 可选择:(1)根治性子宫切除术+盆腔淋巴结切除(证据等级1 )±主动脉旁淋巴结切除(证据等级2B),可考虑行前哨淋巴结显影。(2)有手术禁忌证或拒绝手术者,盆腔外照射+阴道近距离放疗±含铂的同期化疗。
7.2.4 ⅠB3和ⅡA2期(不手术者见7.2.6) 可选择:(1)根治性盆腔外照射+含铂同期化疗+阴道近距离放疗(同期放化疗证据等级1)。(2)根治性子宫切除术+盆腔淋巴结切除±主动脉旁淋巴结切除(证据等级2B)。(3)盆腔外照射+含铂同期化疗+近距离放疗+辅助性子宫切除术(证据等级3)。
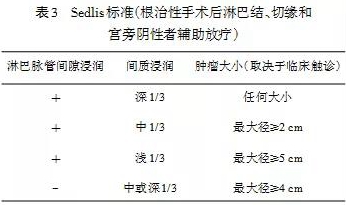
7.2.5 术后辅助治疗 初治子宫颈癌手术指征推荐限于≤ⅡA2期,接受初治手术者术后辅助治疗取决于手术发现及病理分期。“高危因素”包括淋巴结阳性、切缘阳性和宫旁浸润。具备任何一个“高危因素”均推荐进一步影像学检查以了解其他部位转移情况,然后补充盆腔外照射+含铂同期化疗(证据等级1)±近距离放疗。中危因素(肿瘤大小、间质浸润、淋巴脉管间隙阳性)按照“Sedlis标准”(证据等级1)(见表3),补充盆腔外照射±含铂同期化疗(同期化疗证据等级2B)。但中危因素不限于Sedlis标准,如腺癌和肿瘤靠近切缘等。最近的研究提示腺癌淋巴结转移的预测因素可能与鳞癌不同。子宫颈间质侵犯的模式和是否存在LVSI比原发肿瘤大小更能预测淋巴结转移的风险。因此提出了腺癌采用新的间质侵袭模式替代FIGO分期系统,但有待临床进一步验证。
主动脉旁淋巴结阳性者先行影像学检查以了解其他部位的转移。如无远处转移者行延伸野外照射+含铂同期化疗±阴道近距离放疗。影像学发现远处转移者,对有指征的疑似部位进行活检,活检阴性者行延伸野外照射+含铂同期化疗±阴道近距离放疗,活检阳性者进行系统治疗加个体化外照射。
7.2.6 部分ⅠB3/ⅡA2期(选择手术者见7.2.4)和ⅡB~ⅣA 可选择影像学分期或手术分期(手术分期2B类证据)。
7.2.6.1 影像学分期 淋巴结阴性,行盆腔外照射+含铂同期化疗+阴道近距离放疗(证据等级1);若CT、MRI和(或)PET等分为ⅢCr期,盆腔淋巴结阳性/主动脉旁淋巴结阴性,即ⅢC1r者,可选择:(1)盆腔外照射+阴道近距离放疗+含铂同期化疗(证据等级1)±主动脉旁淋巴结放疗。(2)腹主动脉旁淋巴结手术分期(术后可行影像学检查确认切除效果),阴性者即ⅢC1p行盆腔外照射+含铂同期化疗+阴道近距离放疗(证据等级1);主动脉旁淋巴结阳性者即ⅢC2p期,行延伸野放疗+含铂同期化疗+阴道近距离放疗。影像学检查发现盆腔淋巴结和主动脉旁淋巴结均阳性即ⅢC2r者,行延伸野放疗+含铂同期化疗+阴道近距离放疗。影像学检查发现有远处转移并有临床指征经活检证实转移者,行全身化疗±个体化放疗。远处转移局限于锁骨上淋巴结者,可以选择根治性治疗。如果原发灶已被控制,转移灶在1~5个者可考虑消融治疗(2B类)。
7.2.6.2 手术分期 是指切除腹膜后淋巴结,根据术后病理确定下一步治疗方案:(1)淋巴结阴性者,行盆腔外照射+含铂同期化疗+阴道近距离放疗(证据等级1)。(2)淋巴结阳性者,ⅢC1p期即盆腔淋巴结阳性、主动脉旁淋巴结阴性,盆腔外照射+含铂同期化疗+阴道近距离放疗(证据等级1);ⅢC2p期即主动脉旁淋巴结阳性者,需根据临床指征补充进一步的影像学检查以排除更广泛的转移。确定无其他远处转移时,行延伸野外照射+含铂同期化疗+阴道近距离放疗。影像学检查发现有更远处的转移,有临床指征者在可疑处活检,活检阴性者行延伸野外照射+含铂同期化疗+阴道近距离放疗,活检阳性者行全身治疗±个体化放疗。
7.2.7 ⅣB期或远处转移 (1)若适合局部治疗,可考虑局部切除±个体化放疗,或局部消融治疗±个体化放疗,或个体化放疗±全身系统治疗,也可考虑辅助性系统性治疗。(2)不适合局部治疗者,全身系统性治疗或支持治疗。
7.3 单纯筋膜外子宫切除术后意外发现的浸润性子宫颈癌 经病理复核确认的ⅠA1期无淋巴脉管间隙浸润者,可随访观察。ⅠA1期伴淋巴脉管间隙浸润或ⅠA2/ⅠB1期或切缘阳性或有病灶残留者,先完善病史、体格检查、血常规(含血小板)和肝肾功能检测及影像学检查。(1)切缘及影像学检查均阴性者,可选择盆腔外照射+近距离放疗±含铂同期化疗。对于已切除的子宫病理无Sedlis标准所述的危险因素者可行宫旁广泛切除加阴道上段切除+盆腔淋巴结切除±主动脉旁淋巴结取样(主动脉旁淋巴结取样为2B类证据)。术后淋巴结阴性且无残余病灶者可以观察。术后淋巴或切缘或宫旁阳性者,行盆腔外照射(若主动脉旁淋巴结阳性加主动脉旁区放疗)+含铂的同期化疗(1类证据)±个体化近距离放疗(阴道切缘阳性者)。(2)初次手术切缘为癌,存在残留病灶、影像学检查阳性或肿瘤特征符合Sedlis标准者,按前面ⅢCr期所述初治方法处理。
7.4 妊娠合并子宫颈癌 妊娠合并妇科恶性肿瘤中,最常见是子宫颈癌。大多数为Ⅰ期患者。选择延迟治疗直至胎儿成熟还是立即接受治疗是患者和医生必须做出的困难选择。推迟治疗直至胎儿成熟的患者应该接受剖宫产,并可在剖宫产的同时行根治性子宫切除术和盆腔淋巴结切除术。根治性子宫颈切除术已在部分早期子宫颈癌患者中成功实施。对那些选择放疗的患者,传统的放疗±化疗需要做适当调整。
8 随访
建议治疗后2年内每3~6个月随访1次,第3~5年每6~12个月1次,5年后每年1次。高危患者应缩短随访间隔(如第1~2年每3个月1次),低危患者可以延长(如6个月1次)。至少每年进行1次子宫颈(保留生育功能)或阴道细胞学检查。随访时需进行仔细的临床评估,教育患者了解复发的早期症状,如阴道排液、体重减轻、厌食,盆腔、髂关节、背部或腿部疼痛等。鼓励患者戒烟或减少吸烟。随访过程中不需常规进行影像学检查,有症状或怀疑复发时可选用。复发病例在治疗前需经病理证实。对于肿瘤未控或复发者,治疗前需要进一步的影像学检查或手术探查来评估病情。
9 复发性子宫颈癌的治疗
复发子宫颈癌的治疗包括放疗±化疗或手术。局部复发的病例,如果初治没有接受放疗或者复发部位在原来放射野之外,能切除者可以考虑手术切除后继续个体化外照射±全身化疗±近距离放疗。放疗后中心性复发者可考虑盆腔器官廓清术±术中放疗(IORT)(证据等级3)。中心性复发病灶直径≤2cm的病例,经仔细选择也可以考虑行根治性子宫切除术或近距离放疗。对于非中心性复发者,可选择个体化外照射±全身化疗或手术切除±术中放疗或全身系统性治疗。再次复发的患者选择化疗或支持治疗。
10 讨论
新版指南给我们提供了几个重要的信息,对今后的临床实践具有重要的指导意义:
10.1 明确提出开腹手术是早期子宫颈癌根治性子宫切除术的标准手术方式 指南明确推荐微创手术仅限于筋膜外子宫切除术,即QM分型的A型手术。改良根治性和根治性子宫切除术,即QM分型的B型和C1型手术均推荐开腹手术。同时,鉴于目前已经获得了足够多的证据,不再鼓励进行微创手术和开腹手术对比的临床研究。虽然因为目前缺乏保留生育功能根治性子宫颈切除术的微创手术和开腹手术对比的Ⅰ级证据,NCCN指南在根治性子宫颈切除术中仍保留微创手术选项,但同时指出微创手术缺乏生存结果证据。从临床经验判断,根治性子宫颈切除术对术者的技术要求更高,“逸仙妇瘤”推荐针对ⅠA2和ⅠB1期的根治性子宫颈切除术选择经阴道或开腹,ⅠB2期选择开腹手术。值得提出的是,指南没有明确推荐QM分型的C2和D型的手术方式,不等于对这两类手术推荐微创手术方式。因为NCCN指南是以证据为依据的指南,无证据者一般不会提出推荐建议。从临床角度,C2和D型的手术方式也应该选择开腹。
对于有腔镜情结的中国医生而言,接受NCCN的观点非常困难。对LACC研究持怀疑态度还大有人在,我们还在热衷于开展废除举宫器、闭合式切阴道、加强无瘤观念等改进腔镜技术的临床研究。
实际上,自LACC发表后,在全球医学界产生重大影响,2019年第3版美国子宫颈癌NCCN 指南、欧洲ESGO的最新声明都指出子宫颈癌根治性子宫切除术“开腹方式是金标准”。美国临床妇产科协会、ASCO 杂志、英国妇科肿瘤学会也认同微创比开腹生存率更差的观点。韩国、美国阿拉巴马、阿根廷、加拿大多中心研究也显示类似的观点。大量的研究支持LACC“微创手术比开腹手术具有更差的肿瘤学预后”的结论。改进腔镜技术如上述提到的措施能否降低复发率尚未可知。所以,我们不应该还停留在“微创”和“开腹”之争,而是应该把注意力转移到如何提高开腹手术水平这方面来。
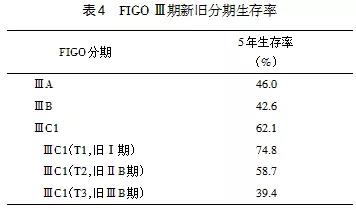
10.2 新版指南对ⅢC期的处理 分别按ⅢCr,ⅢCp提出了明确的指引(详见7.2.6)。随着2018 FIGO子宫颈癌新分期的推广使用,临床上相应出现了一些疑惑。新分期引入了手术病理分期和影像学分期是一大进步,但该分期系统还有待完善,主要的问题集中在ⅢC期上。按照新分期,不管子宫颈病灶大小和宫旁浸润情况如何,只要有淋巴结转移均归为ⅢC显然是不合理的。表4是发表于2019年Gynocologic Oncology的关于Ⅲ期子宫颈癌生存率资料的总结,从表中数据可以看出ⅢC期的预后和宫颈病灶大小和宫旁浸润情况密切相关。对于这部分患者,新版指南全部推荐放疗是值得商榷的。因为在这部分患者中,按旧分期多数属于ⅠA2~ⅡA2期伴有淋巴结转移,以往的处理可选择放疗或手术。在中国,选择手术者远多于选择放疗。究竟是选择手术+放疗还是不手术直接放疗好,还需要更多、更高质量的前瞻性临床研究加以证实。
10.3 腹主动脉旁淋巴结切除 由于子宫颈癌淋巴结阶梯式转移的理念深入人心,早期子宫颈癌是否切除腹主动脉旁淋巴结常被忽视。主动脉旁淋巴结受累与原发肿瘤>2cm、转移到髂总淋巴结密切相关。腹主动脉淋巴结切除另一意义在于指导术后是否延伸放射野。因此,对于主动脉旁淋巴结阳性或子宫颈肿瘤病灶直径超过2cm,髂总淋巴结有转移者,指南推荐常规做主动脉旁淋巴结切除。需要提醒的是,子宫颈癌主动脉旁淋巴结的切除范围不需要像卵巢癌和子宫内膜癌那样达到左肾静脉,只需达到肠系膜下动脉水平即可。NCCN专家组建议对≥ⅠB1期患者进行主动脉旁淋巴结切除的推荐似乎有过度手术之嫌,也没有高质量的证据支持这一推荐。以往多数专家推荐的是对IB3/ⅡA2期才常规切除主动脉旁淋巴结。
10.4 ⅠB3期的处理 一直存在争议。指南3种推荐中,首选同期放化疗。对于选择直接手术者,建议切除主动脉旁淋巴结。也有专家认为应首先进行盆腔淋巴结切除,如果淋巴结阴性,继续行根治性子宫切除术。如果淋巴结阳性,则应放弃子宫切除而接受放化疗,这种做法需要术前就进行充分的医患沟通,否则易诱发医患矛盾。同期放化疗之后进行辅助性子宫切除术的做法存在重大分歧。该做法可减少盆腔复发、但不改善总生存率,且增加并发症,故只适用于放疗结束后仍有肿瘤残留或病灶或子宫增大超出近距离放疗所能达到的放疗区域的患者。至于新辅助化疗后再手术,一直存在争议,支持和否定的研究并存。NCCN指南一直不推荐子宫颈癌的新辅助化疗。FIGO指南也推荐新辅助化疗仅用于缺乏放疗设备的地区和开展临床试验。
10.5 子宫颈腺癌淋巴结转移的预测因素 最近的研究结果表明,子宫颈腺癌淋巴结转移的预测因素可能与鳞癌不同。宫颈间质侵犯的模式和LVSI相比原发肿瘤更有利于预测淋巴结转移的风险。指南提出腺癌可依据间质侵犯类型替代FIGO分期。指南提到的腺癌分类系统指的是Silva分型,该分型以组织形态学为分类基础,以浸润方式代替浸润深度,能较准确预测淋巴转移风险,但其有效性仍有待临床进一步验证。
10.6 复发和转移性宫颈癌的一线化疗方案 增加了贝伐单抗方案,二线化疗新增拉罗曲替尼或恩曲替尼,可用于NTRK基因融合阳性肿瘤(2B类)。推荐患者进行MMR/MSI或PD-L1和(或)NTRK基因融合检测,免疫治疗和抗血管生成药物将是今后晚期、复发子宫颈癌的应用热点。(2020-02-01收稿)
 妇产科在线APP下载
妇产科在线APP下载













