全球约85%的宫颈癌发生在不发达(也称为中低收入)国家,占当地女性癌症的12%。87%宫颈癌导致的死亡也发生在这些地区。不同区域宫颈癌的发生率和病死率存在巨大差异,部分原因是大规模筛查和一级预防普及程度不同造成。鉴于不同地区卫生资源差异巨大,美国临床肿瘤协会(ASCO)2016年10月公布了资源分层的全球宫颈癌二级预防临床实践指南,提供不同资源水平(即基本、有限、较高、最大资源)地区宫颈癌筛查和异常筛查结果管理的最佳方案,为临床医生、公共卫生系统、政策制定者和非专业人士提供宫颈癌筛查专业指引(见表1)。现简要介绍如下。

1主要建议
1.1 初筛 推荐均进行人乳头瘤病毒(HPV)DNA检测。在基本资源地区可以使用醋酸试验(VIA)。
不同资源中推荐的年龄范围和筛查频率如下:最大资源:25~65岁,每5年1次;较高资源:30~65岁,每5年1次,如果连续2次阴性,则每10年1次;有限资源:30~49岁,每10年1次;基本资源:30~49岁,一生中1~3次。终止筛查年龄:最大和较高资源:≥65岁,在过去≥15年内持续阴性结果;有限和基本资源:≤49岁,依赖资源情况。
1.2 分流 基本资源地区,可以对HPV DNA检测阳性患者采用肉眼评估。如果用醋酸试验作为初筛,发现异常结果应接受治疗。对于其他资源地区,可以使用HPV基因分型和(或)细胞学筛查进行分流。
1.3 分流后 结果阴性者在12个月复查;在基本资源地区,分流结果异常或阳性应直接进行治疗;在有限资源地区,分流结果异常应接受阴道镜检查(如果有)或肉眼评估;在最大和较高资源地区,分流异常或阳性结果的女性应接受阴道镜检查。
1.4 癌前病变的治疗 在基本资源地区,可选择冷冻或电环切术(LEEP);在其他情况下,如有高质量水平保证,推荐采用LEEP或存在LEEP禁忌情况下建议消融;建议对所有患者在治疗后12个月进行随访。
1.5 特殊人群 感染人类免疫缺陷病毒(HIV)或免疫抑制的妇女应接受HPV筛查,筛查次数为普通人群的2倍;HIV病毒感染者的筛查结果异常的管理以及分流的阳性结果处理与普通人群相同;在基本资源地区妇女应在产后6周进行初筛,其他资源地区在产后6个月进行;因良性疾病接受全子宫切除术并无宫颈上皮内瘤变或HPV病史的妇女可以中止筛查。已接受子宫次全切除术(有完整的子宫颈)的妇女应继续接受常规筛查。
2相关背景
宫颈癌筛查的主要目的是在群体水平准确检测和及时治疗宫颈上皮内瘤变从而预防宫颈癌的发生。筛查的益处包括发现早期宫颈癌,使其发病率和病死率下降。许多低资源地区缺乏治疗浸润性宫颈癌的手术和放疗设施。因此,ASCO专家小组制定了本指南,强调在发生浸润癌之前及时检测和治疗宫颈癌前病变。
HPV几乎导致了所有的宫颈癌及其癌前病变。高质量的筛查计划可以降低宫颈癌的发病率高达80%。过去30年,在高资源地区,筛查已经降低了宫颈癌发病率。
2013年和2014年,世界卫生组织(WHO)发布了适用于所有环境条件的妇女的筛查和癌前病变治疗指南;本指南加强了这些建议。WHO和本指南涉及的筛查方法包括细胞学(也称为Papanicolaou或Pap测试),肉眼观察(例如VIA肉眼观察)和HPV DNA检测。WHO指南提及阴道镜用于评价阳性结果和推荐LEEP和消融用于治疗。筛查方法可以单独或联合使用。ASCO指南同时涉及了疫苗接种时期筛查、自我取样和新兴的筛查技术。在一些已经形成大规模筛查的区域,细胞学是主要的筛查模式;有些区域增加HPV DNA联合检测。一些国家和地区正在或已经接受将HPV DNA检测或VIA肉眼观察作为主要的筛查方法。在低资源地区,由于病理学家和实验室缺乏限制了传统筛查项目的开展。因此,HPV DNA检测与细胞学检测相比更合适。随着接种HPV疫苗越来越广泛,HPV感染率将降低。接种预防性HPV疫苗可能是预防宫颈癌的终极策略。但是疫苗不能治疗接种前的感染和已产生的病变。此外,二价和四价HPV疫苗对宫颈癌只提供部分保护。
宫颈癌前病变的诊断按严重程度分为:阴性或宫颈上皮内瘤变(CIN)1级(CIN 1),2级(CIN 2),或3级(CIN 3)。其他异常结果包括非典型鳞状细胞(ASC),未确定意义的ASC(ASC-US)和原位腺癌(AIS)。在本指南中,癌前病变术语是指CIN 2或以上(≥CIN 2),定义为CIN 2,CIN 3或AIS。大多数CIN 1在6年内退化,不再视为癌前病变。有些CIN 2实际上是CIN 1或HPV感染,因此,CIN 2是模棱两可的癌前诊断;对所有CIN 2均进行治疗是过度治疗。
3解决的问题
本临床实践指南针对以下4个临床问题:(1)每个资源层最好的筛查方法。(2)筛查出现阳性结果或其他异常结果(如HPV与细胞学结果不一致)时合适的分诊策略。(3)癌前病变最好的管理策略。(4)已接种HPV疫苗女性的筛查方法。
专家小组在内容和方法学评估的基础上选择了8个指南作为本指南的证据基础:包括来自美国癌症协会(ACS)/美国阴道镜和宫颈病理学会(ASCCP)/美国临床病理学会(ASCP)、美国的多学科团体(HUH)的指南、安大略湖癌症治疗协会(CCO)、欧洲指南(von Karsa)和2个WHO指南,并强化了指南中的建议。
4最终建议
本指南建议是由多国、多学科专家组使用了现有指南中的证据并补充数据和临床实践作为指导而制定的。
4.1 最大资源地区 宫颈癌筛查:25~65岁(循证证据)女性HPV DNA检测,每5年1次。个别女性可以选择接受筛查至70岁(类型:专家共识;证据质量:高;推荐强度:强)。≥65岁的妇女如果在过去≥15年持续筛查阴性可以中止筛查;如在60岁以后存在阳性筛查结果,应该在最后1次阳性结果的第2、5、10年进行筛查。如果妇女未曾接受过筛查或不定期筛查,应在65岁时进行筛查,如果结果是阴性,可以退出筛查(类型:循证医学;证据质量:中;推荐强度:中等)
HPV DNA检测结果阳性,应该进行HPV 16、18的基因分型和(或)细胞学检测(类型:循证医学;证据质量:高;推荐强度:强)。如分流结果异常(即>ASC-US或HPV 16、18阳性)建议阴道镜检查,对醋白和可疑癌变区域进行活检。如果分流结果阴性(如最初HPV阳性而细胞学阴性),则随访,在12个月重复HPV检测(类型:循证医学;证据质量:中;推荐强度:强)。如果在12个月随访,重复HPV检测结果为阳性,推荐阴道镜检查。如果在12和24个月随访HPV复测结果阴性或任何间隔12个月连续HPV检查为阴性,可返回常规筛查(类型:循证医学;证据质量:高;推荐强度:强)。
接受HPV和细胞学联合检测者,如HPV结果阳性和细胞学结果异常应进行阴道镜和活检。如果HPV阳性(非16/18型)而细胞学正常,在12个月重复联合检查。复测HPV仍然是阳性,不论细胞学结果如何,均推荐阴道镜活检(类型:专家共识;证据质量:中;推荐强度:强)。活检结果提示癌前病变(≥CIN 2),建议LEEP(如果有高水平的质量保证),如存在LEEP禁忌,可提供消融治疗。(类型:循证医学;证据质量:高;推荐强度:强)。癌前病变接受治疗的患者,在治疗后12个月检测 HPV DNA,结果阳性者,继续每年筛查;结果阴性者返回常规筛查(类型:正式共识;证据质量:中;推荐强度:中等)。
出处及讨论:HPV检测年龄范围从HUH等指南修改而来。证据显示,HPV检测将使得25~29岁的HPV阴性女性获益,因此,与CCO和世卫组织推荐的起始年龄(30岁)相比,增加25~29岁的HPV检测适用人群。对于25岁以下的妇女,由于缺乏降低癌症风险的证据并且存在过度治疗的潜在危害,不推荐筛查。终止筛查的年龄确定65岁是基于现有的指南。在最大资源地区人均寿命较长,宫颈病变的发病率在60~64岁和65~69岁两个年龄段接近(分别为16.6/10万和16.1/10万),因此,妇女和她们的医生可以做出个性化的决定将筛查年龄延长至70岁。比如已经接受过筛查的65~70岁女性,在5年内有过阳性结果(HPV、细胞学或VIA),筛查年龄可延长至70岁。
WHO、von Karsa、HUH及CCO指南均认为HPV DNA检测比细胞学更敏感,将其推荐为初筛项目。根据WHO、CCO及欧洲指南,筛查间隔为5年。目前,大约有10项HPV初筛的RCT研究。ACS/ASCCP/ASC指南推荐联合筛查,但增加诊断花费所带来的附加临床价值有限,HUH指南及2014年发表的ARTISTIC临床试验中均证实HPV初筛比联合筛查具有更高的性价比。仅使用HPV检测(是ASCO认定的最高证据级别标志物)的筛查被证实有临床效能,并被美国和国际监管机构接受,如美国食品药品管理局(FDA)、欧盟CE(Conformite Europeenne)、WHO资格预审及其他国家级监管机构。65~70岁且未曾罹患≥CIN 3的宫颈病变女性,连续2~3次HPV检测阴性或连续≥3次细胞学阴性,且过去15年内检测均为阴性,不需要再进行筛查。
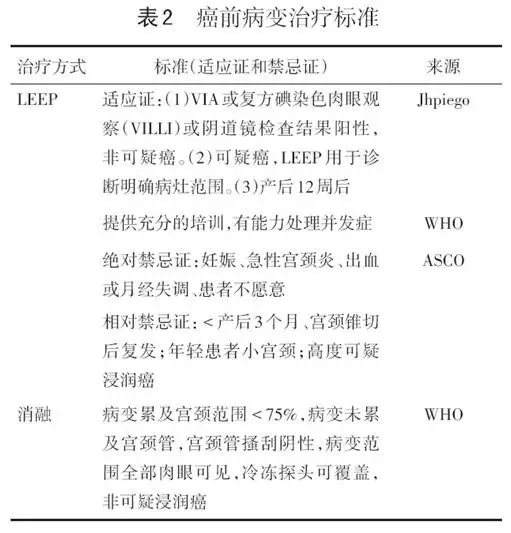
在最大及较高资源地区,如果阴道镜结果阳性,首选治疗方案为LEEP,除此之外还有冷冻、冷凝、激光等方法,这些方法均有严格的适应证(见表2)。最大资源地区不推荐行冷冻治疗,而首选LEEP,因其可提供组织进行病理学诊断。在低资源地区,可能没有LEEP的技术和训练或存在禁忌证。Massad等的研究及WHO指南引用了RCT研究揭示各种治疗方案间仅有微小的差异。LEEP术后HPV情况目前尚无随机对照研究。根据现有共识,指南推荐上述治疗后1年行HPV DNA检测。
4.2 较高资源地区 30~65岁女性,包含HPV DNA检测的宫颈癌筛查应每5年进行1次(即:二次筛查在初次筛查后5年进行;类型:循证医学;证据质量:高;推荐强度:强)。如果连续2次筛查结果为阴性,后续筛查应改为10年1次(类型:专家共识;证据质量:中等偏低;推荐强度:中等)。≥65岁女性过去15年内连续筛查阴性,可停止筛查。但60岁之后筛查阳性的女性应在阳性结果后2、5、10年继续行宫颈癌筛查。对于从未接受过筛查或接受不规律筛查的女性,应当在65岁时进行筛查,若结果阴性,可终止筛查(类型:专家共识;证据质量:低;推荐强度:弱)。
如果HPV DNA检测阳性,临床医师应进一步行HPV16/18基因分型和(或)细胞学检查(类型:循证医学;证据质量:高;推荐强度:强)。若进一步检查结果异常(例如:≥ASC-US或HPV16/18阳性),患者应行阴道镜检查,取任何醋白部位(或可疑癌)行病理活检。若分诊结果阴性[如:HPV阳性(非HPV16/18阳性),细胞学阴性],则12个月后复查HPV检测(类型:循证医学;证据质量:中;推荐强度:强)。若1年后HPV复查为阳性,则推荐患者行阴道镜检查。若1年及2年后HPV复查均为阴性,或连续数次每年HPV复查均为阴性,则患者可重新回到常规筛查路径(类型:循证医学;证据质量:高;推荐强度:强)。
若阴道镜及病理活检结果提示癌前病变(≥CIN 2),临床医师应建议患者行LEEP术(若有高度适应证),若不适宜行LEEP术,也可推荐消融治疗(类型:循证医学;证据质量:高;推荐强度:强)。癌前病变患者完成治疗后,应在术后1年复查HPV DNA检测。若术后1年复查结果为阳性,则应每年行筛查;若为阴性,则回到常规筛查路径(类型:专家共识;证据质量:中;推荐强度:中等)。
出处及讨论:较高资源地区,即大部分中等收入国家的城市,筛查年龄缩窄到30~65岁,这与CCO指南是一致的。关于停止筛查的最佳年龄尚无有效证据。Beal等在墨西哥针对以下4种筛查及治疗策略进行了费用研究:仅使用细胞学筛查,细胞学及后续高危型HPV筛查,高危型HPV分型筛查,高危型HPV分型与细胞学联合检测。结果表明:单独细胞学筛查和高危型HPV分型检测具有最低的边际成本效益率(ICER)。上述策略能让更多女性避免阴道镜检查。若女性过去5年曾有筛查阳性病史(HPV、细胞学或VIA),应该重新加入筛查,这与最大资源地区推荐的方法一致。在较高资源地区,连续2次筛查阴性的女性筛查间隔增长到10年,这也是依据von Karsa指南进行的修正。由于在年长女性中,HPV检测特异性更高,可以检测HPV基因分型进行分流,若HPV基因分型无法实现,则可使用细胞学检查。HPVDNA检测对于发现≥CIN 2病变预测性较低,CCO指南及von Karsa指南推荐利用细胞学检查进行分流。
分流后续处理原则与最大资源地区相同。对于癌前病变,专家组推荐LEEP为首选治疗方案,但如果无法行LEEP或存在禁忌,则临床医师应选择消融治疗。
4.3 有限资源地区 30~49岁女性应每10年行1次HPV DNA检测,相当于一生中共行2~3次筛查[类型:循证医学(年龄段限制);类型:专家共识(间隔);证据质量:中;推荐强度:中等]。若HPV DNA检测阳性,临床医师应对其行细胞学检查(应确保质量)和(或)HPV16/18基因分型或肉眼评估决定治疗方案(细胞学及基因分型:类型:循证医学;证据质量:高;推荐强度:强。窥器检查:类型:专家共识;证据质量:低;推荐强度:低)。若细胞学分流异常(例如≥ASC-US),患者应行质量保证的阴道镜检查(首选),镜检时任何醋白或可疑癌变部位均应取活检,不具备阴道镜检查条件的地区可采用醋酸肉眼试验。对于分型或肉眼评估阳性的妇女应该进行治疗,满足适应证的条件下,推荐消融治疗;如果不满足适应证且有条件,可行LEEP(类型:循证医学;证据质量:高;推荐强度:强)。癌前病变患者接受治疗后,1年后应行随访,检查项目同前(类型:专家共识;证据质量:中;推荐强度:中等)。
筛查的10年间隔研究依据是南亚、中美和东非地区的成本效益分析调查成果。这项研究也支持了WHO指南中关于年龄段的推荐(30~49岁),并且指出自30岁起,每10年1次的HPV DNA检查具有可观的边际成本效益。
出处与讨论:资源有限地区通常指中等收入国家的乡镇地区,推荐的筛查方案大多基于WHO指南。筛查阳性的分流选择取决于资源和取样。如可行,应按照HUH等指南推荐行HPV基因分型检测。若不具备条件,则可选择细胞学检查。若以上条件均不具备,则推荐使用肉眼评估。若细胞学结果阳性,则应接受具有质量保证的阴道镜检查;否则按照分流结果直接治疗。对于有筛查异常史女性(如:重复HPV阳性),召回她们随访是一项挑战,而这些女性患CIN2以上疾病的风险上升,在有限或基本资源地区为她们提供直接治疗具有成本效益。
癌前病变的管理方法基于ASCCP和WHO指南;后者较为支持行LEEP。
4.4 基本资源地区 HPV DNA初筛如不可行则应提供VIA肉眼观察。对于30~49岁女性,宫颈癌筛查应保证终生至少1次,但不超过3次(类型:循证医学;证据质量:中;推荐强度:强)。
HPV检测结果阳性,临床医师应完成VAT肉眼评估后治疗,根据病灶大小位置决定行冷冻治疗和(或)LEEP(类型:专家共识;证据质量:低;推荐强度:中等)。若初筛方式为VIA且结果为阳性,则应根据病灶定位及大小予冷冻治疗和(或)LEEP(类型:循证医学;证据质量:中;推荐强度:中等)。
癌前病变患者接受治疗后,随访应在术后1年进行。若结果阴性,则重新回到常规筛查流程(类型:专家共识;证据质量:中等;推荐强度:中等)。
除了Campos等针对有限资源地区的推荐之外,Shi等研究主要对比中国农村地区女性一生中1次或2次或常规筛查间隔下行HPV、VIA或VIA+卢戈液初筛的效果。研究者发现,筛查的最低成本效应率(CER)为35岁时行终生1次的VIA检查,其次是终生2次的VIA检查(35~45岁)。一生1次的VIA可减少8%宫颈癌导致的死亡。HPV检测则可减少12%;一生2次则可分别减少16%和24%的死亡。
出处与讨论:上述推荐基于WHO指南。在基本资源地区,没有大型筛查项目,可以采用VIA。以VIA为初筛有一些不同的结果。一项纳入151 538名印度女性的RCT研究发表在WHO指南上。研究对象为75 630名接受4轮VIA检查加癌症科普的女性与76 178名单纯接受癌症科普的女性比较,进行了12年的随访。宫颈癌的发病年龄调整率(AARs)在VIA加科普组为29(95%CI:24.5~33.4),对照组为29.4(95%CI:27.1~31.7);宫颈癌病死年龄调整率在VIA加科普组为14.4%(98%CI:12.7~16.2),对照组为19.8(95%CI:17.8~21.8);发病率比为0.69(95%CI:0.54~0.88,P=0.003)。一项更早的印度RCT研究比较了HPV检测、细胞学、VIA和标准治疗;随访年限为8年。结果显示,HPV检测组的结果差异最具有统计学意义,VIA组则无意义。
5特殊人群
5.1 推荐1a:HIV阳性女性 自诊断后应尽早开始每2~3年1次HPV检测,筛查频率取决于其所处地区的资源情况;总的来说,终生筛查次数应为普通人群的2倍(类型:专家共识;证据质量:低;推荐强度:弱)。根据患者所处地区,推荐的频率如下:最大资源地区:2~3年检测HPV 1次。较高资源地区:2~3年检测HPV 1次,若为阴性,则改为5年1次(终生约8次)。有限资源地区:2~3年筛查1次,且总数为普通人群的2倍(终生约4次)。基本资源地区:若有条件进行HPV检测,则患HIV的女性应在25岁开始尽早筛查,若最初结果为阴性则每3年1次;大约终生共2次。若无法行HPV检测,使用VIA检查,频率同前(类型:循证医学;证据质量:低;推荐强度:弱)。
患HIV女性若筛查异常、进一步分诊阳性管理办法同普通人群一致(类型:专家共识;证据质量:低;推荐强度:中等)。
5.2 推荐1b:免疫抑制女性(所有资源地区) 除患HIV以外无论因何种原因处于免疫抑制的女性的筛查频率及次数与HIV阳性患者一致(类型:专家共识;证据质量:不充分;推荐强度:弱)。
关于合并HIV女性的筛查证据并不充分。总的来说,以上推荐与WHO指南意见一致。Vanni等针对巴西(中等收入国家)患HIV女性患者使用了一种模型方法对比27种方案,包括:初筛HPV检测或细胞学,细胞学、HPV或阴道镜检查分流,以及上述方式随机组合后半年、1年、2年的随访结果。结果显示,患有HIV女性接受每年1次HPV检测结合细胞学分流是最具有成本效益的方案。
5.3 推荐2a:妊娠女性(所有地区) 妊娠女性不应接受筛查。
5.4 推荐2b:产后女性(所有地区) 贫困地区女性产后6周应接受VIA检查。其余地区女性产后6个月应推荐接受HPV检测(类型:专家共识;证据质量:不充分;推荐强度:弱)。
针对妊娠及产后女性推荐的筛查方案并无循证医学级别的有力证据,均基于专家共识。有迹象表明,妊娠中免疫改变会让某些女性感染HPV增加,但在产后会自行消退。故而妊娠过程中行HPV检测得到的结果或许不准确。检查的特异性随时间推移而增加。但很多女性在产后6周已看过医师,产后6个月筛查的可能性很低。
5.5 推荐3:已行全子宫切除的女性(既往无≥CIN 2病史) 在所有地区,因良性原因行全子宫切除的女性,既往无宫颈细胞非典型增生或HPV感染病史者,可终止筛查。行次全子宫切除的女性(残留宫颈)应继续接受常规筛查(类型:循证医学;证据质量:高;推荐强度:强)。以上推荐来源于2011年CCO临时推荐及2012年ACS/ASCCP/ASCP指南。
6特别评论
6.1 自行收集标本的意义(仅供HPV分子检测) 为提高筛查覆盖率,已经或将要得到一些自收集标本(也叫自采样)的数据。使用有效的收集装置、运输条件和方法,自采样的标本可以用于HPV检测。ASCO检索到3篇相关系统回顾或Meta分析文献。Arbyn等发现“自采样行HPV检测的敏感度低于医师操作样本[≥CIN 2患者的敏感度为0.88,(95%CI:0.85~0.91),≥CIN 3患者的敏感度为0.89,(95%CI:0.83~0.96)]。除此之外,自采样检测的特异度也比临床医师操作低(≥CIN 2患者的特异度为0.96(95%CI:0.95~0.97],≥CIN 3患者的特异度为0.96(95%CI:0.93~0.99])。当使用信号放大检测方法检测自采样及宫颈样本的敏感度时,差异有统计学意义,但当使用PCR法时,差异大大减少甚至消失。Racey等发现,家用自采样试剂盒收集的样本较临床医师细胞学收集样本更为合规。在基础及有限资源地区使用自收集步骤需进一步验证,高于推荐的温度保存或采用其他缓冲液保存可能会影响检测结果。
6.2 已接种过HPV疫苗的女性推荐何种筛查 宫颈癌疫苗时代来临后,2种最高危致宫颈癌的HPV基因型将被预防。阳性筛查结果对CIN 3以上病变的预测性将降低,这是因为≥CIN 3病变的患病率预期会降低至少50%,同时筛查的阳性率将下降30%以内。因此,宫颈癌患病风险及筛查预测性降低。如果在最大和较高资源地区,女性在性活跃期之前都能接种宫颈癌疫苗,那么,可以在30、45、60岁这3个年龄段进行HPV检测常规筛查,当然,这需要更多的数据来加以验证。
针对接种了二价和四价疫苗的人群,可以通过更改筛查方案来获得更好的利害比。首先,由于接种宫颈癌疫苗的人群(且HPV16/18型阴性)患癌风险降低,且其他亚型HPV病毒引起宫颈癌的中位年龄比高危型导致的患癌中位年龄约晚5年,筛查起始年龄可以推后。其次,应采取风险与管理平衡的原则,可以考虑增加筛查间隔及延长随访时长的管理。
尽管还有至少10年的时间才能观察到最新的HPV疫苗对预测疾病的影响,对于接种了多价HPV疫苗后无HPV感染的人群,是否需要筛查是一个问题。大部分≥CIN3病变将被预防,因为多价疫苗对其他类型的高危HPV(hr-HPV)有交叉对抗作用。由少数其他hr-HPV或低风险HPV亚型导致的CIN 3很少能发展为宫颈癌,这些HPV基因型能引起一些轻微的细胞学或组织学异常并被筛查出来,但是临床意义不大。因此,按目前的筛查方法可能对女性的害处及花费会高于受益。中年女性35~40岁进行单次筛查,若能发现非HPV疫苗覆盖的hr-HPV或边界HPV导致的早期宫颈癌,或许还能发现女性生殖系统其他恶性肿瘤,则单次筛查具有一定价值,并能提供显著的健康受益。
7新的筛查技术
目前,正在研发能用于所有地区的新筛查技术。新技术包含了一些新的有潜力的生物标志物。在hr-HPV初筛阳性的患者,使用这些标志物做分流或许能比细胞学和(或)HPV基因分析检测更具临床意义。上述标志物中最具价值的是p16INK4a细胞免疫组化检测(P16 ICC)。不少研究表明,对于初筛hr-HPV阳性,罹患CIN 2及以上患者,分流采用P16 ICC与细胞学相比具有类似或更高的特异度和敏感度。此外,细胞增殖标志物Ki-67与p16一起双染色(p16/Ki-67 ICC)可成为一种不依赖于形态学的检查。还有E6蛋白检测,该技术可运用于低资源地区。对CIN 3及宫颈癌患者,HPV E6蛋白检测比HPV DNA检测更具特异性。该项研究成果需进行更深入的验证。其他正在研发的生物标志物包括:病毒及宿主甲基化研究、3q扩增和病毒整合素。所有新的生物标志物在投入临床使用之前均需深入研究及验证。
8研究局限性
关于合并HIV或处于免疫抑制状态的女性,最佳开始及终止筛查年龄,治疗的相对风险和受益,癌前病变患者随访的推荐证据具有局限性。此类领域需要更多深入研究。
9未来方向
除了解决研究局限问题,其他领域同样需要深入研究(如:自采样、标志物、女性的需求和喜好、便宜的技术、疫苗对筛查的影响等)。其他改进可能包括以下方面:医疗和公共卫生组织实践及吸收新技术的教育;政策制定者的参与及资助;治疗机构与公共机构、地区、国家之间的合作关系;协调支付能力和HPV检测实现能力;健康信息系统的改进,使得筛选结果阳性的妇女得到更好的随访和治疗;质量控制;监测和评价。
10几点看法
ASCO 2016指南是第一个将全球不同资源水平划分为4个梯度,制定相应筛查策略的指南,具有更高的可操作性。我国幅员辽阔,不同地区经济水平差别巨大,单一筛查指南显然不符合国情,分层筛查指南显然对我国有较大的参考价值。制定政策的卫生行政部门、公共预防决策者需结合当地的卫生资源,确定最优筛查方案。
本指南推荐按不同层次资源,可选择单独或联合VIA或碘染色肉眼观察、HPV DNA检测、细胞学和阴道镜及活检等方法,并推荐将HPV DNA检测作为所有资源地区初筛项目,筛查间隔可延长至5~10年,是本指南的亮点之一。
指南亮点之二是推荐LEEP作为锥切的首选方法。相对于冷刀锥切而言,LEEP因简便、出血少、恢复快、术后宫颈外观变化较小和对以后妊娠影响较少而显示出其优越性。以往担心的复发率高可通过提高手术技巧、控制切除范围来解决。
对于临床医生而言,我们更多的是面对机会性筛查的患者,专门来门诊就诊要求筛查的女性并不多。这些女性对经济多不在意,往往会选择同时进行HPV DNA检测联合细胞学检查。推荐有条件者首选HPV DNA 分型检测,更能减少这些女性就诊的次数。
准确解读筛查异常结果和推荐适当的处理方式是临床医生的工作重点。现将本指南结合其他指南推荐的相关内容浓缩如下,供临床医生参考:(1)细胞学为ASC-US者,HPV DNA阴性可随访;HPV DNA阳性者需行阴道镜检查。(2)细胞学为ASC-US-H或低度病变者,不需考虑HPV DNA结果,直接阴道镜检查。(3)细胞学为高度病变者,可直接行阴道镜检查或直接锥切。(4)细胞学阴性而HPV DNA 16/18型阳性者,推荐阴道镜检查。非16/18型HPV DNA阳性者,可随访1年后复查。
关于CIN的处理:(1)现已明确CIN 1不需处理;所有的CIN 2都处理为过度治疗,CIN 2最好用p16和Ki-67双染分流,染色阳性者治疗、阴性者随访;CIN 3则需治疗。(2)对于需要治疗的CIN,其治疗方法可选择锥切或消融。宫颈外露部完全可见转化区(即Ⅰ型转化区)可选择消融或锥切,转化区部分可见(即Ⅱ型转化区)和完全不可见(即Ⅲ型转化区)需选择锥切。(3)锥切方法首选LEEP,冷刀锥切更多的用于保留生育功能的ⅠA1期宫颈浸润癌患者。(参考文献略)
 妇产科在线APP下载
妇产科在线APP下载










 京公网安备 11010202008857号
京公网安备 11010202008857号