妊娠合并肺动脉高压严重威胁着母胎生命安全。肺动脉高压导致的死亡率正在上升(2001年为5.5/10万,2010年为6.5/10万);女性患者死亡率上升更为显著(图1)。因该病住院的患者中女性居多,占63%,这一比例从2001年到2010年增加了57%。
肺动脉高压最初表现为一些非特异性症状,如劳累性呼吸困难和乏力。随病情进展,肺动脉压升高导致右心衰竭,症状更加明显,包括胸痛、劳累晕厥、外周水肿和右上腹疼痛,以及肝充血引起的厌食。由于早期症状表现非特异,诊断通常延误,孕前也可能不会发现。事实上,只有大约24%的先天性心脏病引起的肺动脉高压能在妊娠期间被诊断出来。
据报道,妊娠期间的死亡率高达25-56%。并发症和死亡主要与心脏无法适应妊娠期血容量、输出量增加、全身血管阻力降低以及孕期高凝状态有关。WHO将任何原因导致的肺动脉高压均归为四级心脏病,并建议避免妊娠。尽管如此,在很多国家,妊娠肺高压患者仍然屡见不鲜,因此造成的母胎死亡病例时有出现,除孕产妇死亡外,最常见的其他产科并发症还包括胎儿生长受限、早产和胎儿丢失等。
分类
既往肺动脉高压定义为通过右心导管测量的平均肺动脉压为≥25mmHg。然而,2019年关于肺动脉高压的世界研讨会提出,正常肺动脉压上限应为20mmHg。尽管妊娠期间血容量增加,但肺血管阻力降低,平均肺动脉压应小于25mm Hg。WHO将肺高压分为五组:其中一些引入了附加诊断标准(表1)。组1:肺动脉高压;组2:左心疾病引起的肺动脉高压;组3:慢性肺病和(或)缺氧诱发的肺动脉高压;组4:慢性和肺血管血栓栓塞引起的肺动脉高压;第5组:不明原因或多因素所致肺动脉高压。
肺高压是所有类型肺动脉高压的总称。肺动脉高压(1组)是肺高压的一个临床亚型,进一步定义为毛细血管前或毛细血管后肺动脉高压。这个亚组包括特发性肺动脉高压(表2)。毛细血管前肺动脉高压反映了肺血管系统中出现的孤立性肺动脉高压(肺血管阻力增加而压力未增加)。毛细血管后肺动脉高压反映了静脉和毛细血管床的高血压(肺静脉压力增加但阻力未增加),通常由左心疾病引起(第2组)。
2017年美国心脏病杂志发表了一项最大样本的妊娠期肺高压报告,纳入2003年至2012年期间共1519名患者,妊娠合并肺高压并住院分娩。此项研究没有根据上述分类系统报告研究结果。然而,报告提供了不同类型的肺动脉高压在这一妊娠群体中所占比率。大多数患者(59.7%)为孤立性肺高压,剩下的40.3%与潜在的心脏病有关,最常见的是瓣膜病(图2)。在孤立性肺高压中,5.8%诊断为特发性肺高压,3%合并艾森曼格综合征。到目前为止,在所有肺高压患者中最常见的并发症为慢性血栓栓塞症,占87.9%;在孤立性肺高压并发血栓栓塞的占85.1%。
表1 肺动脉高压的血流动力学定义
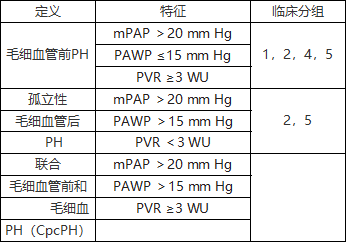
表2肺动脉高压临床分类(2019更新)
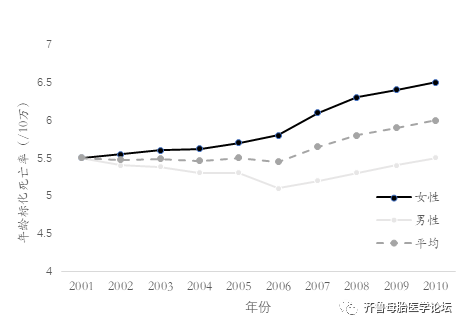
图1.2001-2010年根据年龄分层后不同性别的肺动脉高压死亡率
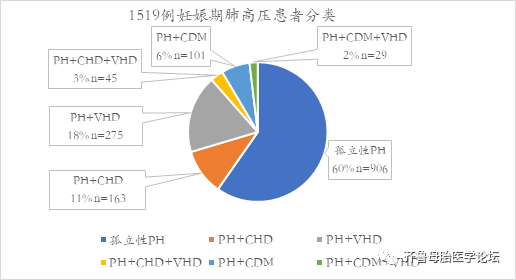
图2.2003-2012年美国妊娠和肺动脉高压亚类分布(N=51519)。PH,肺动脉高压;VHD,瓣膜病;CHD,先天性心脏病;CDM,心肌病。
诊断
超声心动图是评价右室功能和排除左心疾病的首选影像学检查方法。目前的指南建议首先使用经胸超声心动图,根据右室收缩压和三尖瓣射血速度来评估肺动脉高压的可能性。如果估计肺动脉高压的可能性为中或高,建议进一步检查,包括右心导管监测。
超声心动图可用于估计肺动脉收缩压。估计值可能会受肺部疾病和肥胖患者胸部声波传导方面的限制。非妊娠人群经胸超声心动图预测肺动脉高压的敏感性和特异性较高。经胸超声心动图测定右室收缩压(RSVP)和肺动脉压与右心导管测定具有良好的线性关系。如果超声心动图提示肺动脉高压,则在确诊前,应先进行右心导管测定检查确认。
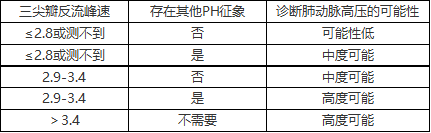
经胸超声心动图检查孕妇肺动脉高压的准确性尚不清楚。妊娠期许多生理变化可能影响超声心动图对肺动脉高压的评估。超声心动图通过评估三尖瓣反流速度(随着肺阻力的增加而增加)和估计中心静脉压(CVP)(代表右房压力,肺动脉压升高时右房压力也增加)间接地估计肺动脉压。超声心动图测定CVP还包括评估下腔静脉的管径和可压缩性。对于循环血量较非妊娠期升高40-50%的孕妇来说,CVP和右房压力可能会被高估。最新的欧洲心脏病学会指南考虑到潜在的不准确性及高估肺动脉压的可能性,建议在估计肺动脉高压时使用三尖瓣反流速度(表3)。
关于超声心动图对妊娠妇女肺动脉高压估计与右心导管监测的比较鲜有报道。一项对27例孕妇小样本报道,与右心导管相比,经胸超声心动图结果会高估肺动脉压。最近一项对21例孕妇研究显示经胸超声心动图与右心导管之间检测结果存在良好的相关性;然而,30%的患者在接受经胸超声心动图检查时,右室收缩压被高估。因此应认识到经胸超声心动图对于肺高压是一种筛查工具,而不能明确诊断。
表3 超声心动图对疑诊肺动脉高压估计的可能性
发病机制
肺动脉高压源于潜在的肺部损伤或遗传倾向导致肺血管床重构,进而出现血管壁肥大和增生、原位血栓形成、纤维化和血管收缩。血管重构过程中涉及三个主要途径:前列环素途径、内皮素途径及一氧化氮途径。
前列环素
前列腺素类是一种具有生物活性的脂类,主要由两类组成:前列腺素(包括前列环素)和血栓烷类。前列腺素(如前列腺素E1和E2)在产科常用,包括促宫颈成熟和治疗产后出血。
前列环素(前列腺素I2)由血管内皮细胞产生,由促前列腺素合成酶合成。前列环素的作用通过增加细胞内环磷酸腺苷而导致肌肉松弛,并抑制血小板聚集、平滑肌细胞增殖和肺血管重塑。肺血管床中的类前列腺素受体可以松弛也可以收缩。前列腺素I2受体是前列环素的一种松弛受体,能导致血管扩张和抑制平滑肌增殖和血小板聚集。在肺动脉高压中,血栓素和内皮素增加,导致血管收缩,同时伴随着舒血管物质前列环素和一氧化氮的减少。
内皮素途径
内皮素途径中,内皮素通过内皮素A和内皮素B受体发挥作用。结合受体通过激活磷脂酶C和激活钙离子导致血管收缩。
一氧化氮途径
一氧化氮途径通过可溶性鸟苷环化酶产生环鸟苷酸。干扰钙离子通道最终导致血管扩张。此外,一氧化氮还可抑制平滑肌细胞增殖和血小板聚集。
右室的重要性
进行性右心衰竭是肺动脉高压患者最常见的死亡原因。右室收缩功能是预测肺动脉高压预后的重要指标。右室在结构和功能上不同于左室。右室是一个低压、高流量的腔室。右室壁薄,肌层厚度约为左心室的六分之一,但由于健康肺血管阻力低、容量大,右室可以产生相同的每搏输出量。肺动脉高压后负荷增加导致右室壁肥厚。最初可以耐受,没有症状。然而,随着病情进展增厚的右室发生纤维化,导致舒张功能障碍和充盈能力下降。右心舒张功能障碍可在超声心动图上显示右房压升高。不能维持足够的心脏输出会导致进一步的扩张,增加室壁压力和心肌耗氧量,最终导致缺血。进行性右室扩张和膨胀导致室间隔右向左移位,损害左心室充盈,最终影响左心室输出量。
右心衰竭是肺动脉高压终末表现,如出现呼吸短促、胸痛、疲劳和晕厥症状应考虑右心衰可能。体格检查会发现颈静脉扩张、水肿、肝肿大或腹水。经胸超声心动图对右室功能的连续评估、症状评估对预测和治疗右心衰竭非常重要。右心衰竭的特征是右心充盈压升高(右房压高于8mm Hg)和心脏指数下降(低于2.5L/min/m2)。
预后
妊娠合并肺动脉高压患者死亡率报告大多来自病例回顾或住院病人。死亡率的准确统计数据存在很大缺陷,很难评估到真正围孕期因肺高压致死率。即使准确数据无法获得,但因肺高压致死孕妇仍然显著高于无心脏病患者(24.8%比0.4%)。此外,数据仅反映了住院期间发生的与妊娠相关的事件,可能会遗漏出院后死亡。高达62%的肺动脉高压患者在妊娠期间会经历一次或多次心脏不良事件,最常见的是心律失常和心力衰竭。
最近一项对49例妊娠合并肺动脉高压患者病例总结,报道的死亡率较低,为16%。然而,超过80%的出现病情恶化,50%以上需要加强治疗(强心、肺血管扩张、一氧化氮或体外膜氧合物[ECMO])。患有严重肺动脉高压、1组肺动脉高压和艾森曼格综合征的患者死亡率和早产风险最高。
由于这些重大风险,对于所有肺动脉高压患者,应考虑避孕和计划生育。不幸的是,临床工作中缺乏这种医患沟通。沟通讨论应该涵盖来自多学科护理团队的意见,包括呼吸内科、心内科、妇产科和母胎医学专家。
治疗方法
肺动脉高压的治疗应基于临床表现、病因、疾病严重程度和对治疗的反应(图3)。一旦确诊并确定分类,就可以有针对性的起始治疗。对于第1组以外的大多数患者,如果病因已知,治疗目标是改变或根除病因。一般来说,所有的肺动脉高压患者都应接受支持或“常规”治疗。支持性治疗包括监督下运动指导、预防性措施(免疫接种)、社会支持和避免过度体力活动导致症状出现。常规治疗方法包括抗凝、吸氧、利尿、阿司匹林和钙通道阻滞剂。对于第1组肺动脉高压患者,治疗的重点是直接治疗肺动脉高压(靶向治疗)。所有1组肺动脉高压患者均应进行急性血管反应性试验,以确定对血管扩张剂治疗的反应程度,并指导治疗策略。靶向治疗适应症患者应在具有肺高压专业中心进行管理。
抗凝
对于肺动脉高压患者抗凝治疗具有很强的生物学和循证理论基础支持。在特发性肺动脉高压中,内皮细胞异常和激活易导致血栓形成,尤其是肺血管系统中的镜下血栓形成。肺血管系统内的血栓栓塞事件会增加阻力,导致右心功能恶化,甚至心力衰竭死亡。最新欧洲心脏病学会指南建议,对于患有特发性肺动脉高压、遗传性肺动脉高压引起的肺动脉高压,应考虑抗凝治疗。目前尚缺乏其他类型肺动脉高压抗凝效果的数据。
吸氧
低氧会明显诱发肺血管收缩。基于专家共识,对非妊娠肺动脉高压患者,建议补充氧气使氧饱和度保持在90%以上。关于妊娠合并肺动脉高压尚缺乏理想的氧饱和度指标数据;然而,目标应该维持至少90%的血氧饱和度。高海拔会导致低氧血症相关的肺血管收缩,因此肺动脉高压患者应避免前往高海拔地区。
利尿
右心负荷增加会带来肺动脉压力升高因此需要利尿。通常表现为颈静脉扩张、下肢水肿、偶发腹水。此类患者对妊娠期出现的血容量增加耐受性较差,尤其是基础右心功能障碍已经存在的患者。
钙通道阻滞剂
钙通道阻滞剂通常用于肺血管扩张。对第1组肺动脉高压患者进行动脉舒张试验,以确定其肺动脉血管舒张反应。反应性是指钙通道阻滞剂治疗后平均肺动脉压降低10mm Hg或平均肺动脉压下降至40mm Hg或更低。对于反应性病人,钙离子拮抗剂能提高其生存。长效硝苯地平、地尔硫卓或氨氯地平是最常用于肺高压的钙离子拮抗剂(超说明书用药)。由于维拉帕米有潜在的负性肌力作用,应避免使用。
值得注意的是,钙通道阻滞剂是非选择性血管扩张药物,因此会降低全身和肺血管阻力。对大多数肺动脉高压患者并不具有临床意义。然而,有心内分流(房、室间隔缺损)的病人,体循环血管阻力低于肺循环阻力可能导致分流逆转和顽固性低氧血症。妊娠期间,体循环血管阻力生理性下降,随着肺动脉压接近全身动脉压,进一步增加了分流逆转的可能性。
靶向药物治疗
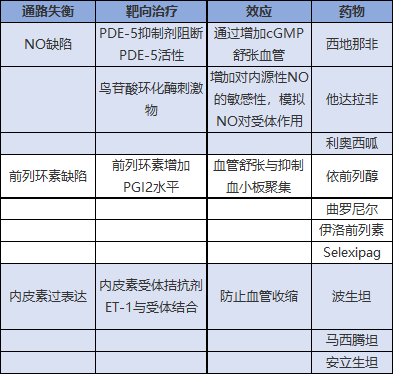
内皮素、一氧化氮和前列环素途径是维持肺血管张力的三种途径。靶向药物指通过三种途径中的一种来降低肺血管阻力的药物。前列腺素类靶向前列环素(前列腺素I2)途径,内皮素受体拮抗剂作用于内皮素途径,磷酸二酯酶5型抑制剂和可溶性鸟苷酸环化酶刺激因子作用于一氧化氮通路。表4概述了通路失衡和针对这些通路的治疗方法。
前列环素通路激动剂
前列环素可引起血管扩张并抑制平滑肌增殖。在肺动脉高压中,前列环素减少。目前该组可用的药物包括合成前列环素(依前列醇)、前列环素类似物(曲罗尼尔和伊洛前列素)和选择性前列环素IP受体激动剂(selexipag)。依前列醇有助于改善血流动力学(心脏指数)、心功能等级、运动能力和延长生存期。然而,由于使用依前列醇通常需要留置中心静脉导管、持续输液泵和日常药物治疗,因此使用依前列醇非常麻烦。在伴有结缔组织病的肺高压患者中已开始使用。短期结果有所改善,包括运动耐力和血流动力学,但死亡率无明显改变。静脉注射依前列醇对其他类型肺动脉高压进行治疗已有报道并取得良好效果。
曲罗尼尔钠是前列环素类似物,可以通过持续皮下或静脉输注,也可以吸入形式给药。与依前列醇输注相似,曲罗尼尔可改善特发性肺动脉高压患者的运动能力、呼吸困难评分和血流动力学。缺乏长期结果数据。
图3 肺动脉高压患者的处理方法
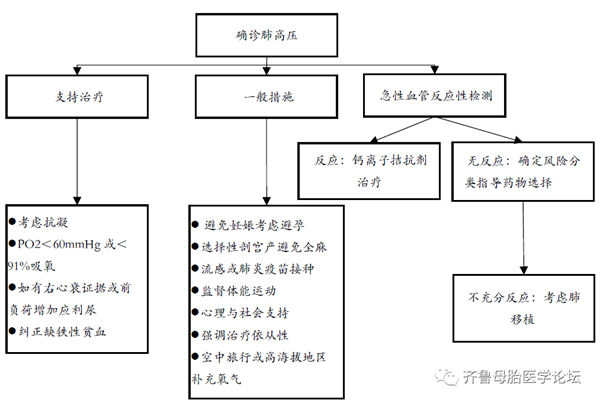
表4 血管活性介质失衡与靶向治疗
伊洛前列素是一种前列环素类似物吸入剂型。伊洛前列素可改善心力衰竭等级、生活质量、肺血管阻力和生存率。吸入型伊洛前列素由超声雾化输送,通常耐受性良好。然而,如存在持续低血压(体循环血压低于85mm Hg)该药禁用。
Selexipag是一种选择性前列环素IP受体抑制剂,最近FDA批准用于治疗肺动脉高压。口服用药,可降低肺血管阻力和改善病情。
内皮素受体拮抗剂
内皮素-1是一种有效的血管收缩物质,在肺动脉高压患者的肺中含量较高。内皮素受体拮抗剂靶向内皮素-1受体的两种亚型(受体A和B)。拮抗这些受体已被证明是靶向治疗第1组肺动脉高压的有效策略。目前口服内皮素受体拮抗剂有:波生坦、马昔腾坦(均为非选择性拮抗剂)和安立生坦(选择性受体A)。FDA警告这三种药物对胎儿有致畸风险。因此,对女性患者使用该药物时需要严格控制并建议避孕或绝育。对非妊娠患者,此类药物可改善肺血液动力学和运动耐力。
磷酸二酯酶5型抑制剂
一氧化氮是血管平滑肌的有效血管扩张剂。西地那非和他达拉非均为环鸟苷磷酸二酯酶5型抑制剂,可增强一氧化氮的血管舒张作用。西地那非改善1组肺动脉高压患者的肺血液动力学和运动耐力,这种改善似乎具有持续性。他达拉非对1组肺动脉高压患者的预后也有良好的效果。
手术治疗
晚期或失代偿性肺动脉高压症患者发生右心衰是一个潜在的致命过程,治疗通常针对降低右室负荷,最大限度地增加氧合和灌注。手术选择包括房间隔造口术、ECMO和移植。
房间隔造口术导致心房水平右向左分流。由于氧合不足血液进入体循环出现动脉血氧饱和度下降。这种氧饱和度的降低是可耐受的,因为心输出量提高了60%。
对严重肺动脉高压和顽固性右心衰竭房间隔造口是一种姑息性治疗,对病情起到缓解作用。手术死亡率高,可能与肺动脉高压和右心衰的严重程度有关。房间隔造口术不能在妊娠期间实行,可考虑在产后处理。
体外膜氧合可用于血流动力学不稳定并伴有严重肺动脉高压的患者。ECMO有两种类型,静-动ECMO和静-静ECMO。ECMO不是治疗目的,而是为移植手术提供过渡。在一项对6例严重肺动脉高压产后女性使用ECMO研究发现,所有6名患者均在随后几个月内死亡。早前有报道ECMO成功地用于一例失代偿期患者剖宫产分娩。尽管病人在围产期幸存,大约1年后最终死于并发症。
肺移植和心肺联合移植
如果在最大限度的药物治疗下心功能持续III-IV级,运动评分较低或下降,且依前列醇治疗无效,心功能衰竭,心脏指数小于2L/min/m2,右房压升高15mmHg,则可考虑肺移植。移植包括单肺移植、双肺移植或心肺联合移植。
对于肺动脉高压患者的移植选择目前没有共识。心肺联合移植一般用于因顽固性右心衰竭而对强心升压药物依赖的患者。在器官共享联合网络目前使用的优先顺序方案中,肺动脉高压的得分低于其他更常见的疾病。肺动脉高血压的肺分配分数通常较低,移植率较低,移植等待死亡率高于其他肺部疾病。
妊娠期处理
妊娠肺动脉高压的管理需要个体化,需要在具有肺动脉高压专业的中心管理,并多学科协作,且具备ECMO和移植能力等高级心肺支持条件。
对于所有肺高压妇女一旦妊娠应考虑终止,不管心功能分级如何,合并肺高压妊娠期母婴死亡率较高。大多数病例回顾性分析建议终止妊娠,可最大限度降低孕产妇死亡;近期文献报告死亡率接近50%。如果决定终止妊娠应在具备条件的医疗机构进行。
医学管理
管理取决于肺动脉高压的病因、右心导管血流动力学指标、心功能分级、步行运动试验及是否对钙离子阻滞剂有反应。
妊娠期靶向治疗
目前缺乏妊娠期靶向治疗标准。已有许多妊娠期靶向治疗报道。孕前前列腺素类药物的使用提示基础疾病已经较为严重。这些药物的使用管理应该在多学科团队指导下进行,该团队包括肺高压专家。
前列腺素类是一种有效的血管扩张剂,没有已知致畸作用,但在人类中还没有进行深入研究。母体获益可能超过对胎儿的潜在风险。用药途径包括肠外或吸入。
磷酸二酯酶5抑制剂单独或与前列腺素联合用于妊娠并取得良好效果。除具有正常右心功能和肺血流动力学指标接近正常,否则一般不单独使用。因妊娠期致畸,内皮素受体拮抗剂应停止使用,并应按照肺高压专家建议,改用其他靶向药物。同样因致畸考虑,妊娠期避免使用可溶性鸟苷酸环化酶激动剂。
抗凝
对于肺动脉高压患者妊娠期抗凝策略的建议尚不多见。考虑到对胎儿的影响,妊娠期不建议使用华法林,应考虑选择低分子肝素抗凝。如果既往有指征妊娠期应继续使用抗凝药物。对以前未抗凝的,产前和产后应预防性抗凝治疗。
产前管理
妊娠合并肺动脉高压患者应在具备条件的医疗机构进行管理。妊娠期正常生理变化将加重患者心脏负担进而失代偿甚至死亡。生理变化始于孕早期,但没有中晚孕期变化显著。贯穿于产前、产时和产后的重点应是保持循环血量稳定,避免体循环低血压、低氧血症和酸中毒,因为这些状况会导致顽固性心衰。
在妊娠与肺高压心脏病登记中,50%的患者需要入院,大多数是因为心衰。其中三分之一的病人需要一次以上的入院。入院时的中位数孕周为27周(第1至第3四分位数为19.6–35.1周)。
孕早期,应仔细评估患者的基础心肺状态,并讨论终止妊娠可能。还应询问用药情况。一般来说,如果孕前采取靶向治疗,应建议继续进行治疗。然而,有些药物可能具有致畸性,需要转为替代药物。如果患者对钙通道阻滞剂有反应,应继续服用。在使用前列腺素类药物时也可加用钙通道阻滞剂,能降低并发症,改善预后,死亡率也较低。
孕中期,伴随着体循环和肺血管扩张,血容量和心输出量也增加。右室此时可能会出现超负荷,并导致心衰或失代偿。
晚孕期初开始出现更为明显的生理变化,这种状态持续至临产和分娩。该阶段需要增加评估母胎频率。
早孕期随访频率至少每月一次,应在母胎专家和肺高压专家指导下随访。随后每周或每2周进行一次评估。鉴于失代偿和心衰风险,应主动和频繁地监测心肺状态。包括定期超声心动图、BNP和6分钟步行试验,以及生命体征和脉氧测定评估以及右心衰体征的体格检查。如果出现心衰症状,建议住院治疗。根据患者的临床情况,可考虑右心导管置入。
产时管理
产时和分娩时应严密监测母胎状况,因为母体面临着严重的右心失代偿风险。在产时、分娩和产后,由于疼痛、焦虑和儿茶酚胺释放的共同作用,心脏输出量和耗氧量均增加。此外,屏气可导致静脉回流减少和潜在低血压,因此,保证右心充足充盈可对抗肺阻力增加,应避免屏气动作。胎儿娩出后会立刻出现静脉回流增加,此时严重患者可出现心室超负荷、心衰和死亡。
患者应在可持续侵入性血流动力学监测的单位接受管理,并且需要多学科协作。母体无创监测应包括心肺、脉氧和血压监测。对于严重肺动脉高压、1组肺动脉高压或艾森曼格综合征应考虑侵入性监测,如中心静脉导管监测右室前负荷。肺动脉导管不常规用于危重病人的监测;但是,在某些情况下,肺动脉导管可能特别有助于指导紧急情况下的前列环素治疗或评估肺动脉压和肺血管阻力。采用动脉导管监测血压波形轮廓评估和监测心输出量。如前所述,产后具有最大失代偿和死亡风险,需要严密持续监护。
麻醉
麻醉选择是管理肺动脉高压的重要组成部分。充分止痛,特别是产时,是减少心排出量波动的重要措施。全麻可能对肺动脉高压患者产生不利影响。研究表明,分娩时,与椎管麻醉相比,全麻与产妇死亡率呈相关性。气管插管和正压通气可增加胸内、肺动脉压,从而降低静脉回流。然而, 也有妊娠合并肺动脉高压全麻成功的报道。
椎管麻醉不增加胸内压力,且止痛效果良好。大量文献表明对于此类病人分娩或剖宫产实行椎管麻醉安全有效。有效维持静脉回流和防止低血压非常重要,通常选择硬膜外或联合低剂量腰麻。艾森曼格综合征(右向左心内分流的肺动脉高压),体循环阻力下降可导致右向左分流恶化,缺氧加重甚至死亡。对于高危患者,椎管麻醉和全麻均会带来体循环阻力下降,增加死亡风险。因此,应由经验丰富的麻醉医生实行椎管麻醉尽量达到最小幅度的血压和体循环阻力下降,最大程度的维持血液动力学稳定。
分娩时机与方式
对于肺动脉高压孕妇,最佳分娩时机仍不确定。选择性分娩可带来一些好处,如资源和人员的可用性、分娩地点的可选择性以及在病情出现恶化前分娩等好处。因此,有人建议在妊娠34-36周时计划分娩。事实上,肺高压合并妊娠早产率明显上升,包括医源性和自发性原因,据报道早产率在22-78%之间。
理想的分娩方式仍然存有争议。肺高压患者无论是在麻醉下剖宫产还是经阴分娩时均存在失代偿和死亡的高风险。
第二产程中屏气用力增加胸内压和腹压降低静脉回流。由于肺动脉高压患者的心脏输出依赖于足够的前负荷,屏气用力可迅速降低前负荷,导致心肺功能崩溃。分娩时的生理应激导致儿茶酚胺升高、心率加快、耗氧量增加,交感神经紧张、肺血管收缩。充分的椎管麻醉可以使这些影响最小化,甚至可不需要屏气用力。手术阴道助产可避免或减少屏气用力及缩短第二产程。
肺动脉高压患者接受非产科手术同样会增加风险,包括死亡,这意味着剖宫产也有类似风险。在妊娠和心脏病登记的151例合并肺动脉高压孕妇,63%接受了剖宫产手术,90%是因为心脏原因。其中5例产妇死亡,阴道分娩组无一例死亡。死亡病例中有2例发生在紧急剖宫产后,1例发生在终止妊娠后,其余两例于计划剖宫产术后死亡。最近一项对49例不同病因肺动脉高压孕妇研究发现,61%的患者行阴道试产,成功率为75%。剖宫产组的死亡率(18%)高于阴道分娩组(5%)。值得注意的是,第1组重度肺动脉高压患者接受剖宫产术的死亡风险似乎最大。
尽管许多专家建议剖宫产,但缺乏支持这一建议的证据。欧洲心脏病学会的最新指南提示有证据表明计划性剖宫产或阴道分娩比产时或紧急剖宫产风险降低。分娩方式应个体化,根据患者的产科病史、阴道分娩成功的可能性、肺动脉高压类型及严重程度、WHO心功能分级和血流动力学指数综合决定。
产后
产后第一周是孕产妇死亡的高峰时段,分娩后患者应在重症监护室连续监测数天,观察其血流动力学变化。因右室可能超负荷,应给予利尿治疗。有人主张积极利尿,并将CVP升高作为右心压升高的标志来指导利尿。不过,要高度警惕右心容量状态,并在右心衰出现时采取适当的措施。
建议产后避孕。对于肺动脉高压女性,口服联合避孕药可能更危险,因为血栓栓塞风险增加。长效可逆性避孕措施,如宫内节育器,由于具有副作用小、有效性和易用性,可考虑作为首选避孕方法。如果采用剖宫产分娩,术中应行绝育手术。
出院后,患者应在门诊严格随访仔细评估右心功能,因为死亡的风险仍然存在。
 妇产科在线APP下载
妇产科在线APP下载













