【编者按】子宫内膜癌是发达国家最常见的女性生殖系统肿瘤,发展中国家里,在女性生殖道恶性肿瘤中居第三位(仅次于卵巢癌和宫颈癌),每年有接近20万的新发病例。在北美和欧洲,其发生率仅次于乳腺癌、肺癌、结、直肠肿瘤,高居女性生殖系统癌症的首位。2018年10月17日,美国肿瘤综合协作网(National Comprehensive Cancer Network,NCCN)公布了《2018 NCCN子宫肿瘤临床实践指南》,同月,FIGO公布了子宫内膜癌报告,解放军总医院第一医学中心妇产科李立安教授在本文中就子宫内膜癌治疗进展进行了解读。
1. 发病情况
子宫内膜癌在世界恶性肿瘤发病居第六位,每年大约确诊32万例。高收入国家子宫内膜癌发病率高于贫困国家(5.9VS4.0),但是,后者的特异性死亡率较高。子宫内膜癌的75岁累积风险在高收入国家为1.6%,而在低收入国家为0.7%,可能与高收入国家人群中肥胖和体力活动较少(子宫内膜癌的高风险因素)有关。特别地,绝经后肥胖妇女雌激素水平升高是子宫内膜癌风险增加的最可能原因。相反,体力活动增多和长期雌孕激素联合治疗可以降低子宫内膜癌风险。肥胖与子宫内膜癌早期诊断以及子宫内膜样癌相关,而与非子宫内膜样癌并无相同的相关性,可能与肿瘤形成机制不同有关。
北美地区以及欧洲,子宫内膜癌是女性生殖道肿瘤发病率最高的,仅次于乳腺癌、肺癌、结肠癌,位于女性恶性肿瘤发病率第四位。欧洲地区,子宫内膜癌在肿瘤致死中排第八位,2012年有23700死亡。美国排在第六位,每年新发病例55000例,死亡病例11000例。高收入国家中,子宫内膜癌发病率增高与肥胖和预期寿命增加有关。另外,雌孕激素联合治疗围绝经期症状广泛减少也是可能的发病增加的原因。
子宫的上2/3位于宫颈内口上方,成为宫体。输卵管位于倒梨形宫体的双侧角。输卵管开口前位于子宫肌层的部分称为间质部。子宫体癌通常是指子宫内膜癌,发生于宫腔粘膜层,首先局部侵犯子宫肌层。来源于子宫间质和肌肉组织的恶性肿瘤为子宫肉瘤。子宫体的淋巴系统由三个主要淋巴管组成。包括子宫卵巢(漏斗骨盆的),子宫旁,和骶骨前的。汇集淋巴液引流向髂内、髂外、髂总、骶前及腹主动脉旁。腹主动脉淋巴结直接转移并不常见,但解剖学和前哨淋巴结研究已经证实腹主动脉旁淋巴结可直接通过骨盆漏斗韧带转移。阴道、卵巢、肺部是最常见的转移部位。
2.病理生理学和组织病理学
在大部分病例中,子宫内膜样腺癌始于癌前病变子宫内膜不典型增生。其它组织类型如浆液性癌和透明细胞癌,多为基因突变的结果。抑癌基因P53突变在浆液癌中起关键作用。
依据WHO/国际病理学会分类,子宫内膜癌组织病理类型如下(须镜下确认)

除子宫内膜癌的分类外,子宫肿瘤包括混合上皮和间质的肿瘤包括:
1.子宫腺肌瘤
2.非典型息肉样腺肌瘤
3.腺纤维瘤
4.肉瘤
5.癌肉瘤:其中上皮性和间充质成分均为恶性、被认为是化生性癌,按浸润性癌治疗。
子宫内膜癌传统上被归类为以下两类:1.Ⅰ型(1级和2级子宫内膜样癌)最多常见的子宫内膜癌。它们可能源于不典型增生并与雌激素过度刺激有关。因此常早期诊断,预后较好。2.Ⅱ型子宫内膜癌较少见,包括3级子宫内膜样癌和非子宫内膜样癌,由萎缩的子宫内膜发展而来。为非雌激素依赖肿瘤。一般确诊较晚,预后较I型差。
2013年癌症基因组计划(The Cancer Genome Atlas, TCGA)提出了子宫内膜癌的分子分类计划,计划组运用多平台分析,整合基因组学、转录组学、蛋白组学、基因拷贝数量和甲基化数据,研究并划分了4类不同的分子亚型:
(1)多聚酶ε基因(polymerase epsilon, POLE)超突变组,
(2)微卫星不稳定高突变组,
(3)低拷贝数异常(copy number abnormalities-low, CN-L)组
(4)高拷贝数异常(copy number abnormalities-high, CN-H)组
该分子分型计划同时提供了相关预后信息:POLE超突变组具有最佳的无进展生存率,而CN-H组最差,微卫星不稳定高突变组和CN-L组则具有中等的生存曲线。
组织病理学分级(G)分为: GX: 不能确定分级; G1: 高分化;G2: 中分化;G3: 低分化或未分化。
3.诊断
人群筛查子宫内膜癌的效果仍需要进一步证实。经阴道超声特异性和敏感性均高,可以作为筛查手段。筛查仅限于高危人群,如LynchII综合征且要求保留生育功能者,在决定行预防性子宫切除之前。在这些病例中,从35岁开始每年进行经阴道超声检查和宫腔抽吸活检。在40岁以后的Lynch综合征突变携带者中,应考虑行预防性手术(全子宫双侧输卵管卵巢切除),以预防子宫内膜癌和卵巢癌的发生。
体格检查之后,常用超声检查排除子宫内膜癌,当子宫内膜厚度小于5mm时,超声有很高的阴性预测值。经阴道超声联合诊刮子宫内膜活检子宫内膜癌的阴性预测值可达到96%。需要活检时,可在诊室使用一次性专用器械完成。不能确定诊断时,需要宫腔镜检查,使用柔性器械,也可以不在麻醉下进行。然而,宫腔镜下膨宫液导致肿瘤细胞进入腹腔影响预后仍无定论。宫颈过紧或不能耐受检查者,仍需麻醉下进行。
明确组织学诊断后,要完成进一步的评估,包括局部肿瘤范围,有无远处转移的证据,以及围手术期风险。
子宫内膜活检标本病理报告需要明确肿瘤类型和分化程度。总的来说,子宫内膜癌术前活检和最终诊断的病理分级一致性中等。而G2的术前术后符合率最低。宫腔镜活检和最终诊断符合率高于诊断性刮宫,但和诊室内活检并无显著差异。
确诊子宫内膜癌后,术前还要完成血生化,血常规,以及一些常规检查。胸部X线检查通用,成本低,可以评估有无肺转移。血清CA125检查可用于晚期病例随访。在肝功异常以及宫旁或阴道转移的患者,要进行转移评估。高危病例中,行胸部、腹部、盆腔CT检查,或者PET-CT检查,有助于决定手术方式。如果怀疑膀胱和直肠受侵,可考虑行膀胱镜检查和直肠镜检查。
4.分期
表 1 FIGO子宫内膜癌分期
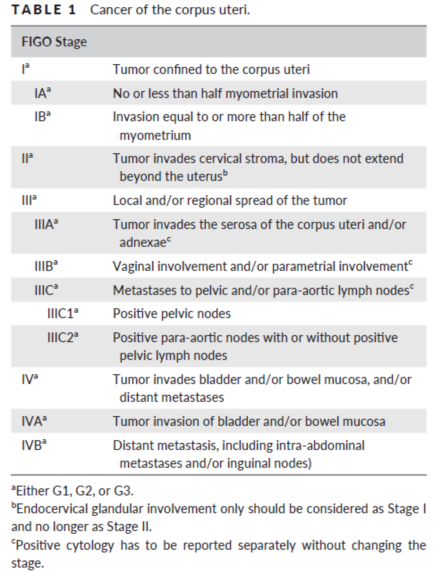
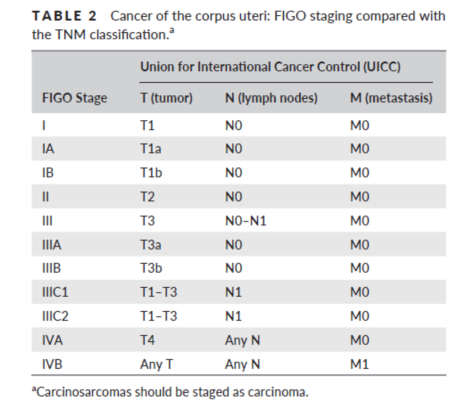
*区域淋巴结 (N):NX: 区域淋巴结无法评估; N0:无区域淋巴结转移;N1: 盆腔淋巴结转移; N2: 腹主动脉旁淋巴结转移,伴有或不伴有盆腔淋巴结转移。
*远处转移 (M): MX: 远处转移无法评估;M0: 无远处转移;M1: 远处转移 (包括腹股沟淋巴结转移或腹腔转移).
分期中,需要测量肿瘤距浆膜面的距离,病理报告中要详细描述切除的子宫标本的其它特征。需要描述有无淋巴管间质浸润需(LVSI),LVSI阳性预后较差,尤其是多部位的LVSI阳性。尤其在I期子宫内膜癌患者中,LVSI阳性的预后相关性要高于IA和IB期。任何肿大和可疑淋巴结都应该切除。高危型子宫内膜癌(G3,深肌层浸润,宫颈受累,浆液性或透明细胞癌)推荐行腹主动脉旁淋巴结切除
1971年FIGO制定的临床分期,适用于一小部分初始治疗为放疗的子宫内膜癌。
5.预后高危因素
早期出现绝经后出血病例预后较好,但要根据证据制定诊疗方案,适当情况下,由MTD团队制定诊疗方案。以下四个病理学特征为子宫内膜癌的高危因素。(1) G 3 低分化iated)(2)LVSI(淋巴血管间质浸润)(3)非子宫内膜样癌(4) 宫颈间质受累。
MRI扫描和术中冰冻切片可以准确判断肌层浸润深度和宫颈受累情况。MR和CT在评估淋巴结转移等效,但不能取代可以获取组织病理诊断的手术淋巴结活检。PET-CT是最好的评估淋巴结和远处转移的影像学检查方法,可用于高危型和晚期病例。PET-MR的作用仍在评估。存在子宫外病变的患者,其是存在小淋巴结受累,腹腔内种植,以及附件转移者,应进行全面的手术病理分期和减瘤术,以为辅助治疗提供依据。
 妇产科在线APP下载
妇产科在线APP下载










 京公网安备 11010202008857号
京公网安备 11010202008857号