目录
1. BRCA1/2突变携带者预防性切除卵管和延迟切除卵巢
2. GOG 218方案中卵巢癌患者的神经毒性
3. 卵巢癌治疗的经济模型
4. 人类输卵管伞三维培养模型
5. 在新诊断内膜癌患者中以简短的家族史问卷筛查Lynch综合征
6. II期子宫内膜样癌的复发模式和生存终点
7. 子宫/肌瘤粉碎发现的恶性病变
8. 少见卵巢上皮癌的治疗
9. 经阴道短距放疗治疗内膜癌
10. 内膜粘液性化生
11. 卵巢癌细胞类型的分布和病例病死率
12. 口服依托泊苷+静脉伊立替康治疗铂类耐药和紫杉烷类治疗过的卵巢癌患者
13. 褐藻多酚增加顺铂的杀肿瘤效果,并能缓解顺铂的肾毒性
14. 吉西他滨和长春瑞滨作为二线或三线方案治疗原发耐药或铂类耐药的复发性卵巢癌和原发性腹膜癌
15. 以HPV筛查原发宫颈癌
16. 人类胎盘生长激素(hGH-V):GTD的一种潜在标记物
17. 早期外阴癌中淋巴结成像和前哨淋巴结切除与完全切除淋巴结的比较
18. 二甲双胍和内膜癌风险
19. NCCN-FACT Ovarian Symptom Index-18 (NFOSI-18)内容的准确性
20. 紫杉醇、卡铂和贝伐单抗治疗晚期和复发性内膜癌
21. I期卵巢透明细胞癌合并淋巴血管间隙浸润(LVSI)的生存结局
22. 上皮性卵巢癌初次术后手术部位的感染
23. 卵巢恶性生殖细胞肿瘤(MOGCT)辅助性治疗后的生育力和性腺功能
24. 早期宫颈腺癌是否需要切除卵巢
25. IV期外阴癌伴有大块盆腔淋巴结转移患者的生存结局
26. 局限于内膜的癌前病变
27. 成人卵巢颗粒细胞瘤是否需要常规评估内膜情况?
28. PI3K抑制剂pilaralisib(SAR245408;XL147)用于治疗晚期或复发内膜癌
29. MTX单药治疗低危风险的妊娠绒癌
30. 婚姻对于内膜癌生存的影响
31. 病理结局划分I型和II型上皮性癌(EOC)的预后价值
32. 早期内膜癌肾静脉以下水平腹主动脉旁淋巴结的机器人手术切除
BRCA1/2突变携带者预防性切除卵管和延迟切除卵巢
这是对39例BRCA1/2突变携带者和23位遗传肿瘤学领域专家的调查和访谈[1]。对于预防性切除卵管、是否切除卵巢的利弊,患者和医生有着不同侧重的关注点。大体上,虽然医患对于预防性切除卵管、延迟切除卵巢仍有怀疑和不确定,但似乎倾向于认同这种方案以取代标准的预防性切除双附件。大部分医患参与者都愿意参加今后的非随机性对照研究,而不是随机对照研究。
GOG 218方案中卵巢癌患者的神经毒性
GOG 218研究是分析贝伐单抗对于卵巢癌化疗初治效果的随机对照研究,2011年发表于NEJM。该研究发现,在卡铂和紫杉醇方案基础上加用贝伐单抗10个月可以延长晚期上皮性卵巢癌患者4个月的中位无进展生存[2]。在这篇神经毒性的研究中,1864例患者中1329例发生了Common Toxicity Criteria ≥1级的神经毒性,差不多一半的患者在头两次化疗结束后就出现症状,而31%的患者经历了Common Toxicity Criteria ≥1级的神经毒性。作者发现,研究初始的年龄和生活质量评分与化疗导致的神经毒性密切相关,用多西他赛替代紫杉醇不能改善神经毒性的症状。因此,可以考虑在某些患者中以非紫杉烷类药物行一线化疗[3]。
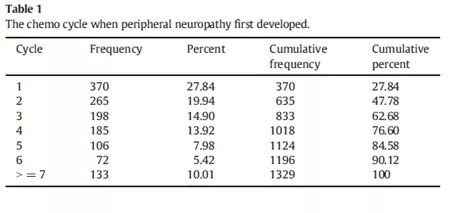
卵巢癌治疗的经济模型
这是基于GOG 218研究的一项成本效用分析[2]。本研究的出发点在于,前瞻性收集有关费用和生活质量的资料对于更好地进行成本效用分析是至关重要的,那些不考虑生活质量的经济模型对患者而言并没有太大价值[4]。在GOG 218的三种方案中,紫杉醇+卡铂(PC)最便宜(4044美元),效果也最差(平均1.1 QA-PFY [质量调整的无进展年])。加用贝伐单抗后(即PCB),平均费用43,703美元,效果可达1.13 QA-PFY。加用贝伐单抗的维持治疗(即PCB+B)最昂贵(122,700美元),效果可达1.25 QA-PFY。相对PC方案,PCB+B的成本效益增加值比率为792,380美元/QA-PFY。在没有考虑生活质量的经济学模型中,和PC方案相比,PCB+B的成本效益增加值比率为632,571美元/PFY。
因此,作者认为,由于成本极其昂贵,对于晚期卵巢癌患者的治疗,加用贝伐单抗并没有成本效益的优势。
人类输卵管伞三维培养模型
这是体外组织学培养研究[5]。结果发现3D伞端结构能够维持正常组织学形态达7天,包括上皮亚型。以双氧水或胰岛素治疗能够显著诱导增殖,不过如论哪种治疗都不影响p53的稳定性。另外,单独以雌二醇治疗能够显著诱导其靶向孕激素受体的经典模式以及IL8的表达,这些都和预后不良有关。
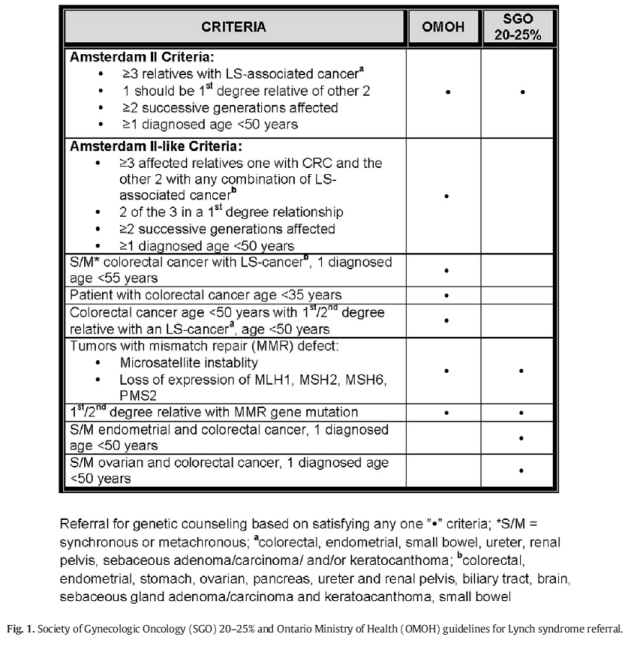
在新诊断内膜癌患者中以简短的家族史问卷筛查Lynch综合征
这是一项前瞻性研究[6]。总计87例患者接受了家族史和家系突变状态的检查,作者比较了简短家族史问卷(bFHQ)和扩展家族史问卷(eFHQ)、病历记录筛查Lynch综合征的准确性,结果,15例确诊Lynch综合征的患者中,bFHQ发现了7例,而eFHQ和病历记录只发现了5例和4例。bFHQ的敏感性、特异性、阳性预测值和阴性预测值分别为100%、76.5%、25.9%和100%,与免疫组化行错配蛋白检查的准确性类似。尽管eFHQ特异性优于bFHQ,但是漏诊2例。图1是SGO和OMOH有关疑似Lynch综合征的转诊标准,图2是简短家族史问卷。

II期子宫内膜样癌的复发模式和生存终点
这是一项多中心研究,包括130例患者[7]。5年的无复发生存、疾病特异的生存和总体生存率分别为77%、90%和72%。在多因素模型中,辅助性放疗、淋巴血管间隙浸润和高肿瘤级别是显著的无复发生存的预后因素,淋巴血管间隙浸润、高肿瘤级别是疾病特异性生存的预后因素,年龄较大和高肿瘤级别是总体生存的预后因素。和辅助性盆腔放疗相比,阴式短距放疗似乎就足够了。
子宫/肌瘤粉碎发现的恶性病变
这是一项回顾性队列研究[8]。结果总计发现10例恶变,包括3例子宫内膜样癌、1例子宫浆液性癌、3例内膜间质肉瘤和3例平滑肌肉瘤,总体恶变率为0.73%。
少见卵巢上皮癌的治疗
作者在这篇综述中将卵巢上皮性癌分为1类(低级别肿瘤)和2类(高级别肿瘤)。作者认为,统一的治疗策略并不适用于罕见类型的卵巢上皮癌,除了高级别浆液性癌之外,绝大部分其他类型的上皮性癌都存在一定程度的耐药,尤其是晚期患者。作者总结了这些罕见类型的遗传学、分子学和临床学差别,尤其是1类肿瘤[9]。我们以后再详细介绍。
经阴道短距放疗治疗内膜癌
本文为综述[10]。经阴道短距放疗(VBT)用于早期内膜癌治疗后复发率很低(0-3.1%),毒性反应率也低。PORTEC-2研究支持应用辅助性的VBT代替外照射,尤其是高中风险的内膜癌患者。VBT相关的急慢性胃肠道和泌尿系毒性较低,继发恶性肿瘤的风险也很低。VBT主要的毒性反应是阴道萎缩和僵硬,这种情况下是否应用阴道扩张进行预防仍有争议。有数据支持患者乐意参与有关辅助治疗的治疗决策,且患者对辅助性VBT受益的最小期望值不师。
American Brachtherapy Society和American Society ofRadiation Oncology的指南支持SGO的医师应用辅助性的VBT。
内膜粘液性化生
本文是综述[11]。粘液性化生是内膜上皮化生的少见类型,通常和高雌激素状态或激素替代治疗有关。组织学发现包括单纯的宫颈内膜类型的粘液上皮到结构复杂的复合粘液性增生。对于内膜活检标本,粘液性化生具有诊断的挑战性,应该和宫颈内膜微腺体增生、粘液性或混合性粘液性癌、内膜样癌相鉴别。单纯粘液化生其恶变风险很低,但是结构复杂的病例通常在后续的活检中发现浸润性癌症。
卵巢癌细胞类型的分布和病例病死率
这项回顾性研究包括562例患者[12]。作者按照I型(内膜样、粘液性、透明细胞和低级别浆液性癌)以及II型(高级别浆液性癌和癌肉瘤)标准进行分离。结果发现,86%的病例是II型晚期癌症,低期别的几乎都是I型的。只有1.7%的II型肿瘤通过全面分期术诊断为I期。85%的死亡病例来自II型肿瘤,5%来自透明细胞癌。II型肿瘤中,高级别浆液性癌和癌肉瘤的细胞类型特异的病例病死率分别为62%和79%。而I型肿瘤中,低级别浆液性癌、透明细胞癌、内膜样癌和粘液性癌的病例病死率分别为38%、36%、27%和13%。不同肿瘤医师之间诊断的重复性非常好,kappa值为0.83。病例病死率计量所有人群中死于所患疾病的比例。
口服依托泊苷+静脉伊立替康治疗铂类耐药和紫杉烷类治疗过的卵巢癌患者
这是JCOG0503的II期临床研究[13]。总计包括60例患者,1例CR,12例PR,反应率、PFS和OS分别是21.7%、4.1个月和11.9个月。分别有11例患者(4例老年患者)和3例患者(2例老年患者)发生发热性中性粒细胞减少和可能的治疗相关的死亡。这种方案的反应率没有达到主要研究终点20%的下限。由于其毒性反应,作者不推荐在临床研究之外应用该方案,尤其是老年患者。
褐藻多酚增加顺铂的杀肿瘤效果,并能缓解顺铂的肾毒性
这是韩国的一项动物试验[14]。结果发现富含多酚的黑昆布(Ecklonia cava)提取物能够通过ROS/Akt/NFKB途径增强卵巢癌细胞凋亡,从而增强顺铂对肿瘤生长的抑制作用;并能够抑制顺铂对正常肾细胞的破坏,从而缓解顺铂导致的肾毒性。起主要作用的是其中的一种多酚类物质,diechol。
吉西他滨和长春瑞滨作为二线或三线方案治疗原发耐药或铂类耐药的复发性卵巢癌和原发性腹膜癌
这是韩国的一项II期临床[15]。总计包括44例患者,方案为3周一次,第1天和第8天给予长春瑞滨25 mg/m2,吉西他滨1000 mg/m2,反应率为22.7%,中位反应持续时间为5.9个月,1例完全缓解,9例部分缓解,17例维持SD状态(中位3.3个月)。中位PFS和OS分别为3.4个月和14.5个月。中性粒细胞减少是最常见的毒性反应,15例患者需要减量。没有治疗相关的死亡。
以HPV筛查原发宫颈癌
这是ATHENA的研究最终结论[16]。ATHENA研究是一项在≥25岁女性中开展的为期3年的队列研究,比较以HPV作为主要筛查方案检查宫颈癌的效果。研究总计招募了42,209例女性,均行HPV和细胞学检查。异常细胞学(≥ASCUS)以及HPV阳性的结果行阴道镜检查。检查结果< CIN2+(这是研究的主要终点)接受为期3年的随访。
结果发现,对于细胞学阴性的女性,3年中CIN3+的累积发生率是0.8%(95% CI 0.5-1.1%),而HPV阴性的女性,3年中CIN3+的累积发生率是0.3%(95% CI 0.1-0.7%)细胞学和HPV均阴性的女性,CIN3+的累积发生率是0.3%(95% CI 0.1-0.6%)。细胞学发现CIN3+的敏感性为47.8%(95% CI 41.6-54.1%),而混合筛查策略(25-29岁间行细胞学,30岁以上行细胞学和HPV联合检查)发现CIN3+的敏感性为61.7%(95% CI 56.0-67.5%),HPV筛查策略发现CIN3+的敏感性为76.1%(95% CI 70.3-81.8%)。细胞学、混合筛查策略和HPV筛查策略发现CIN3+的特异性分别为97.1%(95% CI 96.9-97.2%)、94.6%(95% CI 94.4-94.8%)和93.5%(95% CI 93.3-93.8%)。虽然HPV筛查能够发现更多的CIN3+病例,但是这种筛查策略需要更多次数的阴道镜检查(多于细胞学筛查的情况,和混合筛查策略中需要阴道镜检查的数目类似)。
总之,和混合筛查策略相比,HPV筛查策略具有类似的效果,但是需要进行的筛查次数要少一些。编辑部特地为这篇文章配发了一篇评论[17]。
人类胎盘生长激素(hGH-V):GTD的一种潜在标记物
这是一项免疫组化研究[18],在16例患者的标本中开展进行。结果发现,在所有GTD个体的合体滋养细胞中中都有hGH-V分布,而且血清中可以检测出来。由于其半衰期很短,也许可用于诊断GTD并检测手术或药物治疗的效果。
早期外阴癌中淋巴结成像和前哨淋巴结切除与完全切除淋巴结的比较
这是一项成本效益分析[19],比较根治性外阴切除+广泛腹股沟淋巴结切除(LND)vs. 根治性外阴切除+前哨淋巴结切除(SLNB)的花费和手术结局(修订后的Markov决策模型)。结果发现,SLNB费用更低(13,449美元vs. 14,261美元),更加有效(4.16质量调整的生存年[QALYs] vs. 4.00 QALY)。至于淋巴水肿对于生活质量的影响,该模型是敏感度。除非淋巴水肿对于生活质量的影响非常微小(应用评分> 0.975),SLNB绝对优于LND。在临床合理范围内,SLNB阳性率的变化以及淋巴水肿的可能性均不影响上述结果。
二甲双胍和内膜癌风险
这是一项回顾性队列研究[20],作者利用US healthcare claims (MarketScan?) 2000–2011数据库,比较最近应用二甲双胍vs. 磺脲类的人群罹患内膜癌的风险。总计541.128例合适女性,456,838初始应用二甲双胍,84,290应用磺脲类。平均随访1.2年,总计2,030,914人-年,729例女性发现了内膜癌。应用二甲双胍的女性其内膜癌风险略低(HR 0.81,95% CI 0.67-0.97),但是,经过对糖尿病、PCOS、内膜增生等基础参数的平衡后,二甲双胍并不能降低内膜癌风险(HR 1.09,95% CI 0.88-1.35)。多重敏感性分析,以及糖尿病患者及相关年龄组的亚组分析其结论是一致的。
NCCN-FACT OvarianSymptom Index-18 (NFOSI-18)内容的准确性
NFOSI-18是为了晚期卵巢癌患者提供有临床意义的症状参数[21]。这项研究在18例患者中开展调查[22],结果发现NFOSI-18易于理解,适合描述她们的症状和关注。调查显示,患者女性绝大部分认为乏力、恶心和神经炎是她们最烦恼的不良反应,一般的患者认为乏力和缺少活力是同一概念,其他人或多或少能有所鉴别。
紫杉醇、卡铂和贝伐单抗治疗晚期和复发性内膜癌
这是一项II期临床研究[23]。总计招募了15例患者,1例患者在第一个周期后就出现肠穿孔,14例患者在6个月时无病情进展,中位随诊时间36个月,中位PFS 18个月,中位OS 58个月,5例完全缓解,6例部分缓解,总体生存率73%。即使既往有放疗的患者,该方案也是可以耐受的。
I期卵巢透明细胞癌合并淋巴血管间隙浸润(LVSI)的生存结局
这是一项多中心研究,应用的是2014年最新的FIGO分期[24]。总计232例患者中47例发现存在LVSI,单因素分析显示,LVSI和年龄较大、肿瘤体积较大、IC分期有关。生存分析显示,LVSI降低无疾病生存(5年率70.6% vs.92.1%)和总体生存(5年率78.8% vs. 93.3)。以年龄、肿瘤大小、分期和化疗应用进行校正后,LVSI仍是时独立的预后因素(无疾病生存HR 4.35,OS的HR 4.73)。在210例接受术后化疗的患者中,如果不考虑LVSI状态,化疗类型都并不影响生存结局。而LVSI的患者如果接受≥6个周期的化疗则能显著改善预后。
上皮性卵巢癌初次术后手术部位的感染
一般认为这种感染率为10-15%。这项回顾性研究纳入888例患者,96(10.8%)发生手术部位的感染,影响浅表部位感染的独立的因素包括:BMI增加,手术时间延长,晚期病变。影响器官/腔隙部位感染的独立的因素包括:胃食管反流病史,手术复杂程度,残留病灶等。无论浅表部位的感染(HR 1.69)还是器官/腔隙的感染(HR 1.46)都是总体生存不良的独立的预后因素,但不是无疾病生存的预后因素。
卵巢恶性生殖细胞肿瘤(MOGCT)辅助性治疗后的生育力和性腺功能
这是一项61例MOGCT患者的问卷调查[25],其诊断是年龄< 40岁。在39例尝试受孕的患者中,34例至少受孕一次。15年的治疗后累积妊娠率为28%,在以顺铂为基础的化疗方案治疗后的患者中,化疗周期≤3次的患者其生育力用于>3次的患者(53% vs.20%)。作者还认为抗苗勒氏管激素也许是评估性腺功能的较好指标。
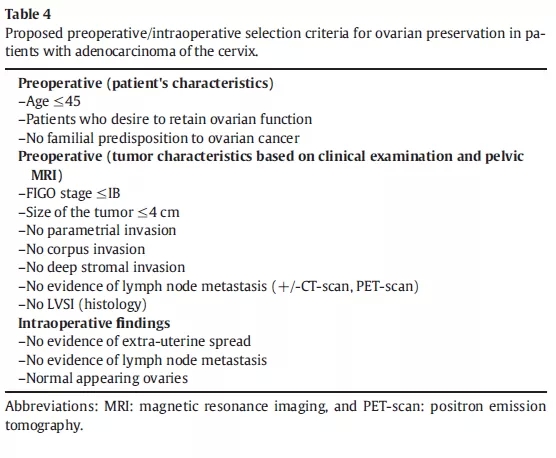
早期宫颈腺癌是否需要切除卵巢
这是一项综述[26]。作者总计分析了10篇评估早期宫颈腺癌(CIS-IIA期)卵巢转移的文章(包括1204例患者)。在所有FIGO分期中,卵巢转移发生率为3.7%(范围0-12.9%),IB期患者中卵巢转移发生率2%(0.8%-3.2%)。在超过100例保留卵巢的CIS-IIA期患者中,经过平均56个月的随访,没有发现卵巢复发的情况。有6篇文章分析了31例卵巢转移的患者,其中30例至少有如下一项高危因素:年龄>45岁,分期> IB期,淋巴结阳性,深部间质浸润,淋巴血管间隙浸润,宫体受累,宫旁受累,肿瘤直径> 4 cm。下表是纳入的文献,以及设想的术前/术中对于保留卵巢的考虑事项。
综上,作者认为,对于早期宫颈腺癌的年轻女性,保留卵巢是安全的。



IV期外阴癌伴有大块盆腔淋巴结转移患者的生存结局
这是一项20例患者回顾性研究[27]。IV期是任何远处转移,包括盆腔淋巴结的情况。这些患者都有影像学评估发现的径线> 1.5 cm的盆腔淋巴结。10例患者接受了放化疗,4例放疗,6例接受了手术治疗+放疗或放化疗。中位随诊47个月。平均外阴肿瘤大小为6.4 cm,12例有2009 AJCC T2级病变,8例有T3级病变。所有患者都有大块的腹股沟淋巴结转移,平均腹股沟淋巴结直径2.8 cm,5年OS和疾病特异的生存分别为43%和48%。11例患者复发,有些是多部位复发,9例在外阴复发,但是没有孤立淋巴结的复发。4例患者在开始放疗后的6个月内出现远处转移。
作者认为,对于这些有大块盆腔淋巴结转移的IV期外阴癌患者,积极的局灶治疗可以改善生存结局,与仅腹股沟淋巴结受累的患者具有可比性。因此作者推荐修订FIGO IVB期分类,以更准确地反映这一类患者的预后。
局限于内膜的癌前病变
局限于内膜息肉的恶变或癌前病变发生率为0.5-6%。这种局限于内膜息肉的不典型内膜增生(AEH)的处理尚不明确。目前越来越倾向于用内膜上皮内瘤变(EIN)的概念代替不典型增生的改变。这篇回顾性研究就是为了评估保守的宫腔镜切除AEH或EIN的结果[28],包括32例内膜息肉AEH的患者,其中25例内膜诊刮结果正常。即使是局限于内膜息肉的12例AEH,宫腔镜检查的标本也发现了11例AEH和1例癌变。内膜息肉的EIN(14例)有57%发现了宫体的EIN或恶变,但是在没有EIN的9例内膜息肉中,仅有1例最终病理发现EIN,无一例恶变。
据此,作者认为,对于恶变或癌前病变侵犯内膜的情况,内膜息肉EIN的诊断是比AEH更好的预测指标,以宫腔镜保守治疗的安全性值得怀疑。
成人卵巢颗粒细胞瘤是否需要常规评估内膜情况?
这是一项回顾性多中心队列研究,总计包括150例患者,在手术时发现29.2%的患者有内膜增生,7.5%的患者有内膜癌。对于年龄≥40岁的女性,97.6%有内膜增生。内膜癌仅见于≥40岁和绝经后的女性[29]。
PI3K抑制剂pilaralisib(SAR245408;XL147)用于治疗晚期或复发内膜癌
这是一项II期临床研究[30]。在67例患者中,总体反应率6.0%(2例CR,2例PR),药物安全性尚可。药物的临床活性和PI3K途径的分子学改变无关。
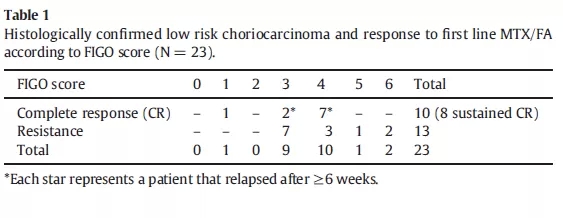
MTX单药治疗低危风险的妊娠绒癌
这是英国的一项回顾性研究[31]。所谓低危,即FIGO 0-6分。这项研究总计包括65例MTX单药治疗的患者(第1,3,5,7天应用50 mg MTX肌注,第2,4,6,8天应用15 mg口服四氢叶酸,2周一个疗程),结果24例不需要任何化疗血清hCG就已经降到正常。在23例组织学确诊绒癌的患者中,8例获得完全缓解且未再复发。对于MTX/四氢叶酸治疗耐药的患者(FIGO 6分以及一例III期患者)通过其他治疗获得挽救。
婚姻对于内膜癌生存的影响
这是一项基于Surveillance,Epidemiology, and End Results项目数据库的研究[32]。总计包括47,420例患者,56%已婚,15%单身,19%寡居。已婚女性低风险内膜癌(1/2级内膜样癌)和局灶病变的可能性更高(p < 0.0001),癌症死亡的风险更低(HR 0.8,95% CI 0.77-0.84)。多因素分析显示,寡居的女性内膜癌生存结局最差。作者建议,对于这些女性应考虑社会心理干预和社会支持。
病理结局划分I型和II型上皮性癌(EOC)的预后价值
这是基于DanishGynecologic Cancer Database数据的一项分析[33],总计包括2660例患者,其中735例划分为I型肿瘤(内膜样、粘液性、透明细胞和低级别浆液性癌),1925划分为II型肿瘤(高级别浆液性癌和癌肉瘤)。II型EOC的患者FIGO分期更晚一些。在头两年,I型和II型之间没有显著的生存差别;730天后,I型肿瘤的总体生存显著提高(HR 1.72,95% CI 1.28-2.31)。Landmark分析也显示了类似的结局(HR 1.85,95% CI 1.35-2.54)。
早期内膜癌肾静脉以下水平腹主动脉旁淋巴结的机器人手术切除
这是一项97例患者的集中报道[34]。肾静脉水平以下(IRL)和肠系膜下动脉水平以下(IMA)的腹主动脉旁淋巴结切除分别为88例和9例,没有改开腹手术的情况。对于BMI > 35 kg/m2的患者,只有81%实现了IRL。仅有2例出现孤立的腹主动脉旁淋巴结转移。值得注意到是,所有切除操作都是在一个trocar穿刺点完成的。
文献目录
[1] Arts-de Jong M, Harmsen MG, Hoogerbrugge N, et al.Risk-reducing salpingectomy with delayed oophorectomy in BRCA1/2 mutationcarriers: Patients' and professionals' perspectives. Gynecol Oncol.2015;136(2):305-310.
[2] Burger RA, Brady MF, Bookman MA, et al. Incorporationof bevacizumab in the primary treatment of ovarian cancer. N Engl J Med.2011;365(26):2473-83.
[3] Chase DM, Huang H, Foss CD, et al. Neurotoxicity inovarian cancer patients on Gynecologic Oncology Group (GOG) protocol 218:Characteristics associated with toxicity and the effect of substitution withdocetaxel: An NRG Oncology/Gynecologic Oncology Group study. Gynecol Oncol.2015;136(2):323-327.
[4] Cohn DE, Barnett JC, Wenzel L, et al. A cost–utilityanalysis of NRG Oncology/Gynecologic Oncology Group Protocol 218: Incorporatingprospectively collected quality-of-life scores in an economic model of treatmentof ovarian cancer. Gynecol Oncol. 2015;136(2):293-299.
[5] Eddie SL, Quartuccio SM, Zhu J, et al.Three-dimensional modeling of the human fallopian tube fimbriae. Gynecol Oncol.2015;136(2):348-354.
[6] Eiriksson L, Aronson M, Clarke B, et al. Performancecharacteristics of a brief Family History Questionnaire to screen for Lynchsyndrome in women with newly diagnosed endometrial cancer. Gynecol Oncol.2015;136(2):311-316.
[7] Elshaikh MA, Al-Wahab Z, Mahdi H, et al. Recurrencepatterns and survival endpoints in women with stage II uterine endometrioidcarcinoma: A multi-institution study. Gynecol Oncol. 2015;136(2):235-239.
[8] Graebe K, Garcia-Soto A, Aziz M, et al. Incidentalpower morcellation of malignancy: A retrospective cohort study. Gynecol Oncol.2015;136(2):274-277.
[9] Groen RS, Gershenson DM, Fader AN. Updates andemerging therapies for rare epithelial ovarian cancers: One size no longer fitsall. Gynecol Oncol. 2015;136(2):373-383.
[10] Harkenrider MM, Block AM, Siddiqui ZA, et al. Therole of vaginal cuff brachytherapy in endometrial cancer. Gynecol Oncol.2015;136(2):365-372.
[11] Turashvili G, Childs T. Mucinous metaplasia of theendometrium: Current concepts. Gynecol Oncol. 2015;136(2):389-393.
[12] Seidman JD, Vang R, Ronnett BM, et al. Distributionand case-fatality ratios by cell-type for ovarian carcinomas: A 22-year seriesof 562 patients with uniform current histological classification. GynecolOncol. 2015;136(2):336-340.
[13] Matsumoto K, Katsumata N, Shibata T, et al. Phase IItrial of oral etoposide plus intravenous irinotecan in patients withplatinum-resistant and taxane-pretreated ovarian cancer (JCOG0503). GynecolOncol. 2015;136(2):218-223.
[14] Yang Y-I, Ahn J-H, Choi YS, et al. Brown algaephlorotannins enhance the tumoricidal effect of cisplatin and amelioratecisplatin nephrotoxicity. Gynecol Oncol. 2015;136(2):355-364.
[15] Hong SH, Lee S, Kim H-G, et al. Phase II study ofgemcitabine and vinorelbine as second- or third-line therapy in patients withprimary refractory or platinum-resistant recurrent ovarian and primary peritonealcancer by the Korean Cancer Study Group (KCSG)_KCSG GY10-10. Gynecol Oncol.2015;136(2):212-217.
[16] Wright TC, Stoler MH, Behrens CM, et al. Primarycervical cancer screening with human papillomavirus: End of study results fromthe ATHENA study using HPV as the first-line screening test. Gynecol Oncol.2015;136(2):189-197.
[17] Schiffman M, Wentzensen N. Transitioning to a new erain cervical cancer screening. Gynecol Oncol. 2015;136(2):175-177.
[18] Hübener C, Bidlingmaier M, Wu Z, et al. Humanplacental growth hormone: A potential new biomarker in gestationaltrophoblastic disease. Gynecol Oncol. 2015;136(2):264-268.
[19] McCann GA, Cohn DE, Jewell EL, et al. Lymphaticmapping and sentinel lymph node dissection compared to complete lymphadenectomyin the management of early-stage vulvar cancer: A cost-utility analysis.Gynecol Oncol. 2015;136(2):300-304.
[20] Ko EM, Stürmer T, Hong J-L, et al. Metformin and therisk of endometrial cancer: A population-based cohort study. Gynecol Oncol.2015;136(2):341-347.
[21] Jensen SE, Rosenbloom SK, Beaumont JL, et al. A newindex of priority symptoms in advanced ovarian cancer. Gynecol Oncol.2011;120(2):214-9.
[22] Jensen SE, Kaiser K, Lacson L, et al. Contentvalidity of the NCCN-FACT Ovarian Symptom Index-18 (NFOSI-18). Gynecol Oncol.2015;136(2):317-322.
[23] Simpkins F, Drake R, Escobar PF, et al. A phase IItrial of paclitaxel, carboplatin, and bevacizumab in advanced and recurrentendometrial carcinoma (EMCA). Gynecol Oncol. 2015;136(2):240-245.
[24] Matsuo K, Yoshino K, Hasegawa K, et al. Survivaloutcome of stage I ovarian clear cell carcinoma with lympho-vascular spaceinvasion. Gynecol Oncol. 2015;136(2):198-204.
[25] Solheim O, Tropé CG, Rokkones E, et al. Fertility andgonadal function after adjuvant therapy in women diagnosed with a malignantovarian germ cell tumor (MOGCT) during the “cisplatin era”. Gynecol Oncol.2015;136(2):224-229.
[26] Omar T, Marie P. Should ovaries be removed or not in(early-stage) adenocarcinoma of the uterine cervix: A review. Gynecol Oncol.2015;136(2):384-388.
[27] Thaker NG, Klopp AH, Jhingran A, et al. Survivaloutcomes for patients with stage IVB vulvar cancer with grossly positive pelviclymph nodes: Time to reconsider the FIGO staging system? Gynecol Oncol.2015;136(2):269-273.
[28] Naaman Y, Diment J, Perlman S, et al. Can malignantpotential of endometrial polyps be determined by incorporating the endometrialintraepithelial neoplasia (EIN) classification? Gynecol Oncol.2015;136(2):254-257.
[29] Ottolina J, Ferrandina G, Gadducci A, et al. Is theendometrial evaluation routinely required in patients with adult granulosa celltumors of the ovary? Gynecol Oncol. 2015;136(2):230-234.
[30] Matulonis U, Vergote I, Backes F, et al. Phase IIstudy of the PI3K inhibitor pilaralisib (SAR245408; XL147) in patients withadvanced or recurrent endometrial carcinoma. Gynecol Oncol.2015;136(2):246-253.
[31] Taylor F, Short D, Winter MC, et al. A retrospectivestudy to evaluate single agent methotrexate treatment in low risk gestationalchoriocarcinoma in the United Kingdom. Gynecol Oncol. 2015;136(2):258-263.
[32] Lowery WJ, Stany MP, Phippen NT, et al. Survivaladvantage of marriage in uterine cancer patients contrasts poor outcome forwidows: A Surveillance, Epidemiology and End Results study. Gynecol Oncol.2015;136(2):328-335.
[33] Prahm KP, Karlsen MA, H?gdall E, et al. Theprognostic value of dividing epithelial ovarian cancer into type I and type IItumors based on pathologic characteristics. Gynecol Oncol. 2015;136(2):205-211.
[34] James JA, Rakowski JA, Jeppson CN, et al. Robotictransperitoneal infra-renal aortic lymphadenectomy in early-stage endometrialcancer. Gynecol Oncol. 2015;136(2):285-292.
(本文由北京协和医院妇产科李雷编译)
本文为作者原创并授权妇产科在线发布,版权归原作者所有,欢迎转载,但请务必注明出处,否则将追究法律责任。
 妇产科在线APP下载
妇产科在线APP下载










 京公网安备 11010202008857号
京公网安备 11010202008857号