摘要
卵巢储备功能减退 (DOR) 包括生殖功能减退和内分泌功能减退,最终导致女性生育力下降。内质网是细胞内重要的细胞器,参与蛋白的合成折叠与分泌、脂质代谢、类固醇激素合成、Ca2+储存等细胞内活动。细胞内外环境的变化,如氧化应激等皆有可能扰乱内质网稳态,导致内质网未折叠蛋白反应 (UPR)。初期UPR有助于维持机体细胞存活,但刺激强度过高或时间过长,则会导致细胞凋亡。越来越多的研究证实,内质网应激参与DOR发生的病理机制,与卵泡闭锁、卵巢纤维化增加、激素合成功能下降等过程密切相关。本文将综述DOR发生发展过程中的内质网应激机制及其研究进展。
【关键词】内质网应激;卵巢储备功能减退;卵泡闭锁;类固醇激素;纤维化
基金项目:江苏省自然科学基金(BK20161592);默克雪兰诺中国生殖医学研究基金(MerckSerono-CREATE-2016023)
DOI:10.3760/cma.j.cn101441-20190601-00233
大概10%不孕女性存在卵巢储备功能减退 (diminished ovarian reserve, DOR)。DOR的临床表现包括生殖功能减退与卵巢内分泌功能减退,导致女性生育能力下降,最终表现为生殖能力的丧失与绝经。DOR病因尚不明晰,可能是多因素共同作用所致,包括遗传因素、医源性因素、环境因素、自身免疫因素、年龄因素等。与其他器官相比,卵巢更易受到年龄的影响。卵巢功能随年龄增加而减退,卵巢发生老化伴随着卵泡闭锁加快、卵泡数目的减少与卵泡质量的降低。随年龄增长,卵泡凋亡增加是DOR的重要原因,其主要病理机制包括氧化应激损伤、线粒体功能低下、能量代谢系统损坏等,近年来的研究还包括细胞自噬和内质网应激。内质网应激是独立于经典的线粒体损伤途径和死亡受体信号途径以外的一种细胞凋亡途径。内质网应激反应的失调是许多衰老相关疾病的病因之一,卵巢的衰老也与内质网应激以及其引起的氧化损伤密切相关。
本文重点阐述DOR发生发展的内质网应激机制及其研究进展。
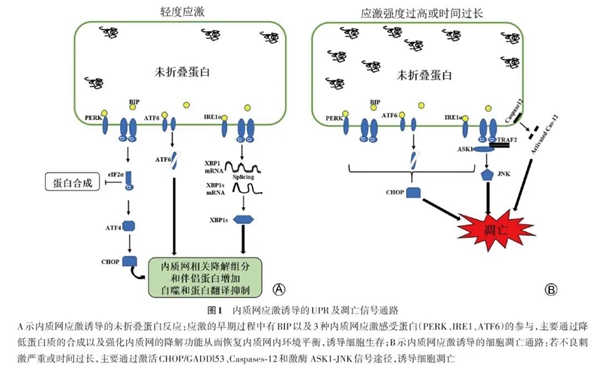
一、内质网应激的双重作用
内质网应激早期主要通过降低蛋白质的合成以及强化内质网的降解功能从而恢复内质网内环境平衡,诱导细胞生存。应激的早期过程中有内质网伴侣蛋白GRP78以及3种内质网应激感受蛋白(PERK、IRE-1、ATF6)的参与(图1A)。GRP78 作为内质网中一个稳定的伴侣蛋白以及感受器,能监控内质网中未折叠蛋白堆积以及内质网应激的发生。当内质网应激出现时,GRP78能由结合态转化为游离态,激活了3条信号通路的蛋白级联反应(图1A)。①IRE1通路:IRE1磷酸化激活后,具有核酸内切酶的活性,可剪切XBP-1的mRNA,剪切后的XBP-1具有转录激活作用,促进分子伴侣和折叠酶的表达,并上调内质网相关降解(ER-associated degradation,ERAD)组分。②PERK通路:应激时,PERK形成同源二聚体,并使eIF2a磷酸化。磷酸化的eIF2a一方面非特异性地终止翻译或阻止新合成的蛋白持续进入内质网,同时特异性上调ATF4基因的表达,启动下游基因CHOP的表达。③ATF6通路:应激时,ATF6转至高尔基体并被蛋白酶切割,切割后的ATF6释放出N-端的转录激活结构域,促进分子伴侣BIP和GRP94的转录,加速蛋白折叠。
若不良刺激严重或时间过长,内质网应激早期的上述3种途径无法代偿缓解,细胞会发生凋亡。研究显示,内质网应激诱导细胞凋亡主要有3条信号途径(图1B)。①CHOP/GADDl53 相关通路:该途径是内质网应激诱导细胞出现凋亡的最关键途径之一。关于CHOP上游调节机制的研究,目前认为3个UPR相关联信号通路均对CHOP的转录有影响。但是CHOP蛋白表达的主要途径是PERK-eIF2α-ATF4途径。对于CHOP下游调控机制仍不清楚,但过多的CHOP能够促使某些凋亡反应蛋白如DR5、GADD34、ERO1和TRB3的增加,从而导致细胞凋亡。CHOP还能调节例如Bcl-2家族蛋白转录,在促进凋亡中发挥重要作用。②Caspases-12通路:Caspase-12通常定位在内质网膜胞质侧,是内质网特有的凋亡途径。IRE-1、Caspase-7和钙蛋白酶途径均可激活Caspase-12。激活的Caspase-12能传递凋亡信号并作用于Caspase家族其他成员如Caspase-3或-9从而激活这些分子终致细胞出现凋亡。③激酶 ASK1-JNK通路:持续不断的内质网应激会导致IRE1招募TRAF2(tumor),进而激活ASK和JNK蛋白激酶,起始凋亡级联反应。
内质网应激诱导的凋亡与衰老密切相关,参与多种老年性疾病的发病机制中,如阿兹海默症、帕金森氏症、糖尿病、动脉硬化。衰老进程中存在着慢性内质网应激以及内质网的功能不断减退;内质网应激及其功能减退也加速衰老,内质网应激与衰老相互影响(图1)。
二、内质网应激与卵巢储备功能减退
卵巢功能主要取决于卵母细胞的数量和质量。卵泡闭锁引起的卵子数量减少、卵子质量下降以及卵巢相关激素合成水平降低是DOR的重要病理生理变化。内质网应激主要通过介导的凋亡途径参与颗粒细胞凋亡、性激素合成下降、卵巢纤维化等过程促进DOR的发生。
1. 卵泡闭锁:哺乳动物中,大多数卵泡发生闭锁。卵泡闭锁的实质就是细胞凋亡,窦卵泡之前的卵泡闭锁主要与卵母细胞的凋亡相关,而窦卵泡之后发生的卵泡闭锁主要是颗粒细胞发生凋亡导致的。颗粒细胞的凋亡机制尚不清楚,已有研究表明,死亡受体和氧化应激引起的凋亡途径参与颗粒细胞的凋亡过程,这两个凋亡途径中的JNK、Bcl2、Bax及TRAF也参与内质网应激介导的凋亡过程。并且最近有研究表明内质网应激介导的凋亡通路在颗粒细胞凋亡中被激活,过度或持续的内质网应激会引起颗粒细胞凋亡。
Lin等将山羊闭锁卵泡液与正常的卵泡液中颗粒细胞的内质网应激相关基因表达量进行检测比较,结果提示GRP78、CHOP在早期闭锁卵泡的颗粒细胞中显著上调,并且在进一步闭锁卵泡的颗粒细胞中,GRP78表达量下调,CHOP表达量进一步升高,内质网应激对细胞的保护作用逐渐转向致细胞凋亡作用。并在体外细胞实验探索内质网应激对颗粒细胞的影响,通过加入内质网诱导物衣霉素诱导颗粒细胞发生内质网应激,导致了颗粒细胞的凋亡。与Lin等结果相一致,Yang等进一步证明了内质网应激介导凋亡通路激活会引起卵巢颗粒细胞的凋亡。
课题组前期研究显示定位于卵巢颗粒细胞内质网中的Peroxiredoxin4(Prdx4)可通过内质网应激介导的凋亡通路参与影响卵巢功能。内质网合成的分泌蛋白和膜蛋白在进行氧化折叠过程中产生大量的H2O2。在哺乳动物的内质网中清除H2O2的主要有3种过氧化物酶:Prdx4和2种GSH过氧化物酶Gpx7和Gpx8,Prdx4和Gpx7都可以利用H2O2并加速底物的氧化折叠,且Prdx4的效率更高,Gpx8 主要致力于减少内质网中H2O2向细胞质的扩散。这3种过氧化物酶,尤其Prdx4提高了内质网中的分泌和膜蛋白氧化折叠的效率,另一方面解决了细胞内H2O2的毒性问题。Prdx4可以保护细胞免受内质网应激和氧化应激,对于细胞内环境稳定起重要作用[30]。并且研究表明,Prdx4主要定位于卵巢颗粒细胞内质网中,其在卵巢颗粒细胞中表达水平与人和小鼠的卵巢功能呈正相关。
2. 性激素合成下降:下丘脑-垂体-卵巢(HPO)轴中促性腺激素和类固醇激素的调节与合成可影响卵巢功能。卵泡刺激素(FSH)是早窦卵泡后促进卵泡生长发育的主要促性腺激素,体内体外实验证实小鼠卵巢颗粒细胞中FSH可以减轻内质网应激,但是严重的内质网应激会抑制FSH促进卵巢激素合成及卵泡发育的功能。既往研究表明GRP78在卵巢颗粒细胞和卵泡膜细胞均有表达,但以颗粒细胞表达为主。GRP78具有结合促性腺激素受体(FSHR和LHR)的能力,内质网应激早期过程中GRP78的升高促进促性腺激素受体正确折叠和转运。内质网同时也是类固醇合成的重要场所,并且内质网应激可能影响类固醇激素合成酶的表达,两者均影响卵巢中类固醇激素的合成。黄体是由排卵后卵泡发育而来的短暂的内分泌组织,主要功能是合成和分泌孕激素。Kogure等[22]在实验中证实GRP78参与细胞表面LHR表达的恢复,启动孕酮的合成。并有研究证实,在猪和鼠的黄体期孕激素合成阶段所有的内质网应激过程中包括适应生存和促凋亡的因子全部升高,Park等在大鼠颗粒细胞中检测到内质网应激诱导生存相关因子(GRP78、ATF6、XBP1)在黄体发育和维持期升高,尤其GRP78在黄体维持期表达量显著增加,在黄体衰退期时下降。Park等和Yang等研究表明内质网应激促凋亡因子(P-JNK、CHOP、Caspase-12)在黄体衰退期表达量明显增加。
综上可见,内质网应激早期诱导的UPR在黄体发育、维持以及促进孕激素合成中起到积极促进作用;内质网应激介导凋亡途径促进黄体萎缩,进入衰退期。已有研究表明GRP78表达和雌二醇水平在子宫内膜中均呈周期依赖性,且呈负相关性,并证实严重的内质网应激可能抑制雌二醇反应。
3. 卵巢纤维化:卵巢纤维化是造成DOR的病理机制之一,主要出现在放化疗后、卵巢早衰的卵巢组织中,且转化生长因子(TGF)-β1、结缔组织生长因子(CTGF)、血管内皮生长因子(VEGF)等生长因子是刺激卵巢组织发生纤维化的主要因素。内质网应激促进组织纤维化发生,尤其肾脏与肺部纤维化,导致脏器功能减退。研究表明内质网应激通过激活促凋亡通路、诱导上皮间质转化、促进炎症反应等,从而促进纤维化重构。内质网应激可由JNK、CHOP介导的凋亡通路的激活,促进炎症和TGF-β1的释放从而发挥促纤维化作用。也有证据表明,内质网应激可能直接诱导TGF-β1产生,并通过诱导ROS激活肌成纤维细胞发挥此作用。Chang等和Cheng等的体外实验表明,内质网应激参与促纤维化因子(CTGF、TGF-β1)的生成,并调节细胞外基质重塑,从而促进卵巢组织发生纤维化。
三、结语与展望
综上,内质网应激与卵巢储备量减少、卵巢内分泌下降及卵巢纤维化密切相关。内质网应激与人体衰老相关疾病紧密相关,细胞的存活与否取决于内质网应激对促生存与促凋亡间的平衡点,而这一平衡点的上游调节机制目前尚不清楚。卵巢中卵泡的生长发育、成熟过程均有大量的蛋白及类固醇激素的合成,早期会激活UPR,恢复内质网内环境稳态;但持续或严重的内质网应激会导致卵巢颗粒细胞的凋亡、卵泡闭锁、激素合成的下降,最终促进DOR的发生。DOR有复杂的病因和发病机制,是多个因素相互作用而导致的,内质网应激作为其中的重要因素之一,其产生影响的分子机制仍需进一步深入研究。近年来,随着我国二孩政策的全面开放,高龄妇女的妊娠问题亟待解决,深入研究内质网应激与卵巢功能的关系,全面探讨DOR的发生机制,为提高DOR患者辅助生育临床结局提供新的治疗思路。
参考文献(略)
 妇产科在线APP下载
妇产科在线APP下载













