
内蒙古农业大学“乳品生物技术与工程”教育部重点实验室
2014.05
植物乳杆菌P-8(Lactobacillus plantarum P-8,L. plantarum P-8)是内蒙古农业大学―乳品生物技术与工程‖教育部重点实验室与北京和美科盛生物技术有限公司共同合作于2005年从内蒙古巴彦淖尔市乌拉特中旗草原上牧民家庭自然发酵酸牛乳样品中分离筛选出的1株性能优良的益生菌。采用体外实验、动物模型和人体试验对Lactobacillus plantarum P-8的益生功能进行了系统评价(图1),并利用基因组学的手段对Lactobacillus plantarum P-8的益生机制进行了深入剖析。经过多年系统的基础研究,自主解决了其产业化的关键技术问题,包括直投式发酵剂、发酵豆乳制品、发酵乳制品、益生菌固体饮料、益生菌片剂和益生菌胶囊等产品,并实现了产业化。相关研究开发报告分类目录如下:
1. Lactobacillus plantarum P-8的分离与筛选
2. Lactobacillus plantarum P-8的益生功能评价
a) Lactobacillus plantarum P-8对高脂血症大鼠脂质代谢的影响
b) Lactobacillus plantarum P-8对机体氧化能力的影响
c) Lactobacillus plantarum P-8对大鼠肠道菌群的影响
d) Lactobacillus plantarum P-8在人体肠道中的定植情况及对肠道菌群、短链脂肪酸、总胆汁酸和分泌性免疫球蛋白A代谢的影响
3. Lactobacillus plantarum P-8基因组学研究
4. Lactobacillus plantarum P-8稳定性研究
5. Lactobacillus plantarum P-8直投式发酵剂的开发及产业化
6. Lactobacillus plantarum P-8在发酵豆乳制品、发酵乳制品中的研究开发及产业化
7. Lactobacillus plantarum P-8在益生菌片剂、益生菌固体饮料及益生菌胶囊等健康食品中的研究开发及产业化
8. Lactobacillus plantarum P-8研究开发获得的奖励
9. Lactobacillus plantarum P-8相关的发明专利和发表的研究论文

图1 Lactobacillus plantarum P-8的益生功能
Lactobacillus plantarum P-8研究开发摘要
1. Lactobacillus plantarum P-8的分离与筛选[1]
Lactobacillus plantarum P-8是2005年分离自内蒙古巴彦淖尔市乌拉特中旗草原上牧民家庭自然发酵酸牛乳样品中的1株具有优良益生特性的植物乳杆菌(图2~图5)。

Lactobacillus plantarum P-8是从内蒙古农业大学乳酸菌菌种资源库(中国第一个最大的原创性乳酸菌菌种资源库,保藏乳酸菌3,388株)中347株植物乳杆菌(分离自内蒙古、新疆、云南和蒙古国的自然发酵乳样品)中优选的1株具有优良益生特性的植物乳杆菌。该菌株在消化系统中具有优异的耐受胃酸、肠液和胆盐能力。
Lactobacillus plantarum P-8在pH2.5的人工胃液中消化3小时后继续在pH8.0的人工肠液中消化12小时,其存活率高达94.87%(图6)。
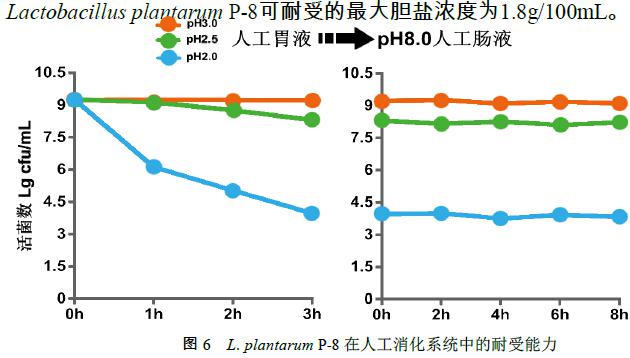
图6 L. plantarum P-8在人工消化系统中的耐受能力
2. Lactobacillus plantarum P-8的益生功能评价
2.1 Lactobacillus plantarum P-8对高脂血症大鼠脂质代谢的影响 [2 , 3]
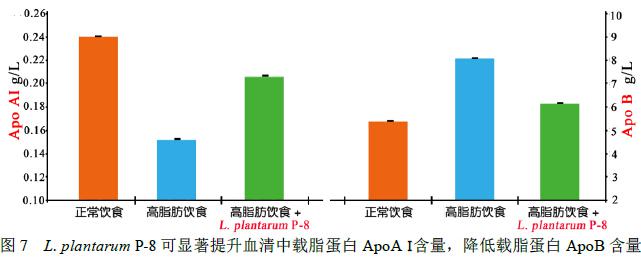
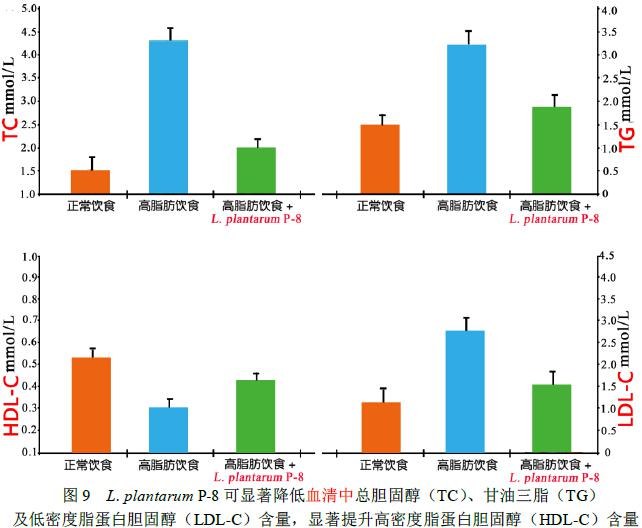
高脂血症大鼠摄食Lactobacillus plantarum P-8 (1.0×109CFU/d) 28 天后,大鼠肝脏和血液中的低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)和总胆固醇(TC)的含量与不食用Lactobacillus plantarum P-8的高脂血症大鼠组相比显著降低(P<0.01< span="">);肝脏和血液中的高密度脂蛋白胆固醇(HDL-C)含量显著增加(P<0.01) (实验数据见图8、图9),同时Lactobacillus plantarum P-8可以调节血液中载脂蛋白(ApoAⅠ和ApoB)的代谢(图7),并可显著增加粪便中总胆汁酸的排出。
这一研究结果表明Lactobacillus plantarum P-8可显著改善高脂血症动物的脂质代谢,具有良好的降血脂作用。

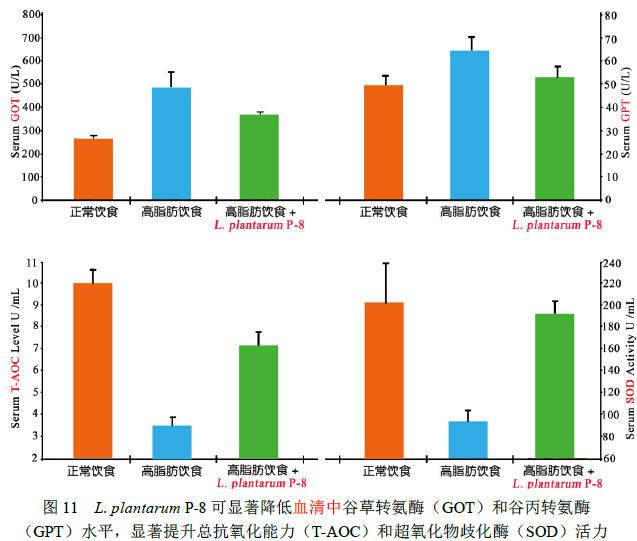
2.2 Lactobacillus plantarum P-8对机体氧化能力的影响[2]
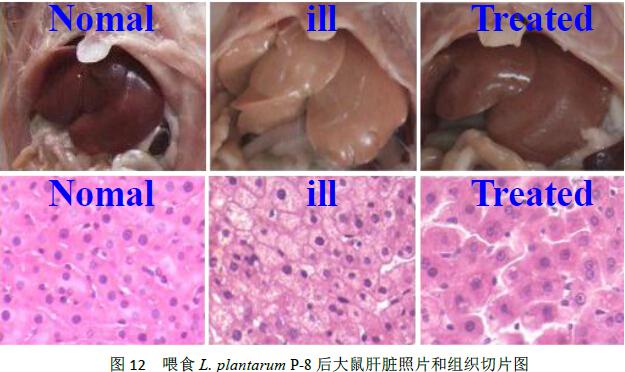
高脂血症大鼠摄食 Lactobacillus plantarum P-8 (1.0×109CFU/d) 28d后,与对照组相比,食用Lactobacillus plantarum P-8可使高血脂动物血清和肝脏中的总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)和谷胱甘肽还原酶(GSH-Px)活力显著升高(p<0.05< span="">),而丙二醛(MDA)含量显著降低(p<0.05< span="">),同时血清谷草转氨酶(GOT)和谷丙转氨酶(GPT)水平显著降低(p<0.05< span="">)。这一结果说明Lactobacillus plantarum P-8可提高机体的抗氧化能力(试验数据见图10、图11和图12)。

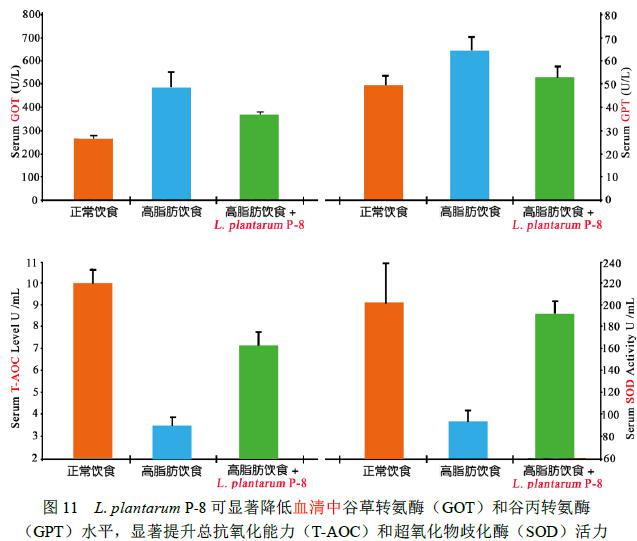
2.3 Lactobacillus plantarum P-8对大鼠肠道菌群的影响[2]
高脂血症大鼠摄食Lactobacillus plantarum P-8 (1.0×109CFU/d) 28d后,与对照组相比,食用Lactobacillus plantarum P-8可显著增加大鼠粪便中乳杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)的含量和拟杆菌属(Bacteroides)数量;显著降低梭状菌属(Clostridium)的数量(p<0.05< span="">)。试验结果表明:Lactobacillus plantarum P-8对改善肠道微生物菌群起到积极作用,实验结果见图13。
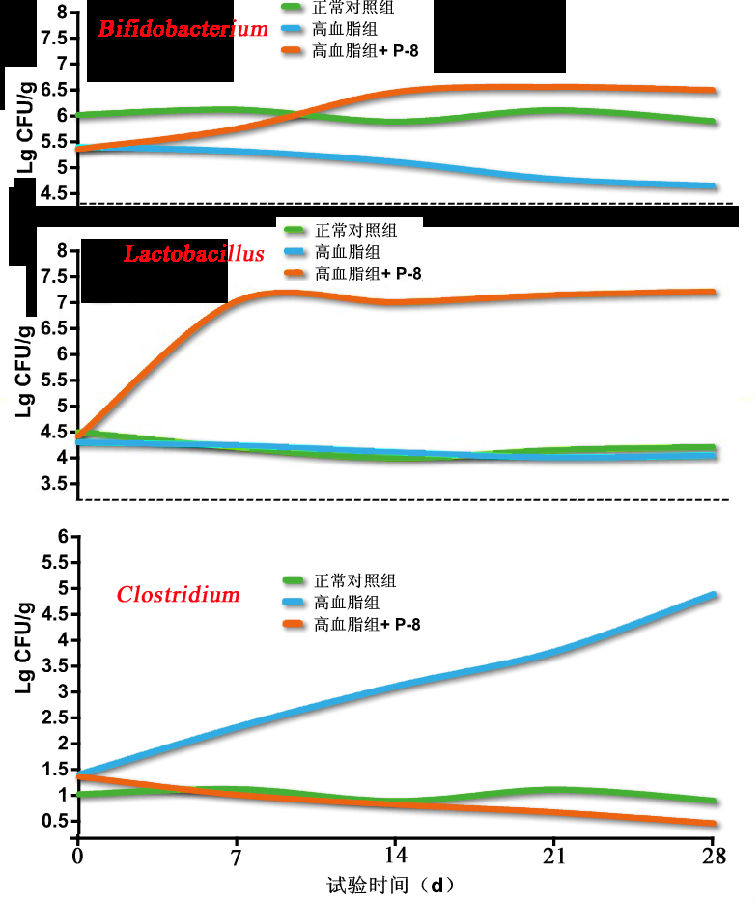
图13 L. plantarum P-8可显著提高肠道中双歧杆菌和乳杆菌的数量,并降低梭状菌的数量
2.4 Lactobacillus plantarum P-8在人体肠道中的定植情况及对肠道菌群、总胆汁酸、短链脂肪酸和分泌性免疫球蛋白A代谢的影响[4]
2.4.1试验设计
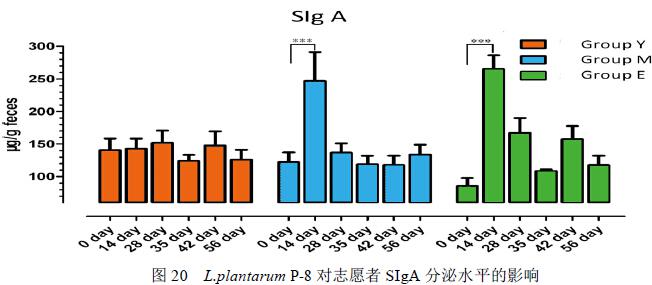
为了评估Lactobacillus plantarum P-8对人肠道菌群及肠道中短链脂肪酸(SCFA)、总胆汁酸(TBA)和分泌性免疫球蛋白A(SIgA)的影响,本研究征集了33名健康志愿者并依据年龄将33人分为老年组(E group 10人,平均年龄75.1岁),中年组(M group 12人,平均年龄50.9岁)和青年组(Y group, 11人,平均年龄26.2岁)三组。在试验期间,志愿者连续28天每天食用Lactobacillus plantarum P-8 8.0× 1010 CFU,并于0天、14天、28天、停止食用后的1周、2周、4周、5周、6周、8周、13周、17周和21周采集志愿者粪便进行相关指标的测定。
株特异性引物荧光定量 PCR ( Strain Specific Primer RT - PCR)、种属特异性引物荧光定量 PCR ( Species Specific Primer RT - PCR)技术和454焦磷酸测序技术综合分析评价该菌株在人体肠道的存活定植以及对人体肠道菌群多样性的影响,Lactobacillus plantarum P-8菌株特异性引物和具体试验设计及见图14。
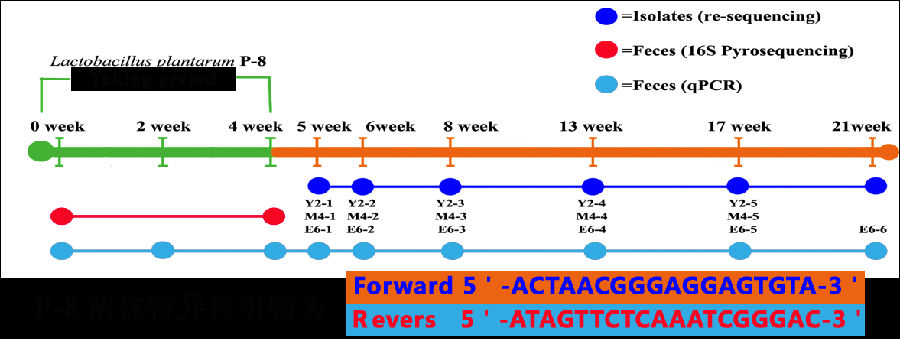
图14L.plantarum P-8菌株特异性引物和人体试验设计流程图
2.4.2 Lactobacillus plantarum P-8在人体肠道中的定植情况及对肠道菌群的影响
食用Lactobacillus plantarum P-8 14 天后,老年志愿者粪便中该菌株含量最高,平均达到8.47±0.17 Lg CFU/g,青年志愿者次之,平均达到8.29±0.13 Lg CFU/g,中年组志愿者粪便中该菌株为7.98±0.17 Lg CFU/g。当食用到第28 天时Lactobacillus plantarum P-8 在各组志愿者粪便中的含量基本相同,平均为8.48±0.19 Lg CFU/g。
当停止食用Lactobacillus plantarum P-8 7天时,志愿者粪便中P-8活菌数量平均水平下降到6.95±0.14 Lg CFU/g;到第14天时,平均水平下降到6.32±0.25 Lg CFU/g,但是此时出现组别差异,老年志愿者粪便中存留的活菌数(6.78±0.11 Lg CFU/g ) > 青年志愿者( 6.43 ± 0.07 Lg CFU/g ) > 中年志愿者( 6.13 ±0.176Lg CFU/g);而当停止食用Lactobacillus plantarum P-8 28 天时,该菌株在各组志愿者粪便中的存留量基本不再发生变化,平均为6.44±0.28 Lg CFU/g;当停止食用Lactobacillus plantarum P-8 4个月后,仍然可以从志愿者粪便中检出该菌株,试验结果见图15。这一结果说明Lactobacillus plantarum P-8在人体肠道具有优异定植能力,至少可以在人体肠道中存活4个月以上。
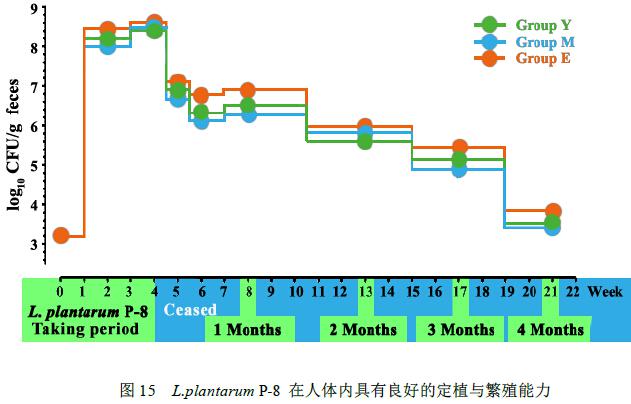
变性梯度凝胶电泳(DGGE )技术分析了不同时期各志愿者肠道内微生物菌群的变化,通过对DGGE图谱的分析发现,对于每位志愿者,在食用Lactobacillus plantarum P-8 的不同阶段,肠道菌群均有显著变化。
6 为青年志愿者Y2,中年志愿者M9 和老年志愿者E6 的在食用Lactobacillus plantarum P-8 0天、14天、28天以及停止食用后35天、42天和56天的肠道菌群的变性梯度凝胶电泳图谱。图中黑色箭头标示的为差异性条带,将这些条带胶回收后克隆测序,分析测序结果发现,对于中年志愿者M9 的差异性条带11(有益菌Bifidobacterium kashiwanohense)和老年志愿者E6 的差异性条带18(有益菌Bifidobacterium pseudocatenulatum),在食用Lactobacillus plantarum P-8后数量有所增加;条带2、3、9、17 所代表的Pseudomonas 菌属(潜在致病菌)的数量在食用Lactobacillus plantarum P-8的过程中呈下降趋势。这些结果说明,Lactobacillus plantarum P-8 可以增加肠道内有益菌的数量,降低致病菌的数量,使肠道菌群健康化。

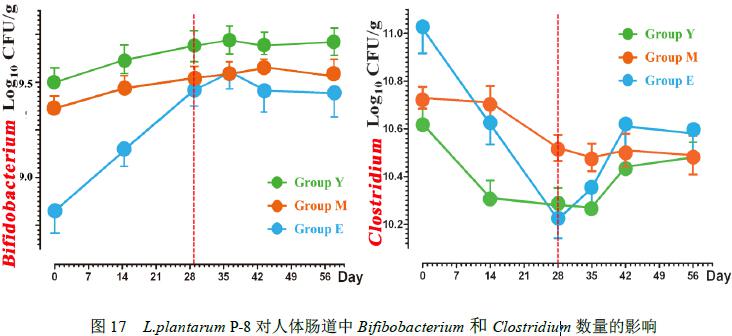
双歧杆菌种属特异性引物对食用Lactobacillus plantarum P-8 的志愿者肠道内的双歧杆菌属(Bifidobacterium,有益菌)和梭状菌属(Clostridium,潜在致病菌)进行定量研究。
结果表明(图17)食用该菌株后志愿者肠道内Bifidobacterium的平均数量显著增加(p< 0.05),Clostridium数量显著降低(p< 0.05);而停止食用该菌株后,Bifidobacterium 的数量并没有回落,依然维持在一个较高的数量级上(9.47±0.26 Lg CFU/g),Clostridium数量在一定程度上有所回升,但仍然低于食用前的水平。说明Lactobacillus plantarum P-8 可以促进肠道内固有的双歧杆菌的生长,同时抑制梭状杆菌的生长。
志愿者肠道内Bifidobacterium 初始数量较低(8.78±0.33),而Clostridium初始数量较高(11.02±0.23 Lg CFU/g),在食用 P-8 后,肠道内Bifidobacterium 数量增加极其显著(p<0.01)< span="">,Clostridium数量降低极其显著(p<0.01)< span="">。即使停止食用该菌株28天后,老年人肠道中Bifidobacterium 数量依旧能达到9.36±0.35 Lg CFU/g,而Clostridium数量也低于使用前水平(10.58±0.11 Lg CFU/g)。说明Lactobacillus plantarum P-8 对改善老年人肠道菌群效果更加明显。
2.4.3 Lactobacillus plantarum P-8对人体胆汁酸代谢的影响
对志愿者粪便中胆汁酸代谢水平测定发现(图18),青年志愿者胆汁酸代谢水平低于中年志愿者, 中年志愿者低于老年志愿者。但是不论对于那个年龄段,在食用益生菌Lactobacillus plantarum P-8后,胆汁酸代谢水平均明显降低。
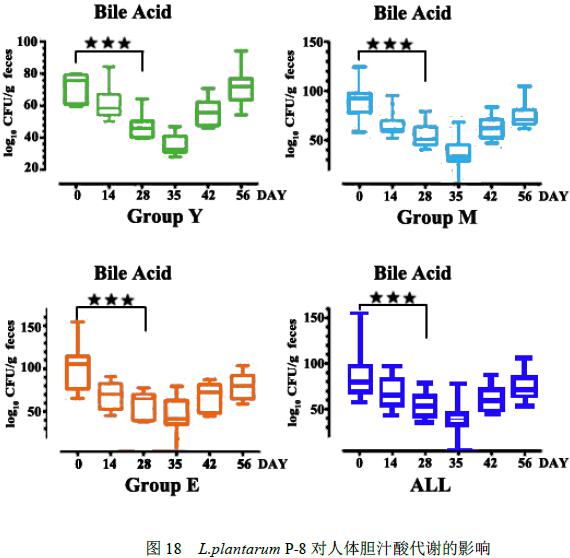
图18 L.plantarum P-8对人体胆汁酸代谢的影响
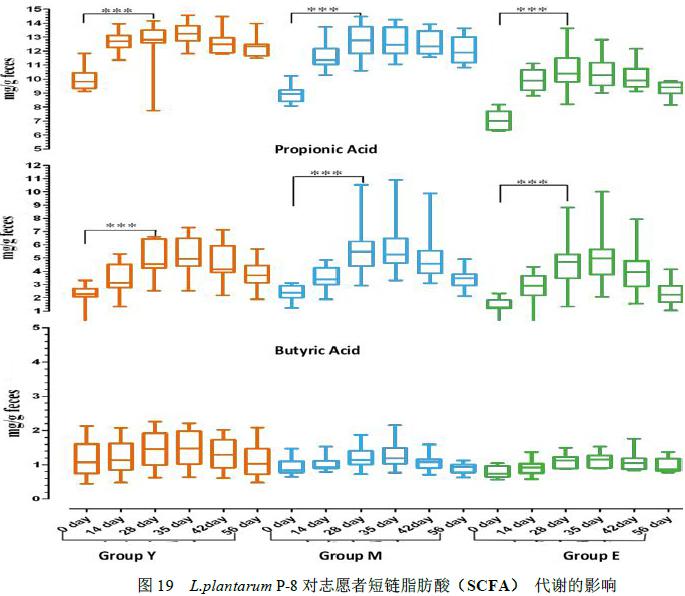
2.4.4 Lactobacillus plantarum P-8对人体肠道中短链脂肪酸(SCFA)代谢的影响
对青年组、中年组和老年组志愿者0天、14天、28天、35天、42天和56天粪便中短链脂肪酸(SCFA)的测定发现,食用Lactobacillus plantarum P-8前,青年组肠道内乙酸含量>中年志愿者>老年志愿者,而三个组别志愿者丙酸和丁酸代谢水平相当。 14 / 22
Lactobacillus plantarum P-8 后,所有志愿者机体肠道内乙酸、丙酸代谢水平均显著增高,且中年志愿者肠道内乙酸含量增幅最大,老年志愿者肠道内丙酸含量增幅最大。而丁酸代谢水平在各个时期的志愿者体内变化均不显著(图19)。
2.4.5 Lactobacillus plantarum P-8对人体肠道内分泌性免疫球蛋白A(SIgA)影响
各个年龄段志愿者肠道内SIgA 的测定发现(图20),在未食用Lactobacillus plantarum P-8 前,志愿者肠道上皮细胞分泌的SIgA含量为:青年志愿者>中年志愿者>老年志愿者。食用 P-8 后,青年志愿者粪便中SIgA 含量变化不显著,而中年志愿者和老年志愿者在食用该菌株14 天后,粪便中SIgA 含量显著增加,但是随着食用该菌株时间的增长,粪便中SIgA 含量并没有继续增加,而是有所回落。
3.Lactobacillus plantarum P-8基因组学研究
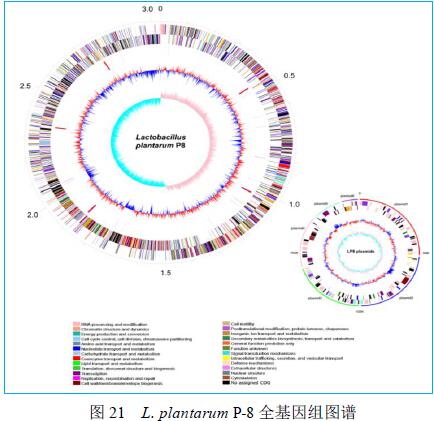
2010年,采用全基因组鸟枪法测定了Lactobacillus plantarum P-8全基因组序列并进行了功能基因组学分析(genbank号:CP005942)。结果表明:Lactobacillus plantarum P-8基因组由1条染色体和6个质粒组成。其中,染色体长度为3,033,693 bp,GC含量为44.80%,共编码3009个开放阅读框;包括5个rRNA基因簇和65个tRNA基因。6个质粒长度为51,183 bp、46,574 bp、39,469 bp、30,687 bp、16,104 bp和8,686bp,分别编码73、54、47、36、26和12个开放阅读框(图21)。
4.Lactobacillus plantarum P-8稳定性研究[8,9]
将生菌Lacobacillus plantarum P-8在普通和碳源限制性MRS培养基中连续传代1000代,结合其在传代过程中细胞形态、活菌数、浊度和菌株活力的变化对该菌表型特征的稳定性进行了综合评价。实验结果表明,连续传1000代后,Lacobacillus plantarum P-8在两种培养基中的细胞形态与原始菌株相比没有发生变化;活菌数与浊度随培养代数的增加均呈波动性变化,但总数基本维持不变;菌株活力在传代过程中呈波动性变化,但差异不显著(P>0.05)。以上研究表明益生菌Lacobacillus plantarum P-8具有良好的稳定性(图22)。

5.Lactobacillus plantarum P-8直投式发酵剂的开发及产业化[10]
根据Lactobacillus plantarum P-8的代谢分子机制和营养需求,对增菌培养基成分和含量进行筛选和优化,确定了Lactobacillus plantarum P-8的高密度发酵工艺,发酵液中活菌数大于 1.0×1010CFU/mL,并且具有良好的益生稳定性(连续传1000代)。
抗冷冻方面的研究中,发现在冷冻干燥过程中,糖类的添加对 Lactobacillus plantarum P-8细胞膜的zeta电位、疏水性、流动性和完整性均有不同程度的影响,在此基础上开发出了适合Lactobacillus plantarum P-8冷冻干燥的抗冻保护剂。
基于上述研究,Lactobacillus plantarum P-8经真空冷冻干燥可得到活菌数3.0×1011 CFU/g以上的高活力发酵剂,可以满足益生菌制剂和各类发酵制品的工业化生产要求。
2010年 6月,Lactobacillus plantarum P-8发酵剂进入了工业化生产,产品中活菌数大于3.0×1011 CFU/g,达到国际同类产品水平(图23-图26)。

6. Lactobacillus plantarum P-8在发酵豆乳制品、发酵牛乳制品中的研究开发及产业化应用[1,11,12]
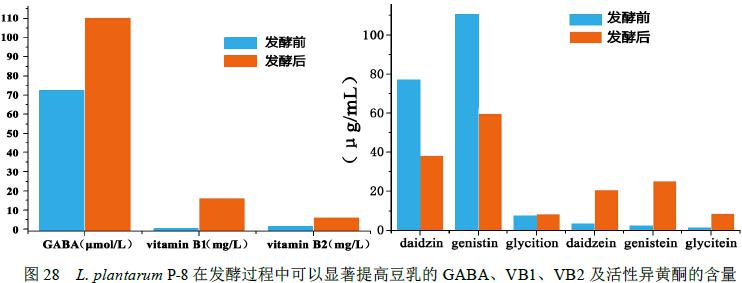
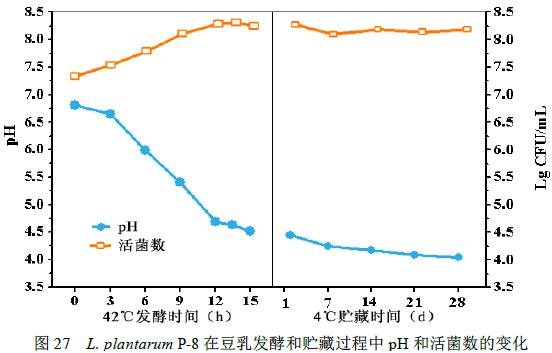
将Lactobacillus plantarum P-8按2.0×107CFU/mL接种量接种于豆乳中,42℃恒温发酵。结果显示:至发酵终点(pH 4.5)时,发酵豆乳中维生素B1和B2的含量较原豆乳显著上升(p<0.05)< span="">,发酵豆乳样品中,维生素B1和B2的含量分别为16.25mg/L和6.30 mg/L;γ-氨基丁酸((GABA)由发酵初始的72.25 umol/L增加至发酵结束时的110.67umol/L;乳酸含量由初始的0.97g/L增加至5.36g/L,而乙酸含量由初始的1.04g/L增加至2.09g/L;豆乳发酵过程中,L. plantarum P-8可以促使无生物活性的异黄酮(黄豆苷、黄豆黄苷、染料木苷)转化为具有生物性活性的异黄酮(黄豆甙元、黄豆黄素、染料木素),数据见图27、28。
将 Lactobacillus plantarum P-8按2.0×106CFU/mL接种量与酸奶基础发酵剂同时接种于牛乳中,37℃恒温发酵,发酵乳具有良好的口感和风味,且后酸化程度低,同时Lactobacillus plantarum P-8可以有效抑制霉菌和酵母菌对发酵乳的后期污染,延长酸奶货架期(图29)。

2011年,Lactobacillus plantarum P-8成功地应用于内蒙古伊利集团和云南欧亚乳业酸奶制品中,相关产品见图30。

7. Lactobacillus plantarum P-8在益生菌片剂、益生菌固体饮料和益生菌胶囊等健康食品中的应用与产业化
根据 Lactobacillus plantarum P-8优良的益生特性和贮藏稳定性,北京和美科盛生物技术有限公司推出了含有Lactobacillus plantarum P-8的复合益生菌片—益生和美(含B. lactis V9、L. casei Zhang和L.plantarum P-8,总活菌数大于3000亿CFU/100g,其中Lactobacillus plantarum P-8含量大于1000亿CFU/100g)(图31)。

北京中研万通科技中心营养食品公司陆续推出了含有Lactobacillus plantarum P-8复合益生菌冻干粉—给力1号(含Lactobacillus plantarum P-8高达1000亿CFU/100g)和复合益生菌胶囊—肠寿(含Lactobacillus plantarum P-8高达1000亿CFU/100g),产品见图32、图33。

北京灵君康美生物科技有限公司陆续推出了含有Lactobacillus plantarum P-8的超级益生菌组合—LA片剂(含Lactobacillus plantarum P-8高达1000亿CFU/100g)和LA固体饮料(含Lactobacillus plantarum P-8高达2500亿CFU/100g),产品见图34、图35。

8. Lactobacillus plantarum P-8研究开发获得的奖励
2009年,―功能性益生乳酸菌高效筛选及应用关键技术‖获国家科技进步二等奖(证书号:2009-J-251-2-10-D04),证书见图36。

图36 L. plantarum P-8的研究开发成果获国家科技进步二等奖
9. Lactobacillus plantarum P-8相关的发明专利和研究论文
进入审核阶段的发明专利7项(截止到2014年05月):
(1) 一株可以促进肠道中SIgA分泌的益生菌及其检测方法;申请号: 201210062296.0;
(2) 一株可以在人体肠道中定植并繁殖的益生菌及其检测方法;申请号:201210062297.5;
(3) 一株植物乳杆菌及其高密度发酵和冻干粉制备的方法;申请号:20121011452.5;
(4) 一株可以调节人体肠道菌群的益生菌及其检测方法;申请号:201210062066.4;
(5) 一种植物乳杆菌在改善酒精性肝损伤中的应用;申请号:201210450985.9
(6) 一株调节人肠道中短链脂肪酸和总胆汁酸代谢的益生菌及检测方法;申请号:201210062159.7;
(7) 一种全燕麦固态混菌发酵生产益生菌活菌粉剂及其制备方法; 申请号:201410123174.7.
发表的研究论文(截止到2014年05月):
1. Yan Bao, Yong Zhang, Haiping Li, Yong Liu, Shuiquan Wang, Ximei Dong, Fang Su, Guoqiang Yao, Tiansong Sun, Heping Zhang. In vitro screen of Lactobacillus plantarum as probiotic bacteria and their fermented characteristics in soymilk. Ann Microbiol, 2012, 62:1311–1320.
2. Yan Bao, Zhanli Wang, Yong Zhang, Jiachao Zhang, Lifeng Wang, Ximei Dong, Fang Su, Guoqiang Yao, Shuiquan Wang, Heping Zhang. Effect of Lactobacillus plantarum P-8 on lipid metabolism in hyperlipidemic rat model. European Journal of Lipid Science and Technology, 2012, 114, 1230–1236.
3. Zhanli Wang, Yan Bao, Yong Zhang, Jiachao Zhang, Guoqiang Yao, Shuiquan Wang, Heping Zhang. Effect of Soymilk Fermented with Lactobacillus plantarum P-8 on Lipid Metabolism and Fecal Microbiota in Experimental Hyperlipidemic Rats, Food Biophysics, 2013,8:43-49.
4. Wang Lifeng, Zhang Jiachao, Guo Zhuang, Kwok L, Ma Chen, Zhang Wenyi, Lv Qiang, Huang Weiqiang, Zhang Heping,The Impact of Oral Consumption of the Probiotic Lactobacillus plantarum P-8 on the Faecal Microbiota,SIgA, SCFAs and TBAs of Subjects of Different Age, Nutrition (2014), doi: 10.1016/j.nut.2013.11.018.
5. 张昕艳, 赵国芬, 包秋华, 张和平. 植物乳杆菌P8亚油酸异构酶基因及其上游非编码区的克隆与分析. 食品科学,2011,32(17):297-302.
6. 慈志敏, 赵国芬, 陈剑, 包秋华, 张和平. 产CLA植物乳杆菌P8的离子束诱变与筛选. 内蒙古农业大学学报(自然科学版). 2011,32(3):207-210.
7. 斯日古楞, 包秋华, 张家超, 张和平, 孙天松. 应用RT-PCR技术定量检测发酵乳中Lactobacillus plantarum活菌数. 食品科技,2011,36(7):270-275.
8. 孔亚楠,张文羿,白梅,乌云,赵亚荣, 张和平.益生菌Lactobacillus plantarum P-8长期连续传代1000代过程中稳定性的研究,中国乳品工业,2013,41(4):15-18.
9. 共轭亚油酸(CLA)负突变植物乳杆菌p8中转录因子rpoD 基因序列的变化研究, 金凤, 赵国芬, 包秋华, 张和平. 农产品加工 (学刊).2013 ,332(10):79-81.
10. 孙鹏, 赵国芬, 李靖波, 崔国卿, 杜美婷, 张和平, 包秋华. 植物乳杆菌P8微囊化的初步研究. 饲料工业,2012,38(7):42-44.
11. 何秋雯, 王水泉, 鲍雅静, 礼贺, 王记成, 张和平, 陈卫. 益生菌Lactobacillus plantarum P8与Streptococcus thermophilus混合发酵对发酵乳品质的影响. 中国乳品工业,2012,40(10):8-10.
12. 益生菌Lactobacillus plantarum P-8在酸乳保鲜中的应用研究, 郭建林, 高鹏飞, 姚国强, 李晶, 赵洁, 王晓伟, 赵小燕, 张和平. 食品科技,2013,38
 妇产科在线APP下载
妇产科在线APP下载










 京公网安备 11010202008857号
京公网安备 11010202008857号