【摘要】目的研究具有潜在益生特性的乳酸杆菌Lactobacillus casei. Zhang( LcZhang) 活菌、灭活菌制剂对小鼠免疫功能的影响,为进一步研究其增强机体免疫活性的机理提供依据。方法采用动物活体试验方法,应用分离自酸马奶,并经过耐酸性实验、人工胃肠消化液中存活能力筛选的LcZhang,制备成热致死菌体和活菌制剂各分成高、中、低三个剂量组灌服小鼠15d,测定胸腺指数、脾脏指数;观察ConA促进脾淋巴细胞增殖作用、脾脏巨噬细胞吞噬中性红的能力。结果与对照组相比,实验各组的胸腺指数无明显变化。活菌制剂组脾脏指数、脾淋巴细胞增殖能力、脾巨噬细胞吞噬中性红的能力有所提高且差异显著(P<0.05);并且在本试验选取的3个剂量范围内基本呈量效关系。灭活菌制剂对以上指标的影响与对照相比无显著差异。结论 LcZhang活菌制剂的免疫调节作用优于热致死菌体制剂。活菌制剂对小鼠的非特异性免疫功能及细胞免疫功能产生了多方面的、有利于机体免疫功能状态的调节作用。
【关键词】LcZhang 昆明小鼠免疫功能
【中图分类号】R 3 6
【文献标识码】A
【文章编号】1674-0742(2008)04(b)-0039-04
高等动物在长期的进化过程中,产生了复杂而逐步完善的免疫系统。由免疫器官、免疫细胞和免疫分子组成的免疫网络系统,产生较为精密而协调的免疫应答,以保证机体免疫环境的相对稳定。当免疫功能失衡时,免疫功能紊乱从而导致疾病的发生,而应用不同的免疫调节剂治疗是临床实践中不可缺少的手段之一。作为一个机体,维持正常的免疫功能,也是正常生长、生活、抵御外界不良环境的重要前提和保证。迄今为止,国内外学者已发现多种免疫增强剂对免疫功能正常的动物具有提高免疫水平的作用,包括增强吞噬细胞的功能,提高它们的杀菌能力,刺激补体、溶酶体和抗体反应,进而提高动物对细菌性病原体的抵抗力[1]。
将双歧杆菌和乳酸菌作为生物反应调节剂经口服或经非胃肠道途径给予宿主,可激活机体免疫系统中的淋巴细胞、巨噬细胞及NK细胞等多种免疫效应细胞,使之分泌 IL-2、IL-12、IFN- γ等多种细胞因子,从而提高机体局部或全身的防御功能,发挥自稳调节、抗感染、抗肿瘤等效应[2]。
本文应用从内蒙古传统酸马奶中分离,并通过耐受性试验和人工消化液耐受性分析筛选的1株乳酸杆菌Lactobacillus casei.Zhang (LcZhang),经热致死和活菌制剂灌服小鼠,观察了对免疫脏器指数、脾淋巴细胞转化增殖能力、脾巨噬细胞吞噬能力的影响,探讨来源于传统乳制品中的乳酸杆菌的免疫调节作用,为传统乳制品乳酸菌资源的开发利用提供实验依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂 TPY培养液;淋巴细胞分离液(上海试剂二厂产品);RPMI1640干粉(美国Gibco公司)规格,1L/袋;胎牛血清(兰州民海生物公司);噻唑蓝(Amresco公司);刀豆蛋白A(Sigma公司)规格 25mg/ 支;DMSO(国产分析纯,购于成都化学试剂厂);0.83%NH4CI;0.2%台盼兰;0.072中性红;Hank’s液;其他试剂均为分析纯。
1.1.2 LcZhang的来源及制剂制备本研究选取的 LcZhang为内蒙古农业大学乳品生物技术与工程教育部重点实验室分离自内蒙古传统发酵酸马奶中的一株乳酸杆菌[3],种属归类已通过16SrDNA同源性分析,与标准菌株 GeneBank中 Lb.casei ATCC 334的同源性为100%[4]。该菌株具有良好的耐酸性、人工消化液耐受性及胆盐耐受性[5]。
将冷冻干燥保存的 LcZhang接种于TPY培养液,37℃培养18h, 3000g、10min离心收集菌体,用灭菌0.01M、pH7.4的PBS离心洗涤后分散于0.01M、pH7.4的PBS中并调整其菌数为1.0×109cfu/mL (光密度检测结合BCP琼脂培养基培养计活菌数确认),按用量分装,液氮速冻后-80℃保存备用,此为活菌制剂。另取上述一部分菌悬液煮沸40min后室温冷却分装后-80℃保存备用,此为灭活菌制剂。
1.1.3 实验动物清洁级昆明小鼠72只,雌雄各半,购自内蒙古大学实验动物研究中心。实验动物适应性饲养(2~3)d待体重均达 (20±2)g后将小鼠随机分组(表1)。
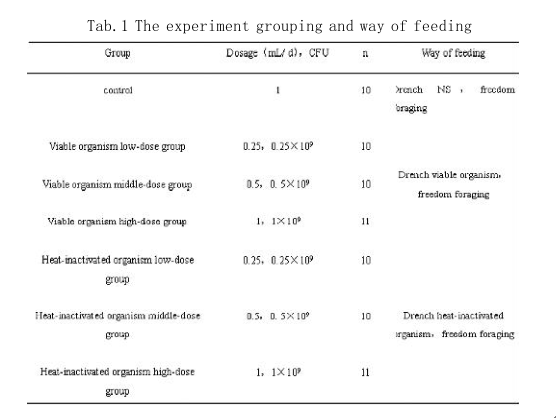
1.2 方法
1.2.1小鼠免疫脏器指数(Immuneorgan index,IOI)的测定小鼠连续灌服15d后断颈处死,75%乙醇浸泡(3~5)min,于超净工作台内无菌取出胸腺和脾脏, 将周围组织剥离干净,用滤纸吸净组织表面血液后称重,按下式计算免疫脏器指数:IOI=胸腺或脾脏重量(mg)/体重(g)[6]。
1.2.2 LcZhang对小鼠脾淋巴细胞转化代谢水平的影响(MTT法) 小鼠脾细胞悬液制备: 将上步实验无菌取出之脾脏置盛有Hank’s液的平皿中,于灭菌钢筛(200目)上剪碎,用针芯轻轻研磨,过滤,吹打分散成脾细胞悬液,1000g离心10min,弃上清后加入适量0.83% NH4CI红细胞裂解液溶解 RBC,吹打均匀,作用(2~5)min,用不含FBS的RPMI1640洗2次,将悬液轻轻加于淋巴细胞分离液的上层,2000g水平离心(15~20)min,吸取白色淋巴细胞层于一无菌离心管中,用 Hank’s液洗3遍,0.2%台盼兰染色,计数活细胞>95%,用含10%胎牛血清的RPMI1640液调至细胞浓度为 1 × 107个 /mL。淋巴细胞增殖反应:在96孔培养液板上加200μL/孔脾细胞悬液,加 ConA10μ L/ 孔(浓度为 5mg/mL),每个样品 3 个复孔。37℃,5%CO2孵箱培养48h,每孔弃去100μ L,加入10 μL/ 孔MTT(浓度为5mg/ml),再培育 4h,取出后再加入 10 μ L/ 孔 DMSO,混均置室温20min,待细胞完全溶解,显色后,置酶标仪492nm波长读取OD 值。
1.2.3 LcZhang对小鼠脾脏巨噬细胞吞噬功能的影响按与上面实验同样条件与方法处理96孔培养板。在37℃,5%CO2孵箱培养2h,弃去上清和未贴壁细胞用37℃预温的PBS洗涤2次,洗去未贴壁细胞,即得巨噬细胞。加 200 μ L/ 孔 RPMI1640完全营养液,培养4h,弃去培养液,加0.072%中性红液100μL/孔,作用30min弃去中性红,用 PBS 液洗 2 次,每孔加入细胞溶解液(V冰醋酸∶V乙醇=1∶1)100μL,放置4℃冰箱过夜,细胞完全溶解后,在酶标仪上测定570nm处 O D 值。
1.3 统计学处理
采用 SPSS for Windows 10.0统计软件。计量数据以均数±标准差表示,组间比较进行Independent-Samples T Test分析,P<0.05差别有统计学意义。
2 结果
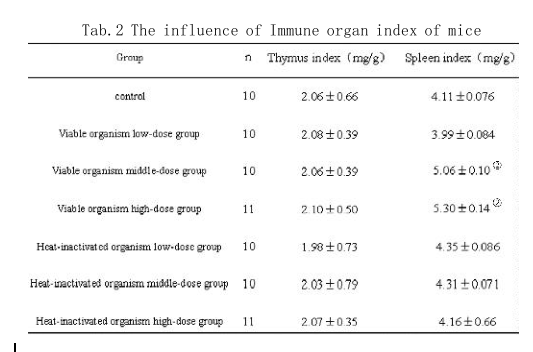
2.1 小鼠一般状况、胸腺、脾指数测定结果实验期间,各组小鼠一般状况良好,无纳差腹泻等不良表现,未发现小鼠有中毒症状或自然死亡。说明LcZhang活菌菌液及灭活菌制剂对健康小鼠均无毒性。LcZhang不同剂量组对小鼠免疫脏器指数的影响结果(见表2)。与对照组相比较,活菌高、中剂量组增加了小鼠脾脏指数(P<0.05),而对于小鼠胸腺指数无显著影响,低剂量组和灭活菌组的脾脏指数和胸腺指数与对照组无显著差异。
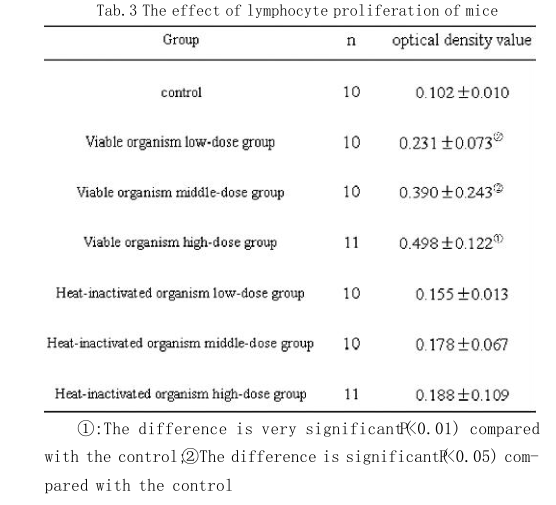
2.2 淋巴细胞转化实验LcZhang不同剂量组与对照组比较,观察ConA促进脾淋巴细胞增殖作用,结果(见表3)显示,活菌组与对照组相比,光密度值均有所增高且差异显著(P<0.05)。灭活菌组与对照组相比,光密度值无明显差异。
2.3 小鼠脾脏巨噬细胞吞噬中性红能力
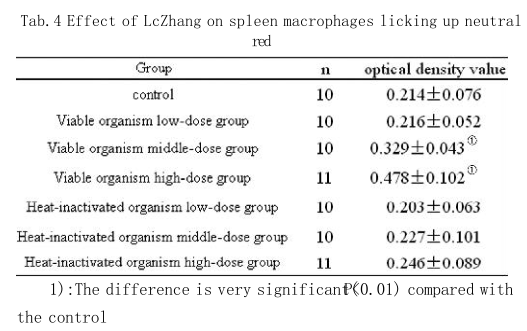
从表4可以看出, LcZhang对小鼠脾脏巨噬细胞吞噬中性红能力的影响情况。LcZhang活菌高、中剂量组与对照组相比较,光密度值都明显的升高了,且差异水平为极显著(P<0.01)。LcZhang活菌低剂量组和灭活菌各剂量组光密度值与对照组相比较差异水平无显著性。吞噬中性红能力与LcZhang活菌剂量成一定依赖关系。
3 讨论
近年来,随着微生态学研究的不断发展,越来越多的实验证明有益细菌对人体健康的重要作用。在人的肠道中生存着100种以上的细菌,形成了肠道内菌丛,这些细菌以某种方式与营养吸收、物质代谢、感染性疾病、肠道免疫、炎症等相关。因此,为改善肠道内微生物的平衡,可对宿主投予有益的活菌制剂,达到防病保健的目的。乳酸菌作为一类食品级的对人体健康有益的菌群,其提高机体免疫功能等重要作用巳得到较为充分的肯定[7~9]。有研究资料表明,关于乳酸菌的防癌、抗肿瘤、抗变异原及免疫增强作用的研究,已引起食品科学、微生物学、预防医学和微生态学等许多学科的广泛重视。肠道微生物在人体中所起的作用有好的一面,也有坏的一面,而由乳酸菌移位所引起的炎症不到其它菌的1%[10]。我国是最早利用乳酸菌发酵食品的国家之一[11],有着丰富的传统发酵食品资源。日本小崎博士[12]1991年指出,在中国及东南亚的传统发酵食品中,蕴藏着大量未知微生物,是探索有用微生物菌株的绝好宝库。Ohara博士[13]1992年也强调,应大力研究该地区发酵食品中的微生物相,探索有益菌株。
乳酸菌作为一种生物反应调节剂刺激免疫系统是多角度多水平的,它可以对免疫器官、组织、免疫活性细胞、细胞因子及有关基因等各个层次进行微妙而精细的调节。乳酸杆菌也是应用最早、研究最多的益生菌之一[14~16]。
本文应用分离自内蒙古传统发酵酸马乳中的一株具有潜在益生特性的乳酸杆菌LcZhang,观察其活菌制剂及灭活菌制剂对于小鼠脾、胸腺指数,脾脏淋巴细胞转化增殖反应,脾脏巨噬细胞吞噬作用等的影响,综合判定其对小鼠免疫功能的影响。
(1) 免疫器官的脏器系数是衡量机体免疫功能的初步指标。脾脏与胸腺是体内主要的免疫器官,脾脏及胸腺的重量及其功能对巨噬细胞的吞噬功能、细胞免疫和体液免疫等免疫功能具有重要的影响。一般来讲,免疫力低下的动物个体其免疫器官的重量往往会低于健康个体[17~18]。免疫抑制剂可使胸腺、脾脏萎缩;免疫增强剂可使胸腺、脾脏增重。因此,胸腺和脾脏可作为观察药物对免疫影响的指标之一[19]。胸腺和脾脏指数能反应免疫器官的发育和免疫细胞的功能状况,间接反映了机体的免疫水平[20],从表2可知,活菌高、中剂量组的脾脏指数明显地升高了(P<0.05),而活菌低剂量组和灭活菌组的胸腺指数和脾脏指数没有明显变化。
胸腺是T细胞,尤其是αβ+T细胞发育的场所。淋巴干细胞迁入胸腺,进行分化,分化为αβ+及γδ+T细胞。在胸腺内,约95%以上的胸腺细胞死亡,只有不足 5%的细胞存活,分化成熟为Th 及CTL细胞,输出胸腺,定位至外周淋巴器官及组织。
脾是体内最大的外周淋巴器官。血液中的病原体及异物经血液循环带至脾,被巨噬细胞过滤清除;或降解为抗原分子后,活化T及B细胞,进行特异免疫应答。脾中T细胞约占35%,B细胞约占55%,约10%为巨噬细胞。当被血流来源的抗原刺激后,T及B细胞经克隆扩增,数目明显增加,致T及B细胞区体积扩大,脾脏体积重量亦相应增加。
本实验结果说明,LcZhang对于淋巴细胞的分化成熟没有明显的影响,其作用靶点主要在于免疫应答的过程中。LcZhang活菌中、高剂量组明显增加小鼠脾脏指数,因此具有提高小鼠机体免疫机能和细胞免疫、体液免疫水平的功效。
(2) 淋巴细胞转化试验是检测T细胞免疫功能的方法,淋巴细胞转化率可直接反映细胞免疫功能状态。脾脏是机体内最大的外周免疫器官,也是T、B淋巴细胞定居和接受抗原刺激产生免疫应答的重要场所。T、B 淋巴细胞是机体的免疫活性细胞,其激活、分化、增殖在免疫应答过程中起着重要的作用,ConA为非特异性T细胞有丝分裂原,能与细胞膜上的受体结合而诱导T细胞活化,导致细胞因子合成,细胞因子受体表达及最终活化细胞的增殖[21]。本实验证实了LcZhang活菌制剂能明显促进小鼠脾淋巴细胞对CoA的应答,对小鼠脾淋巴细胞有明显的促增殖作用,且促进作用与浓度呈正相关,显示了较强的免疫促进作用。提示LcZhang活菌制剂对T淋巴细胞介导的免疫应答有增强作用。
(3) 非特异性免疫是机体免疫系统的重要组成部分,单核巨噬细胞的吞噬能力是衡量机体非特异性免疫功能的标志之一。作为非特异性的免疫功能之一,吞噬细胞是免疫系统维持自身内环境稳定的重要手段,也是机体产生免疫应答的基础,大多数抗原经巨噬细胞处理成超抗原后,免疫原性大大增加。因此,吞噬是非特异性免疫的关键环节。巨噬细胞是动物体重要的免疫调节和效应细胞,在机体众多的生理和病理反应过程中发挥着重要的作用。巨噬细胞识别、吞噬和消除病原微生物及机体衰老的细胞,分泌特定的细胞因子参与机体的炎症反应,通过加工处理提呈抗原,启动特异性免疫应答,抗肿瘤作用。特别是巨噬细胞在清除侵人机体的病原微生物方面,发现感染或携带细菌、病毒、寄生虫等致病病原体后,巨噬细胞通过启动细胞凋亡清除这些病原体[22]。
从本试验可以看出LcZhang活菌制剂对小鼠脾脏巨噬细胞的吞噬能力有显著的促进作用,说明LcZhang活菌制剂具有较强的活化巨噬细胞的作用,能促进小鼠非特异性免疫功能。
4 结语
在免疫活性细胞调节方面,前期实验结果表明,饲喂LcZhang主要维持或增加了小鼠外周血中的CD3+(总的活化淋巴细胞)和CD4+(辅助/炎症 T 细胞)细胞数目,优化了 CD4+/CD8+比值,提高小鼠的细胞免疫功能。同时LcZhang可以显著增加小鼠血清IgG含量和小鼠肠粘膜SIgA含量,对体液免疫和肠黏膜局部免疫也有一定的促进作用[23]。本实验以LcZhang活菌及灭活菌制剂为研究对象,观察了其对正常小鼠诸免疫功能指标的影响。结果表明,LcZhang活菌制剂对正常小鼠非特异性免疫功能和细胞免疫功能起到了重要而复杂的调节作用,对小鼠的免疫功能产生了多方面的、有利于保持和恢复机体免疫功能状态的有益调节作用。其重要特点可能是使细胞免疫类别的Th1细胞占据优势,据此调节整个机体的免疫功能状态。从而有助于维持整体免疫系统的平衡。同时也说明,乳酸杆菌LcZhang免疫调节能力存在于其活细胞,热处理过的细胞将会丧失这种能力。这与Majamaa等人[24]的研究发现乳酸菌的免疫调节功能只有活的乳酸菌才有,热灭活的相同的乳酸菌则无此效果的结果相同。为今后开发和利用传统发酵乳制品中的有益菌株提供了实验依据,也为今后的产品开发和利用奠定了理论基础。
参考文献
[1] Sakai M. Current research status of fish immunostimulants [J].Aquaculture, 1999,172:63~92.
[2] 康白.双歧杆菌[M].大连:大连海事大学出版社,1998:1~2. [3] 孟和毕力格,乌日娜,王立平,等.不同地区酸马奶中乳杆菌的分离及其生物学特性的研究[J].中国乳品工业,2004,32(11):6~11.
[4] 乌日娜,张和平,孟和毕力格.酸马奶中乳杆菌Lb.casei.Zhang和ZL12-1的16S rDNA基因序列及聚类分析[J].中国乳品工业, 2005,33(6):4~9.
[5] 张和平,孟和毕力格,王俊国,等.分离自内蒙古传统发酵酸马奶 (Koumiss)中L.casei Zhang潜在益生特性的研究[J].中国乳品工业,2005,34(4):6~11.
[6] Simpson MA, Gozzo J J. Spectrophotometric determination oflymphocyte mediated sheep red blood cell hemolysis in vitro[J].JImmunolMethods,1978,21:159.
[7] 顾瑞霞,伊明.乳酸菌抗肿瘤特性的研究进展[J].中国微生态杂志, 1999,11(4):253.
[8] 程波财,魏华.乳酸菌与肠粘膜免疫[J].中国微生态杂志,2001,13(5):302.
[9] 张洪泉,顾瑞霞,许爱华,等.五株活菌型乳酸对荷瘤小鼠的免疫调节作用[J].药物生物技术,1996,3(2):101.
[10]清水精一.乳酸菌肠内フロフと健康はツ酵乳"マサイの战士"の开发と有效性にフ~て[J].食品工业,2002(2):40.
[11]骆承痒.乳与乳制品工艺学[M].北京:农业出版社,1992,236
[12]小崎道雄.日本食品工业学会志[J].1991,38:651
[13]Ohara I.Jpn[J].Dairy and Food science,1992,41(2),A~87
[14]何明清.动物微生态学[M].北京:中国农业出版社,1994.
[15]杨景云.医用微生态学[M].北京:中国医药科技出版社,1997.
[16]Leer R J.Genetic analysis of a ciocin B,anovel bacterioncinproducedby Lactobacillus acidophilus[J].Microbiology,1995,141:1629~1635.
[17] 郑健仙.功能性食品[M].第3卷.北京:中国轻工业出版社,1999.
[18] 周俭.保健食品设计原理及其应用[M].北京:中国轻工业出版社,1998.
[19] 陈奇.中药药理研究方法学[C].北京:人民卫生出版社,1993:172~173.
[20] 赖新峰,王立生,潘令嘉,等.双歧杆菌对裸鼠腹腔巨噬细胞激活作用的初步研究[J].中国微生态学杂志,1999,1(6):336~337.
[21] 汪谦.现代医学实验方法[M].北京:人民卫生出版社,1997:690~691.
[22] GIL D,GARCIA L F,ROJAS M.Modulation of macroph-age apoptosis byantimy-cobacterial theraphy:physiological role of apoptosis in the control ofMyco-bacterium tuberculosis [J].Infect Immun,2004,65(2):1886.
[23] 张和平,张七斤,孟和毕力格,等.L.casei.Zhang对小鼠T 淋巴细胞亚群及血清IgG 和肠黏膜SIgA的影响[J].中国乳品工业,2006,34(10):4~8.
[24] Majamaa.H, Isolauri.E, Saxelin.M, Vesikari.T. Lactic acid bacteriain the treatment of acuterotavirus gastroenteritis.J.Pediatr.Gastroenterol[J].Nutr.1995,20:333~338.
 妇产科在线APP下载
妇产科在线APP下载










 京公网安备 11010202008857号
京公网安备 11010202008857号