双歧杆菌是自然栖居在人体肠道中的有益菌株, 在成人肠道中约占到肠道总菌数的 3% ~ 10% ,而在婴儿肠道中这一比例超过 91% [ 1], 双歧杆菌在肠道内的数量是评价机体健康程度的重要指标[ 2],其主要作用在于可抑制有害菌群、维持肠道菌群平衡、保护肠粘膜屏障、代谢产生有机酸、促进肠道蠕动、腹泻便秘双重调节[3]。作为益生产品要求菌株必须在通过胃肠道后仍然能有足够数量的活菌存在( 约 106~107CFU/g) , 这也为评价潜在益生特性的菌株提供了标尺[ 1]。
本文从健康蒙古族儿童粪便中分离得到 11 株双岐杆菌, 经生理生化试验鉴定并以耐受人工胃肠液和胆汁盐情况为评价指标来评价其益生特性, 其中 B. animalisV9 各项益生特性较为突出, 进一步通过分子生物学手段 16S rDNA 对 B. animalis V9进行鉴定, 发现该菌株与 Bifidobacterium animalissubsp.Lactic BB12的同源性为 99% , 有望在乳制品
及微生态类产品中得到广泛应用。
1材料和方法
1.1材料
1. 1. 1样品来源:12 名健康蒙古族儿童, 男性 7 名、女性 5 名, 年龄为 3~ 6岁, 均无胃肠病史, 采样前两周内未服用过任何抗菌类药物。
1. 1. 2主要试剂和仪器:胃蛋白酶( pepsin,sigma) ;胰蛋白酶( Trypsin,sigma) ; 牛胆盐( 北京双旋微生物培养基制品厂) ; 厌氧罐( BBL Gas park) ; OLYMPUSBX50 型光学显微镜及 OLYMPUS PM-20 型摄像系统; HITACHI U-2000 型紫外可见分光光度计;
Eppendorf TGL-168 高速台式离心机; PTC-200 梯度PCR 扩增仪;ABI 3730测序仪。
1.2样品的采集与保存
用无菌玻璃棒挑取自然排出的新鲜粪便 5~10 g, 置入无菌平皿中, 迅速放入厌氧罐中, 带回实验室进行分离。
1.3稀释液 PBS 和双岐杆菌选择性培养基的配制
稀释液PBS: 磷酸氢二钠6 g, 磷酸二氢钾4.5 g,吐温- 80 0.5 g, L-cys-HCl 0.5 g, 蒸馏水1000 mL, pH自然, 121。C 15 min 灭菌备用。
选择性 TPY 培养基: TPY 培养基+ 2g/L LiCl+1.5% 琼脂粉
1.4供试菌液的配制
将各菌株用 TPY 传代培养 2 次, 选取生长至稳定期的菌体离心( 3000 × g, 7 min, 4e ) 收集, 用 1.3所述 PBS 洗涤 2 次[ 4- 5], 重新悬浮于 10 mL PBS 中,然后用灭菌 PBS 梯度稀释至一定倍数, 采用TPY 琼脂培养基平板倾注法( 下同) , 37°C培养 48 h 后计菌落总数, 同时测定相应稀释度菌体在 600 nm 处OD值, 制作OD值与所对应的近似菌落数( CFU/mL) 的线性关系曲线。
根据上述各稀释度 OD 值与所对应的近似菌落数( CFU/mL) 的线性关系[ 6], 通过调整各菌体在600 nm处的 OD 值, 使各供试菌体最终浓度为 5× 108 CFUPmL[ 7]。
1.5人工胃肠液和含胆盐培养基的配制
具体方法参照Charteris、Usman 等提供的方法[ 8- 9]。
1.6菌株的分离纯化与保存[10- 12]
取厌氧冻存的样品 3g 加入有玻璃珠的三角瓶中, 加入 30 mL PBS 稀释液摇床振荡( 250 r/min)15 min, 然后吸取 1 mL 便液加入一支装有 9 mL PBS稀释液的试管中, 漩涡混匀, 作为 10- 2稀释液, 同样方法稀释至10-4。
取在厌氧罐中充分预厌氧的TPY 固体平板, 将粪便原液、10- 2稀释液、10- 3稀释液、10- 4稀释液各取0.1 mL, 均匀涂布平板, 置厌氧罐中 37°C厌氧培养24h( 先抽真空至- 0.05MPa,然后充氮气至 0.02MPa,重复2次, 最后通入 0.02 MPa 的混合气体(N280%, H210%, CO210%) ) 。
在选择性TPY 培养基上, 双歧杆菌的菌落特征较为典型, 易与其它菌落区分开来。双歧杆菌的菌落一般为光滑, 凸圆, 边缘完整, 颜色呈乳褐色或乳白色, 菌落直径在0.6 mm~1.8 mm 之间, 具有这些形态特征的菌落被认为是双歧杆菌可疑菌落, 通过进一步分离纯化得到双岐杆菌纯菌株。
将双歧杆菌纯菌株扩培后用 PBS 离心洗涤2 遍后, 悬于保护剂( 12% 脱脂乳+ 0.1% 谷氨酸钠) 中,真空冷冻干燥- 18°C保存。
1.7生理生化鉴定
具体方法参照文献[15]。
1.8耐受人工胃肠液和胆盐试验[9]
取 1.0 mL 各供试菌液加入到 9.0 mL 人工胃液(pH 2.0、2.5、3.0) 中, 37°C厌氧消化3 h 后分别取样, 用平板计数法测定活菌数并计算存活率。同时,吸取1.0mL消化3h后的 pH2.0的人工含菌胃液,加入到 9.0 mL 人工胰液中, 继续于37°C厌氧培养,分别于0、2、4、8 h 取样用 TPY平板计数法测定活菌数并计算存活率。
以 1% 接种量将各供试菌液接种至含胆盐( 0.2%、0.3%、0.5%、0.8%、1.0% , W/V) 和不含胆盐的TPY 液体中, 37°C厌氧培养, 不定时取样测定吸光值 OD620,直到吸光值增加至0.3 个单位停止培养, 计录各菌株在含胆盐和不含胆盐的TPY 培养基中生长时OD值增加 0.3 个单位所需的时间, 以含胆盐组与不含胆盐组OD值增加 0.3 个单位所需的时间之差(LT 延迟时间) 来判断菌株对胆盐的耐受性。
1.9菌株存活率计算
菌株存活率( %)=logcfuN1/logcfuN0x 100%。
N1一菌株处理后活菌数;N0菌株初始活菌数。
1.10分子生物学 16S rDNA鉴定方法
用冻融-CTAB 法提取菌株基因组 DNA[ 13]。16SrDNA 扩增引物采用通用引物 [13], 即 27F ( 5,-AGAGTTTGATCCTGGCTCAG-3,)和1541R( 5,-AAGGAGGTGATCCAGCC-3,) 。扩增产物经 ABI 3730测序仪测序, 并用 MEGA 4.0 软件构建该菌株的系统发育树。
1.11数据统计分析
试验数据采用 SAS 8.02ANOVA程序处理。
2
结果
2.1分离至蒙古族儿童粪便中的双歧杆菌的鉴定
结果
由12 名健康蒙古族儿童粪便中分离得到 11株双歧杆菌, 对其进行生理生化试验和糖发酵试验。对照菌株为:Lactobacillus dellbrueckii subsp. Bulgaricus ATCC 112278 ( 同表 1 中的 BZ1) 、Lactobacillus.acidophilusATCC4356( 同表 1 中的 BZ2) , 由内蒙古农业大学乳品生物技术与工程教育部重点实验室提供, 实验结果如表 1 所示。
根据表 1 试验结果, 参照文献[ 15] , 得到5株B.adolescentis:A1、H3、G4、A8、V10; 3 株 B. longum:C6、C7、D11; 1 株 B. pseudocatenlatum: B2; , 1 株 B.bifidum: G5; 1 株B.animalis: V9。 BZ1 为Lactobacillusdellbrueckii subsp. bulgaricus,BZ2 为Lactobacillus. Acidophilus。
2.2 11 株双歧杆菌的生长特性比较
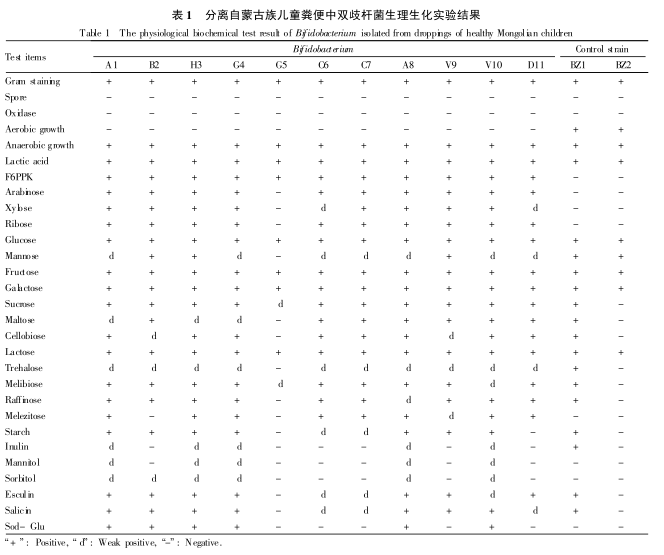
如图 1所示, 各菌株在TPY 液体培养基中生长曲线变化基本相同, 但菌体达到的最大 OD 值有明显的差异。16 h 前为对数生长期, 16 h 后开始进入生长稳定期, 一直持续至24 h。B. adolescentis A1在稳定期时的 OD 值最小( 1136) , 而 B. adolescentis H3在稳定期达到的 OD 值最大( 2112) , 其它各菌株在稳定期 OD 值差异不大。
以下实验以此生长曲线为依据, 将各菌株在TPY 液体培养基中厌氧培养 18h 的菌体做为供试菌, 根据 OD 值与所对应的近似菌落数( CFU/mL) 的线性关系( 略) , 通过调整各菌体在 600 nm 处的 OD值, 使各供试菌体以5x 108CFU/mL的接种量接入人工胃液中。
2.3 11株双歧杆菌的人工胃液耐受性筛选试验结果
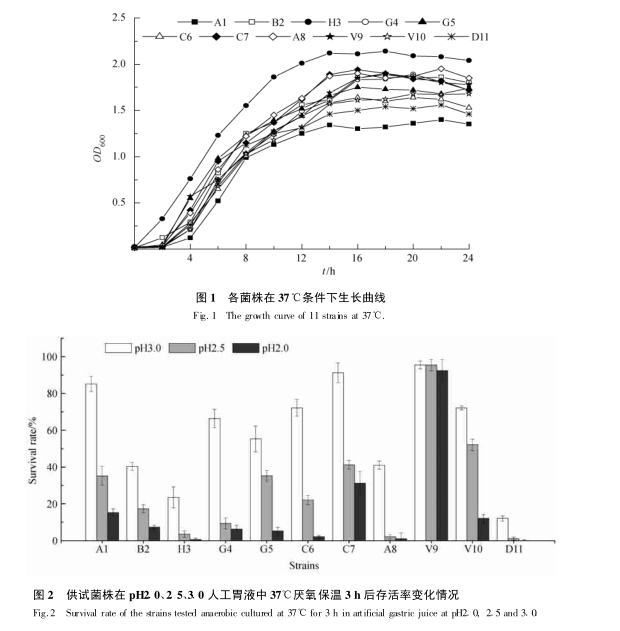
将供试菌株接入 pH2.0、2.5、3.0 人工胃液中, 37e 厌氧培养 3 h 对其进行活菌计数, 并计算存活率, 结果见图 2。
由图 2可以看出, 不同菌株在不同 pH 的人工胃液中耐受性有显著差异( p< 0.01) 。菌株对人工胃液耐受性随 pH 降低而降低, 其中 B. animalis V9对人工胃液耐受性最强, 在 pH2.0 人工胃液中 37°C厌氧保温3h后存活率达到 92.4%, 而其它10株双歧杆菌在此条件下的存活率均小于 31.25%, 其中B. adolescentis H3、B. adolescentis A8 和 B. longum D11 的存活率均未超过 1% , 说明这 10 株菌对模拟胃液特别敏感, 没有进一步筛选的价值, 所以仅选择具有良好耐酸特性的 B. animalis V9 作为进一步试验的对象。
2.4 B. animalis V9对 pH810人工肠液的耐受结果
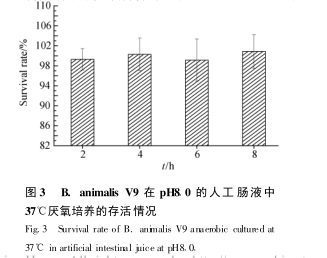
将具有良好耐酸特性的 B. animalis V9 在pH2.0 的人工胃液中厌氧消化 3h 后, 接入pH8.0的人工肠液中继续 37e 厌氧保温消化, 分别在不同时间取样计数并计算其存活率, 结果如图 3。
由图 3可以看出, B. animalis V9 在 pH8.0 的人工肠液中 37°C厌氧保温 8 h 后, 活菌数与存活率均无明显差异( p < 0.05) , 该菌株具有良好的耐受肠液特性。
2.4 B. animalis V9 对不同浓度牛胆盐的耐受结果
由图 4 数据分析得知, 结果按照 Chateau 等提出的方案进行分析, 该方案根据 LT 将耐受胆盐的菌株分为 4组: ( 1) 对胆盐不敏感 LT≤15min; ( 2) 可耐受胆盐LT15 <LT ≤40 min; ( 3) 轻微耐受胆盐 40< LT≤60 min; ( 4) 对胆盐敏感 LT > 60 min)[14]。B. animalis V9在含有不同牛胆盐浓度的 TPY 培养基中耐受情况有显著差异(p < 0.01) 。与对照组相比, 添加 0.3%的胆盐组延迟时间LT 为15 min, 添加0.5% 的胆盐组延迟时间LT 陡然增加至 17.01 h, 添加 0.8% 、1.0%的胆盐组在 24 h 内 OD 值均未增加0.3 个单位, 说明 B. animalis V9 对 0.3% 的牛胆盐浓度不敏感。

2.5 B. animalis V9 16S rDNA 鉴定结果
采用分子生物学手段 16S rDNA 对 B. animalis V9 进行鉴定, 通过 PCR 产物直接测序, 获得长度为1433 bp 的 16S rDNA 序列。通过 NCBI BLAST 比对分析, 发现与 Bifidobacterium animalis subsp. lactic 模式菌株 DSM 10140 和益生菌株 BB12 的同源性为99% 。运用专业软件 Mege 4.0 构建 Bifidobacterium属内 31个种以及 BB12和 V9 的系统发育树, 如图 5所示。
综上, B.animalis V9 进一步鉴定为Bifidobacterium animalis subsp.Lactic, 这与前期所做的生理生化试验结果是一致的。
3结论
本文从 12 位健康蒙古族儿童粪便中分离得到11 株双岐杆菌, 经生理生化试验鉴定, 得到 5 株 B.adolescentis: A1、H3、G4、A8、V10; 3 株 B. longum: C6、C7、D11; 1 株 B. pseudocatenlatum: B2; , 1 株 B.bifidum: G5; 1 株 B. animalis: V9。其中 B. animalis V9 具有较强的人工胃肠液和胆盐耐受性。通过分子生物学手段鉴定, B.animalis V9 为一株Bifidobacterium animalis subsp.Lactic。本研究证实B.animalis V9具有良好的益生潜力, 对该益生菌制剂的开发需要深入研究。
在国内益生菌的研究和应用方面, 存在一些亟待解决的问题: 一是目前成功应用于发酵乳制品生产的益生菌大都来自于国外, 如法国的罗地亚公司,丹麦的汉森公司, 荷兰 DSM 公司等, 国内具有自主知识产权且研究较系统的益生菌几乎没有; 二是缺乏对益生菌筛选、功能特性以及安全性方面的机理研究, 这是导致我国益生菌乳制品开发和应用方面落后于国外的关键所在。因此, 研究和开发来源于健康中国人肠道、有相当的益生功能特性和对人体的健康有疗效作用, 同时又具有安全性、能成功地应用于乳制品及保健食品生产的、拥有自主知识产权的益生菌菌株已势在必行。
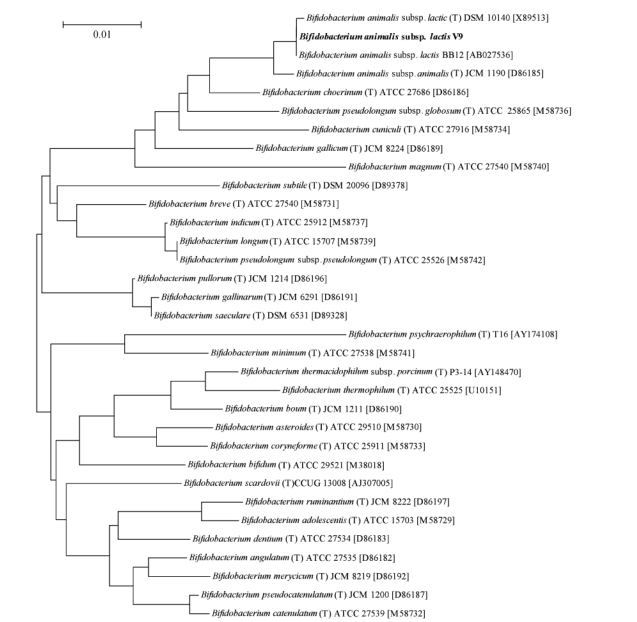
图 5Bifidobacterium 属 16S rDNA 系统发育树
Fig. 5 Phylogenetic treebased on the 16S rRNA sequences of Bifidobacterium genera, / T0represents thetype strain.
参考文献
[ 1 ] M. Carmen Collado, Yolanda Sanz. Method for direct selectionof potentially probiotic Bifidobacterium strains from human feces based ontheir acid-adaptation ability. Journal of Microbiological Methods, 2006, 66(7): 560- 563.
[ 2 ]Apostolou E, Pelto L. Differences in the gut bacterial flora ofhealthy and milk-hypersensitive adults, as easured by fluorescence in situhybridization. FEMS Immunology and Medical Microbiology, 2001, 30: 217- 221.
[ 3]金红芝, 范小兵, 杭晓敏, 等. 儿童肠道双歧杆菌和乳杆菌种群结构分析. 微生物学报( Acta Microbiologica Sinica) ,2005, 45(4): 567- 570.
[ 4]Jaya Prasad, Harsharanjit. Selection and Characterisation of Lactobacillus
And Bifidobacterium Strains for Use as Probiotics. Dairy Journal,1998, 993- 1002.
[ 5]Lefteris Makra. Kinetic analysis of the antibacterial activity ofprobiotic lactobacilli towards Salmonella enterica serovar Typhimurium revealsa role for lactic acid and other inhibitory compounds. Research in Microbiology, 2006,157: 241- 247.
[ 6 ]Sumangala Gokavi. Oa-t based symbiotic beverage fermented byLactobacillus plantarum, Lactobacillus paracasei ssp.casei, and Lactobacillusacidophilus. Journal of FoodScience, 2005, 70( 4): 216- 223.
[ 7 ]EM Tuomola. The effect of probiotic bacteria on the
adhesion of pathogens to human intestinal mucus. FEMSImmunology andMedical Microbiology, 1999, 138 ( 26) : 137- 142.
[ 8 ]WP Charteris. Development and application of an in vitro methodologyto determine the transit tolerance of potentially probiotic Lactobacillus andBifidobacterium species in the upper human gastrointestinal tract. Journal ofApplied Microbiology, 1998, 84: 759- 768.
[ 9 ] Usman A, Hosono. Bile Tolerance, Taurocholate Deconjugation, and Binding ofCholesterol by Lactobacillus gasseri Strains. Journal of Dairy Science, 1999,82: 243- 248.
[ 10]Sullivan DJO. Screening of intestinal microflora for effective probioticbacteria. AgricFood Chem , 2001, 49 (1) : 1751- 1760.
[11]Lorella Bevilacqua. Screening of Bifidobacterium strains isolatedfrom human faeces for antagonistic activities against potentially bacterial.Pathogens Microbiol Reserch, 2003, 158: 179- 185.
[12]王勇. 双歧杆菌的选择计数培养基. 国外医学临床生物化学与检验学分册( Foreign MedicalSciences( Clinical Biochemistry Laboratory Medicine ForeignMedical Sciences), 2005,26 (12) : 899- 900.
[13]Ausubel FM, Brent R, Kingston RE, et al. 精编分子生物学实验指南. 颜子颖, 王海林, 译. 北京: 科学出版社, 1998.
[14]Chateau, N, Deschamps, AM, Hadj Sassi,A. Heterogeneity of bilesalts resistance in the Lactobacillus isolates of a probiotic consortium.Lettersin Applied Microbiology, 1994, 18: 42- 44.
[15]RE Buchanan, NE Glbboms. 伯杰氏细菌鉴定手册, 洪俊华译. 北京: 科学出版社, 1986.
 妇产科在线APP下载
妇产科在线APP下载










 京公网安备 11010202008857号
京公网安备 11010202008857号