今天,国家药品监督管理局传来令人振奋的重磅新闻:则乐®(尼拉帕利)批准用于一线含铂化疗完全或部分缓解的所有(不论其生物标志物状态如何)上皮性卵巢癌、输卵管癌或原发性腹膜卵巢癌成人患者维持治疗。
则乐®活性高及代谢途径独特
则乐®是一种口服、每日一次的聚ADP核糖聚合酶(PARP)抑制剂,选择性抑制PARP1/2酶,具有更强的PARP捕获活性,半衰期长达36小时,疗效卓越,一天一次的给药方便。除此之外,则乐®是唯一一款可以通过血脑屏障的PARPi药物,这意味着该药物可用于治疗脑转移的卵巢癌患者。还有则乐®独特的代谢途径——羧酸酯酶代谢,具有较少的药物相互作用,不会影响高血压及糖尿病常见药物的使用。
PRIMA研究奠定则乐®一线维持治疗地位
这项新适应症获批的主要依据是名为PRIMA(ENGOT-OV26/GOG-3012)的国际三期临床研究,该研究的结果已在2019年ESMO公布,并同步发表在顶尖的《新英格兰医学杂志》上。研究结果表明,则乐®用于卵巢癌的一线维持治疗疗效卓越,全人群获益,打破了只有BRCA突变卵巢癌患者才能从PARPi一线维持治疗中获益的僵局!此外,PRIMA研究入组了疾病进展风险高的人群,更加贴近临床需求。具体请看下面的PRIMA研究生存曲线图:
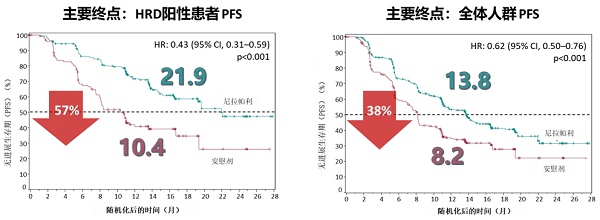
整体来看,与安慰剂相比,则乐®可显著延长全体人群的无进展生存期(PFS)至13.8个月,降低38%疾病进展或死亡风险。并且则乐®在HRD阳性患者组表现更加优异,可显著延长PFS至21.9个月,降低57%疾病进展或死亡风险。
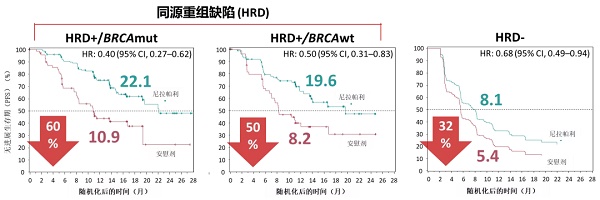
进一步分析,可以发现HRD+/BRCA突变的患者可以从则乐®一线维持治疗中获益更多,PFS达到22.1个月,降低疾病进展或死亡风险60%;HRD+/BRCA野生型患者组,则乐®组PFS延长至19.6个月,降低疾病进展或死亡风险50。值得注意的是,即使是HRD阴性亚组也能获益,则乐®组PFS延长至8.1个月,降低疾病进展或死亡风险32%。
新适应证获批,更广泛的卵巢癌患者将获益
2020年4月美国FDA基于PRIMA研究批准了则乐®(尼拉帕利)的补充新药申请,作为对一线铂类化疗后完全或部分缓解的晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者的一线维持治疗,不论其生物标记物状态如何。此外,则乐®还以高证据级别获得NCCN指南以及国内PARPi指南推荐用于晚期卵巢癌一线维持治疗。
去年12月则乐®成功在中国上市第一个适应症,用于铂敏感复发卵巢癌维持治疗,而此次获批的第二个适应症是含铂化疗后获得PR或CR的所有新诊断卵巢癌一线维持治疗。此次适应症的获批将适用人群进一步扩大,为中国患者带来了更多的选择和希望。此外,则乐®在国内也开展了卵巢癌相关的三期临床研究,包括用于铂敏感复发卵巢癌患者维持治疗的NORA研究以及用于晚期卵巢癌患者一线维持治疗的PRIME研究。目前,NORA研究的结果已于2020年5月公布为阳性,具体的数据将会在本月的ESMO上进行口头报告揭晓。PRIME研究在2019年11月完成384例患者随机入组,目前正在积极随访过程中。
则乐®是首个本土生产的国家1类新药PARP抑制剂,仍有多项临床试验正在进行中,包括卵巢癌后线治疗、肺癌、胃癌等。期待该药未来造福更多中国肿瘤患者。
 妇产科在线APP下载
妇产科在线APP下载













