子宫平滑肌瘤是常见的妇科良性肿瘤之一,发病率在5.4%~77%,以子宫内良性平滑肌瘤最为常见。而子宫外的平滑肌瘤(LBU)是指在子宫外生长的良性平滑肌细胞肿瘤。该实体的亚型主要有子宫静脉内平滑肌瘤病(intravenous leiomyomatosis,IVL)、良性转移性平滑肌瘤(BML)、弥漫性腹膜平滑肌瘤病(DPL)、腹膜后平滑肌瘤和寄生性平滑肌瘤。IVL是一种罕见和特殊类型的平滑肌肿瘤,1896年由Birch首次进行描述,其特征是良性平滑肌生长在静脉系统的血管空间内。
文献统计IVL的发生率约为0.25%~0.40%[1]。到目前为止,文献中已报道了约300例病例。2020年WHO明确指出,IVL是平滑肌瘤组织出现生长结构异常的一种良性疾病[2],但其生物学行为却有蔓延性生长、易复发等恶性表现。通常IVL起源于子宫,但它可以沿着静脉系统延伸到下腔静脉、右心甚至肺动脉。由于该病诊断存在一定困难,复发率高,临床医生应提高对本病的认识,尽量做到早期识别并且全面评估,以降低复发风险,改善患者生存。

作者:王雅卓
单位:河北省人民医院妇科
IVL的发病机制仍有待阐明,目前主要有以下两种理论:(1)肿瘤由血管壁肌层的平滑肌细胞发展形成;(2)肿瘤由子宫平滑肌瘤细胞生长并侵袭入血管腔形成[3]。IVL细胞几乎均表现出雌孕激素受体ER和PR阳性,而内皮细胞和内皮下细胞常不表达或弱阳性,因此,有学者推测IVL可能起源于子宫平滑肌瘤[4]。目前已有很多研究表明,大多数IVL患者均有子宫肌瘤或有子宫肌瘤切除术/子宫切除术史。
在最近的一项回顾性研究中,共纳入25例IVL患者,其中20例患者有妇科或产科手术史,包括子宫肌瘤切除术(24%)、剖宫产术(44%)和宫内节育器置入术(16%)[5]。这提示,手术引起的血管损伤可能为IVL的形成创造一定条件,但还需要进一步的研究来验证这一假设。
Ordulu等学者认为,IVL可能是子宫平滑肌肿瘤良恶性肿瘤之间的一种特殊中间体;也有研究证实IVL的表达谱与平滑肌肉瘤相似[6]。总之,关于其发病机制,尚需进一步探索和研究。
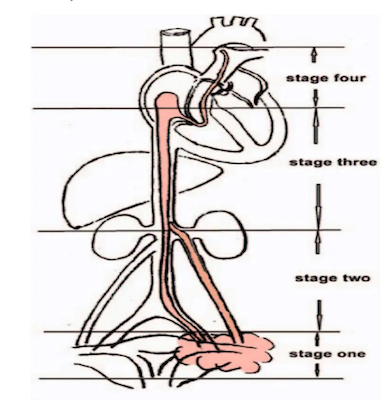
IVL好发于育龄期或围绝经期女性,文献统计平均发病年龄在45岁左右。在临床上子宫IVL可分为4个期别:侵犯子宫静脉并局限于盆腔,被认为是I期;延伸到腹腔但不累及肾静脉的肿瘤,被认为是II期;肿瘤侵犯肾静脉和下腔静脉,并进一步延伸至右心房,但未到达肺动脉,被认为是III期;到达肺动脉和/或转移到肺的肿瘤,被认为是IV期(图1)[7]。几乎所有的研究均显示,I期患者的临床表现缺乏特异性,与子宫平滑肌瘤相似,通常表现为月经过多、腹痛、盆腔包块,或由肿物引起的压迫症状等。但如果病变累及下腔静脉、心脏或肺动脉,则可引起胸闷、呼吸短促、下肢肿胀、晕厥、体位性低血压、心功能不全、肺栓塞、Budd-Chiari综合征、休克,甚至猝死。
术前影像学检查对IVL患者的诊断价值有限。IVL的盆腔超声表现与子宫肌瘤相似,彩色多普勒血流成像常显示丰富的血流。当IVL浸润子宫旁血管时,常被误诊为阔韧带肌瘤或卵巢肿瘤。因IVL血管内肿物可沿髂静脉、下腔静脉等子宫外血管延伸,甚至可延伸至右心出现瘤栓,目前有学者认为,采用妇科超声联合下腔静脉彩超以及超声心动图等检查可以提高静脉内血管平滑肌瘤病的术前诊断率。
此外,可根据患者情况选择下腔静脉CT血管成像、磁共振成像(MRI)、血管造影等辅助检查以提高IVL的诊断率。肿瘤标志物如CA125、CA199及甲胎蛋白,特异性均不高。IVL主要的诊断手段是术中及术后的病理检查,当手术中发现沿盆腔血管走形的串珠样、条索状、蠕虫样结节或血供丰富的实性肿物,特别是在阔韧带发现蠕虫状肿块时,应充分考虑该诊断并通过快速病理检查确诊(国内研究发现,77%的伴有盆腔肿块的IVL可累及阔韧带),但是IVL冰冻病理检查的准确率低。在一项纳入25例IVL患者的回顾性研究中,仅有4例经术中冰冻病理检查确诊。石蜡切片病理检查依然是诊断IVL患者的最可靠方法。
IVL的病理特征是子宫平滑肌瘤以外的组织中静脉内有平滑肌瘤生长,一般不超出血管外。从大体形态来看,子宫常因子宫肌瘤而呈现增大的表现,在子宫肌层静脉内或宫旁血管内形成蠕虫样、条索样实性瘤栓,肿瘤组织与血管壁之间有一定间隙,很容易分离和剥离。
病理学家应采用正确的取样和包埋方法。标本必须包括肿瘤及周围的子宫平滑肌组织,平行切开正常肌层与肿瘤,以避免肿瘤的缩回导致漏诊。镜下可在子宫肌层静脉内见到平滑肌瘤瘤栓,表面有血管内皮细胞覆盖,肿瘤细胞无异型性。在大多数情况下,免疫组化检查中,平滑肌肌动蛋白(SMA)、波形蛋白(Vimentin)、结蛋白(Desmin)、CD34、雌孕激素受体ER、PR等呈阳性表达,CD10呈阴性或局灶性阳性,Ki-67指数通常小于5%。主要的鉴别诊断包括普遍的子宫平滑肌瘤、低级别子宫内膜间质肉瘤、平滑肌肉瘤和Sternberg瘤等。
1、手术治疗
手术切除是IVL患者的主要治疗方法,手术应始终以完全切除肿瘤为目标。原则上,建议大多数患者进行子宫切除术。对于绝经或接近绝经(≥40岁,也有文献报道≥45岁)或有子宫外血管浸润的患者,推荐同时行输卵管卵巢切除术。也有一些学者认为,对于没有生育要求的女性,即便还年轻,也应接受输卵管卵巢切除术。
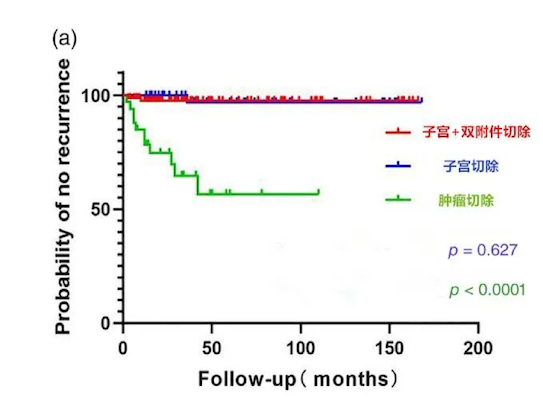
然而,近些年来越来越多的研究认为,是否行卵巢切除术和术后抗雌激素治疗与复发无关[8]。最近的一项研究共纳入260例IVL患者,是目前样本量最多的一项研究,其中46例进行了全子宫切除术,86例进行了全子宫加双附件切除术,34例仅进行了肿物切除术。生存分析显示,全子宫切除术与全子宫加双附件切除术的术式不同对于复发没有影响(P=0.627),而仅行肿瘤切除术的患者复发风险大大升高(图2)(P<0.001)[9]。
当病变累及肾静脉、下腔静脉或心脏和肺的血管时,需要进行多学科手术。手术的难度更多地取决于肿瘤浸润和血管壁变形的程度,而不是其长度。手术的并发症有死亡、肿瘤周围血管化引起的出血、感染、栓塞等。为了预防出血并降低风险,在高度可疑IVL时,术前需充分备血,子宫动脉栓塞或子宫动脉结扎也可作为一种选择。
2、激素治疗
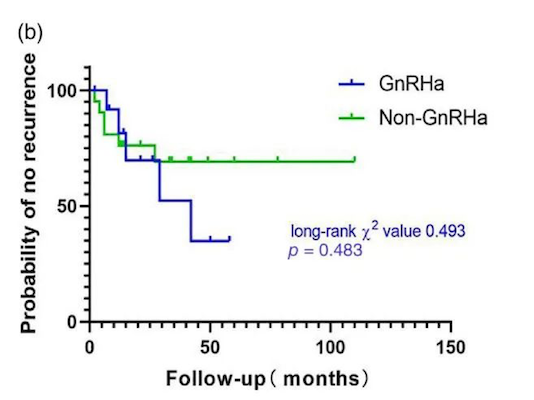
IVL患者术后激素辅助治疗始终存在争议。由于IVL雌激素和孕激素受体阳性,肿瘤生长似乎与激素水平有关,外源性雌激素必须避免。迄今为止,关于IVL患者的激素治疗,如促性腺激素释放激动剂、芳香化酶抑制剂或选择性雌激素受体调节剂(SERM)等尚没有高质量循证医学数据证实其有效。一项研究对34例全子宫切除术后患者使用GnRHa与未使用GnRHa的复发情况进行分析,结果显示差异无统计学意义(P=0.483)(图3)[9]。
也有一些学者认为,对于高复发风险的病例,如初始肿瘤体积大或手术切除不完全,为了降低复发风险或术前减小肿瘤体积时可考虑激素治疗,但需要对激素治疗带来的生存获益和副反应进行权衡[10-12]。总体来说,IVL患者的激素治疗尚缺乏大样本临床病例的观察和数据分析,有待进一步的研究。低剂量局部放射治疗可用于复发高风险的患者[13]。
3、IVL患者复发后的治疗
IVL在术后很容易复发。据文献报道,复发率约为16.6%~30%[14]。肿瘤复发的风险与肿瘤切除的程度密切相关,复发部位主要局限于盆腔和髂静脉,很少见于下腔静脉和心脏。患者年龄较轻、初始肿瘤较大(>7 cm)、阔韧带损伤和大静脉受累是复发的高危因素。因此,术后应进行长期随访,尽早发现复发的病变,观察残留病变的动态变化。随访应包括系统的检查,特别是生殖系统检查,定期进行心血管系统超声检查、盆腔检查,必要时应进行增强CT或MRI。
然而,目前对于随访的周期并没有达成共识。一些学者建议6个月随访一次,每2年至5年进行一次CT扫描,但另一些学者则建议采用更紧密间隔的监测方案(每3~6个月随访一次)[15]。对于IVL复发患者,如果条件允许,手术仍然是最有效的治疗方法。
综上所述,IVL是一种相对罕见的疾病,早期缺乏特异性临床表现,术前诊断困难,手术完整切除病灶是预防复发的最重要方式。临床医生、放射科医生及病理学家应加强对本病的认识,术前充分评估,术中仔细探查,尽可能减少误诊误治。术后定期随访,及早发现复发征象,以改善患者的长期预后。
参考文献
[1] Birch H. Lehrbuch der pathologischen Anatomie. Leipzig, Germany: FCW Vogel; 1896.
[2] WHO Classification of Tumours Editorial Board. WHO classification of tumours: female genital tumours [M]. Lyon (France): IARC Publications, 2020:1-632..
[3] Diakomanolis E, Elsheikh A, Sotiropoulou M, et al. Intravenous leiomyomatosis. Arch Gynecol Obstet 2003; 267:256-7.
[4] Kir G, Kir M, Gurbuz A, et al. Estrogen and progesterone expression of vessel walls with intravascular leiomyomatosis; discussion of histogenesis. Eur J Gynaecol Oncol 2004;25:362-6.
[5] Yu X, Fu J, Cao T, Huang L, Qie M, Ouyang Y. Clinicopathologic features and clinical outcomes of intravenous leiomyomatosis of the uterus: A case series. Medicine (Baltimore). 2021 Jan 8;100(1):e24228.
[6] Buza N, Xu F, Wu W, et al. Recurrent chromosomal aberrations inintravenous leiomyomatosis of the uterus: high-resolution array comparative genomic hybridization study. Hum Pathol 2014;45:1885-92.
[7] Mathey MP, Duc C, Huber D. Intravenous leiomyomatosis: Case series and review of the literature. Int J Surg Case Rep. 2021 Aug;85:106257. doi: 10.1016/j.ijscr.2021.106257. Epub 2021 Jul 31.
[8] Yu X, Zhang G, Lang J, et al. Factors associated with recurrence after surgical resection in women with intravenous leiomyomatosis. Obstet Gynecol 2016;128:1018-24.
[9] Peng J, Zhong F, Zhu Y, Zhang M, Zhang M, Lu C, Wang Y, Qi X, Wang C, Li G. Clinical analysis of uterine intravenous leiomyomatosis: A retrospective study of 260 cases. J Obstet Gynaecol Res. 2021 Dec; 47(12): 4357-4364.
[10] C. Mizoguchi, H. Matsumoto, K. Nasu, M. Arakane, K. Kai, H. Narahara. Intravenous leiomyomatosis treated with radical hysterectomy and adjuvant aromatase inhibitor therapy. J. Obstet. Gynaecol. Res. 42 (10) (2016 Oct) 1405-1408.
[11] A. Biri, U. Korucuoglu, N. Zumrutbas, B. Tiras, H. Guner, Intravenous leiomyomatosis treated with aromatase inhibitor therapy, Int. J. Gynaecol. Obstet.101 (3) (2008 Jun) 299-300.
[12] A. Mitsuhashi, Y. Nagai, M. Sugita, N. Nakajima, S. Sekiya. GnRH agonist for intravenous leiomyomatosis with cardiac extension. A case report, J. Reprod. Med. 44 (10) (1999 Oct) 883-886.
[13] M.G. Chan, K.G. Huang. Intravenous leiomyomatosis in the parametrium. J. Minim. Invasive Gynecol. 23 (6) (2016 Sep-Oct) 849-850.
[14] Clement PB, Young RH, Scully RE. Intravenous leiomyomatosis of the uterus. A clinicopathological analysis of 16 cases with unusual histologic features. Am J Surg Pathol 1988;12:932-45.
[15] Patricia Correia, Ana Castro, Anabela Rocha, et al. Pelvic intravenous leiomyomatosis-case report. Rev Bras Ginecol Obstet 2016;38:412-5.

王雅卓,博士,主治医师,河北省人民医院妇科工作。
社会职务:河北省妇幼保健协会妇女健康管理专业委员会委员、河北省疼痛医学会妇科专业委员会委员、河北省优生优育协会阴道镜和宫颈病理学专业委员会委员。
专业特长:熟练掌握妇科常见病及多发病的诊治,擅长宫颈病变诊治和妇科良恶性肿瘤的治疗,主要从事妇科恶性肿瘤的基础与临床研究。
科研成果及获奖情况:参与省级科研课题3项,发表论文及著作十余篇;获得“思辨卓行”辩论赛全国二等奖、河北医科大学英文授课竞赛二等奖、河北省人民医院科普大赛二等奖、河北省人民医院授课竞赛二等奖。
声明:本文为作者原创投稿并授权发布,文章仅代表作者观点,不代表本平台立场。如需转载请留言获取授权,未经授权谢绝转载。
 妇产科在线APP下载
妇产科在线APP下载













