2016年ESMO大会上NOVA研究结果惊艳亮相,则乐®(尼拉帕利)在2017年成为全球第一个获批用于所有铂敏感复发卵巢癌患者维持治疗的PARP抑制剂。时隔4年,姊妹研究NORA以proffered oral (完整口头汇报) C位登场2020 ESMO。
NORA研究是一项由中国妇科肿瘤专家独立设计并完成的前瞻性、随机双盲、多中心III期临床研究,并获得国家“十三五”“重大新药创制”科技重大专项支持。
NORA研究由复旦大学附属肿瘤医院吴小华教授牵头,在全国30家医疗中心开展,在不到1年半的时间里,共纳入265例以高级别浆液性复发性卵巢癌为主的铂敏感患者,按2:1随机接受则乐®(尼拉帕利)(n=177)或安慰剂(n=88)口服治疗。除方案之初的16名患者接受了300mg的固定起始剂量,其余249名患者都接受了个体化起始剂量(基线体重<77kg或血小板计数<150000/ul的患者使用200mg/日起始剂量,其余使用300mg)。主要终点为独立中心影像学评估的无进展生存期(PFS)。
研究结果显示,在ITT人群中,则乐®(尼拉帕利)组PFS较安慰剂组显著延长:18.3个月vs5.4个月 (HR=0.32; 95%CI,0.23-0.45;p< 0.0001)。

gBRCA突变亚组PFS延长更显著:则乐®(尼拉帕利)组目前仍未达到中位值vs安慰剂组5.5个月 (HR=0.22; 95%CI,0.12-0.39;p< 0.0001);
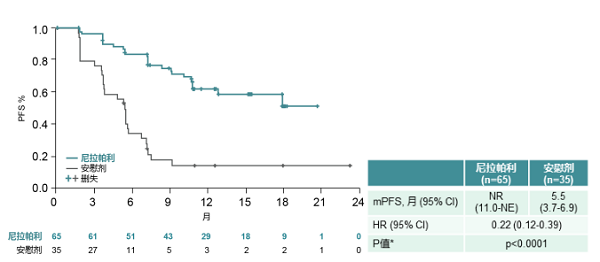
非gBRCA突变亚组,则乐®(尼拉帕利)组对比安慰剂组PFS也有显著延长:11.1个月vs 3.9个月(HR=0.40; 95%CI,0.26-0.61;p< 0.0001)。
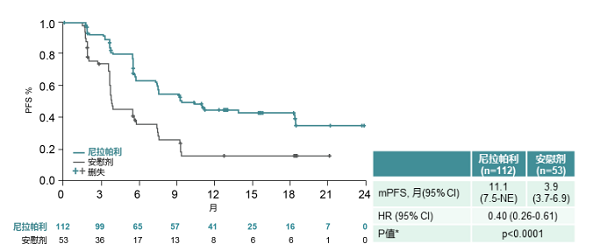
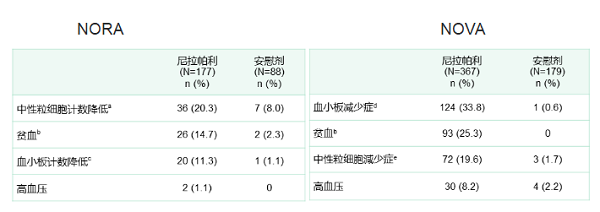
所有预设亚组分析均显示则乐®(尼拉帕利)较安慰剂有显著的生存获益。次要终点无化疗间期(CFI)和至第一次后续治疗开始时间(TFST)结果与主要终点PFS相一致,在则乐®(尼拉帕利)组均有显著延长(HR=0.34;HR=0.35)。相比NOVA固定起始剂量,个体化起始剂量改善尼拉帕利的安全性,尤其是血液学毒性(见下表)。绝大部分不良反应均可以通过剂量调整改善,因TEAE造成的治疗终止率在则乐®(尼拉帕利)组和安慰剂组分别是4%和5.7%。
【leading PI寄语】
该研究是则乐®(尼拉帕利)作为1类新药在中国申请的首个PARP抑制剂III期多中心的注册临床研究。NORA的亮点1. 首个前瞻性验证了则乐®(尼拉帕利)个体化起始剂量在铂敏感复发患者维持治疗的有效性和安全性,应被视为卵巢癌维持治疗的标准临床实践, 200mg起始剂量更加适合中国卵巢癌患者。亮点2. 继NOVA之后在卵巢癌PSR患者中再次印证了尼拉帕利全人群获益。亮点3. 迄今为止经中国患者大样本验证的最具有参考价值的III期临床研究结果。
NORA研究是中国卵巢癌临床研究一个新的起点,激励我们继续前行,继续推动整个中国乃至全球复发卵巢癌患者维持治疗领域的进步和发展。同时我们更加期待另一项中国人自己的临床研究:则乐®(尼拉帕利)用于新诊断晚期卵巢癌维持治疗的PRIME研究的结果,希望为中国乃至全球患者使用则乐®(尼拉帕利)治疗提供更多的数据支持!
最后感谢所有患者,研究者和为NORA研究做出贡献的伙伴们!
Leading PI简介

 妇产科在线APP下载
妇产科在线APP下载













