摘要
比较益生菌干酪乳杆菌Zhang(L. casei Zhang)与商业化益生菌嗜酸乳杆菌 NCFM(NCFM)、鼠李糖乳杆菌 GG(LGG)、干酪乳杆菌 Shirota(LcS)、动物双歧杆菌 Bb12(Bb12)对人工胃肠液的耐受性及发酵特性。将各菌置于人工消化液及含 3.0 g/L 牛胆盐的 MRS 培养基中,37 ℃培养,分别于 3 h 和 8 h 时测定人工胃液和肠液中各菌株的存活率,同时每小时测定 MRS 培养基的浊度,以延迟时间评价各菌株对胆盐的耐受性。对由各菌株制得的发酵乳在发酵及贮藏期间酸度与活菌数的变化进行了测定,结果表明,在 pH 2.5 的人工胃液消化 3 h 后,干酪乳杆菌 Zhang 存活率低于 NCFM(p<0.05< span="">),高于其它 3 株对照菌(p<0.05< span="">);在 pH 3.0 和 pH 4.0 的人工胃液消化 3 h 后,干酪乳杆菌 Zhang 的存活率与 4 株对照菌无显著差异(p>0.05);在 pH 8.0 的人工肠液消化 8h 后,干酪乳杆菌 Zhang 的存活率高于 Bb12(p<0.05< span="">),低于 NCFM(p<0.05< span="">),与其它 2 株对照菌无差异(p>0.05)。干酪乳杆菌 Zhang 对 3.0 g/L 牛胆盐的耐受性与 LcS 差异不显著(p>0.05),而高于其它 3 株对照菌(p<0.05< span="">)。脱脂乳37 ℃发酵 24 h 后,接种干酪乳杆菌 Zhang 的样品的酸度低于 4 株对照菌。 4 ℃贮藏 28 d 内,各益生菌在发酵乳中继续生长,其中干酪乳杆菌 Zhang 发酵乳的 pH 值变化(降低 0.55)显著高于 4 株对照菌(p<0.05< span="">);贮藏 28 d后干酪乳杆菌 Zhang 活菌数为 1.0×109cfu/g,显著高于 4 株对照菌(p<0.05< span="">),说明干酪乳杆菌 Zhang 具有良好的胃肠转运耐受性和极佳的贮藏稳定性。
益生菌是指“当摄入一定量时能对宿主健康有作用的微生物活体”[1]。它具有改善肠道菌群结构,抑制病原菌,生成营养物质,提高机体免疫力,消除致癌因子,降低胆固醇和血压,改善乳糖消化性等功能。因此,益生菌对于人类的营养和健康具有重要的意义。益生菌及其制品正日益受到人们的重视,并成为乳品微生物研究的热点。若使益生菌发挥功效,首要条件是能够克服胃肠道中物理及化学因素的影响,对胃酸和胆盐等具有很好的耐受性[2]。对不同浓度胆盐、人工胃液和人工胰液的耐受性这三项指标被用来确定益生菌在上消化道的存活率[3-4]。其次,益生菌的稳定性对保证该菌及其最终配方产品对宿主的功能性而言至关重要[2],即若要使益生菌起作用,在整个货架期间益生菌制品中必须保持足够数量的活菌数。目前已有的研究表明双歧杆菌、嗜酸乳杆菌等少数乳酸菌能够顺利经过消化道到达肠道,而其它乳酸菌,有的经过胃肠道消化后被完全杀灭,有的活菌数大大降低。 Cherteri等[4]提出一种模拟胃肠道转运的体外试验模型,用来检测益生菌对上消化道转运的耐受性。他们将益生菌菌株(双歧杆菌和乳杆菌)的细胞悬浮液置于模拟胃液(pH2.0,含胃蛋白酶3 g/L 和 NaCl 5 g/L)和模拟胰液(pH 8.0,含胰蛋白酶 1g/L 和 NaCl 5 g/L)中,并在有或没有乳蛋白及猪胃粘蛋白存在的条件下定时(1、90、180 min)观察活菌总数的变化,结果表明大多数菌虽然对胃转运比较敏感,但对小肠转运有天生的耐受性。此外,肠道内胆汁浓度是变化的,很难预测其在某时间段内的浓度。因胆汁盐含量在 0.3~3.0 g/L 范围内波动,故在体外研究益生菌对酸和胆盐的耐受能力时,很多研究者采用 3.0g/L 的胆盐环境(pH 3.0)。研究表明,只有每日摄入足够数量(1×108~1×109cfu/mL)的活性菌体,才能发挥益生菌良好的保健功能。开发益生菌产品的成功标志是确保产品在贷架期间足够的存活益生菌数。
目前,国际上商业化生产的益生菌主要有丹麦丹尼斯克的嗜酸乳杆 NCFM(NCFM)、芬兰维利奥的鼠李糖乳杆菌 GG(LGG)、日本养乐多的干酪乳杆菌 Shirota(LcS)和丹麦科汉森的动物双歧杆菌 Bb12 等。大量的研究表明这些益生菌的耐胃酸和胆汁性能非常突出[5-6],它们被公认为对宿主健康有益,并被用于各种产品中[7-10]。国内乳品企业使用的益生菌 90%来自上述公司,如此下去必将制约我国益生乳酸菌产业的发展。改变这种状况的根本方法在于研制具有自主知识产权的益生乳酸菌菌种。
干酪乳杆菌 Zhang(L. caseiZhang)是分离自内蒙古地区传统酸马奶中的 1 株益生菌。我国是第 1 个对其进行基因全序列测定的国家。经16Sr DNA 同源性分析,其与 Gene Bank 中标准菌株干酪乳杆菌 ATCC334 的同源性达 100%。5年多的研究表明该菌潜在的益生价值。其属同型乳酸发酵乳杆菌,能够利用核糖、葡萄糖、甘露糖等多种糖类;对酸和胆盐有较强抵抗能力;能够在小鼠肠道内定殖,对病原菌具有拮抗作用;通过吸收、吸附胆固醇及减少肝、肠循环中胆酸来降低灌服活菌小鼠的血脂浓度。此外,该菌还能显著增加小鼠血清中抗体的含量,调节细胞免疫、体液免疫及肠黏膜局部免疫功能[11-14]。干酪乳杆菌 Zhang 来源明确,种属特征清晰,许多重要的益生性状表现突出,因此其既是乳酸菌研究理想的模式菌株,又是益生菌开发难得的菌种。
本文针对益生菌对上消化道的耐受问题及其在产品中的稳定性问题,以 NCFM、LGG、LcS、Bb12 为参照,研究干酪乳杆菌 Zhang 对胆盐、人工胃肠液的耐受性及其在脱脂乳中的发酵特性和在发酵乳中的贮藏稳定性,旨在为干酪乳杆菌Zhang 益生菌发酵乳制品的工业化生产提供基础数据。
1材料与方法
1.1菌株
1.1.1菌株来源
干酪乳杆菌 Zhang 由内蒙古农业大学乳品生物技术与工程教育部重点实验室乳酸菌菌种库提供;NCFM(DVS)由丹尼斯克(中国)有限公司提供;LGG(DVS)由芬兰维利奥公司提供;LcS 由市售“养乐多”发酵乳饮料中分离得到;Bb12(DVS)由科·汉森(中国)有限公司提供。
1.1.2菌株的培养
干酪乳杆菌 Zhang:将-80 ℃冷冻保存的干酪乳杆菌Zhang 接种于 MRS 液体培养基中,37 ℃培养 16~18 h,传代培养 2 次。NCFM:将直投发酵剂(DVS)接种于 MRS 液体中,37 ℃ 16~18 h 传代培养 2 次。LcS:将分离自“养乐多”的干酪乳杆菌 Shiro-ta 在 10%脱脂乳中-80 ℃保存。使用前室温解冻,接种于 MRS 液体培养基中,37 ℃ 16~18 h 传代培养 2 次。LGG:将直投发酵剂(DVS)接种于 MRS 液体培养基中,37 ℃ 16~18 h 传代培养 2 次。Bb12:将直投发酵剂(DVS)接种于(MRS+0.5g/L cys-HCL)[15]液体培养基中,37 ℃ 16~18 h 传代培养 2 次。
1.2主要试剂和仪器
胃蛋白酶(pepsin),sigma 公司;胰蛋白酶(Trypsin),sigma 公司;牛胆盐,北京双旋微生物培养基制品厂。Brookfield DV-1 VISCOMETER 黏度仪;pH计(雷磁 PHS-3C),上海精密科学仪器有限公司; Eppendorf TGL-168 高速台式离心机;-80℃低温冰箱(NU-6511-E),日本;无菌工作台(NSC-ⅡA-1200),日本;全自动高压灭菌器(HIRAYAMAHA-300M)、全自动高压干热灭菌器(ADVANTECSP-650)。
1.3菌株对胆盐及人工胃肠液耐受性研究
1.3.1
菌株生长曲线的测定取0.1 mL 上述传代培养 2 次的各菌株,接种于5.0 mL 相应培养基中,37 ℃培养 24 h。每隔 2 h 取样,于 600 nm 处测定其吸光值。
1.3.2
供试菌液的制备1)将各传代培养第 2 次且为生长稳定期[16]的菌体离心(3 000g/7 min/4 ℃),收集,用 PBS[8.0 g/L NaCl-0.2 g/L KH2PO4-1.15 g/L Na2HPO4,pH 7.2]洗涤 2 次(PBS 下同)[17]。
2)洗涤后的菌体悬浮于 10 mL PBS 中,用灭菌 PBS 梯度稀释至一定倍数,采用 MRS 琼脂培养基平板倾注法(下同)37℃培养48 h,计菌落总数,同时测定相应稀释度菌体的 OD600nm值。
3)根据上述各稀释度 OD 值与所对应的近似菌落数(cfu/mL)的线性关系[18],通过调整各菌体在600 nm 处的 OD 值,使各供试菌体最终浓度为(1~2)×109cfu/mL[19]。
1.3.3
低 pH 值 PBS 的制备方法[4]以上 PBS 用浓 HCl 调整pH分别为2.5、3.0 和 4.0,121 ℃ 15min 灭菌备用。
1.3.4
耐胆盐基础液的制备方法[16] MRS 液体培养基中添加 3.0g/L 牛胆盐和 2.0 g/L 巯基乙酸钠。
1.3.5
人工胃液和胰液的制备方法 [20]在 pH 值分别为 2.5、3.0、4.0 的灭菌 PBS 中,以过滤除菌法加入 3.0 g/L 胃蛋白酶,制成人工胃液;在pH 8.0(用 0.1 mol/L NaOH 调整)的灭菌 PBS 中,以过滤除菌法加入 1.0 g/L 胰蛋白酶,制成人工胰液。
1.3.6
低 pH 环境中供试菌株耐受能力的测定取 1.0 mL 各供试菌液,加入到 9.0 mL 本文 1.3.3节的 PBS 中,37 ℃保温3 h,取样,用平板计数法测定活菌数。每个样品3个平行。
1.3.7
供试菌株对胆盐耐受能力的测定方法[16]以 1%接种量将各供试菌液接种至含胆盐(3.0 g/L)和不含胆盐的MRS 溶液中,37 ℃培养 24 h,每小时取样测定吸光值(OD620nm),直至吸光值增加0.3 个单位以上时停止培养。以时间和吸光值作生长曲线图,计算各菌株在含胆盐和不含胆盐的MRS 培养基中生长时 OD 值增加 0.3 个单位所需时间。以二者时间之差(延迟时间)来判断各菌株对胆盐的耐受性。每个样品 3 个平行。
1.3.8
供试菌株对人工胃液和胰液耐受能力的测定[20]取 1.0 mL 各供试菌液,加入到 9.0 mL 人工胃液(见本文 1.3.5 节)中,37 ℃消化 3 h,取样,用平板计数法测定活菌数。之后,吸取 1.0 mL 消化3 h、pH 3.0 的人工含菌胃液,加入到 9.0 mL 人工胰液(见本文 1.3.5 节)中,继续于 37 ℃培养。分别于 0、2、4、8、12 h 取样,用平板计数法测定活菌数。每个样品 3 个平行。
1.4
供试菌株发酵特性研究
1.4.1
供试菌株的扩大培养将各菌株供试菌液以 1×106cfu/mL 接种量接种于灭菌脱脂乳(11%,添加 5%蔗糖和 0.75%葡萄糖)中,37 ℃培养 18h,制成母发酵剂。
1.4.2
供试菌株发酵特性测定11%脱脂乳(其中添加 5%蔗糖和 0.75%葡萄糖)经95℃5 min杀菌后,冷却至37℃,以2%的接种量将各母发酵剂接种于脱脂乳中,于37℃恒温发酵,分别在 0、3、6、9、12、15、18 和 24 h 取样测定其 pH 值、滴定酸度、菌落总数。平行试验重复 3 次,取平均值。
1.5
供试菌株在发酵乳中的贮藏稳定性研究将已培养 24 h 的发酵乳样置 4 ℃冰箱中冷藏,分别于 7、14、21 和 28 d 时取样测定pH值、滴定酸度、菌落总数。平行试验重复3次,取平均值。
1.6
菌株存活率计算
菌株存活率(%)=lgcfu/Nl/lgcfuN0×100%式中,N1———菌株处理后活菌数(cfu/mL);N0——菌株初始活菌数(cfu/mL)。
1.7
数据统计分析3 个平行试验数据采用 SASANOVA 程序处理,p<0.05< span="">。
2
结果分析与讨论
2.1
供试菌株生长特性及对胆盐和人工胃肠液消化耐受性
2.1.1
供试菌株生长特性比较
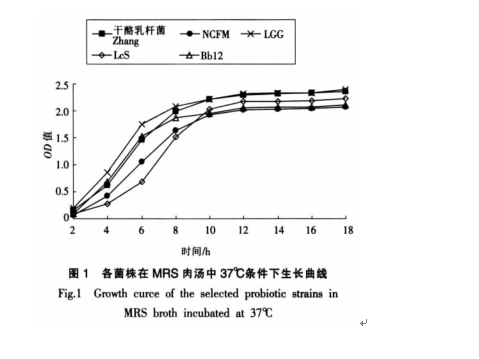
如图1所示,各菌株在MRS液体培养基中生长变化曲线基本相同,即12 h前为对数生长期, 12 h 后开始进入生长稳定期,一直持续至18 h。以下试验以此生长曲线为依据,取各菌株在 MRS 液体培养基中培养16 h 的菌体作为供试菌。
2.1.2
各菌株对胆盐的耐受性比较各菌株对胆盐的耐受性如表 1 所示。在不含牛胆盐的 MRS-巯基乙酸钠液体中,干酪乳杆菌 Zhang、NCFM、LGG、LcS 和 Bb12 的吸光值(OD620nm)增加 0.3 个单位所需时间分别为 4.28、3.79、5.80、4.48 和 3.20h。在含有 0.3%牛胆盐的 MRS-巯基乙酸钠液体培养基中,干酪乳杆菌 Zhang、NCFM、LGG、LcS 和Bb12 的吸光值(OD620nm)增加 0.3 个单位所需时间分别为5.00、4.74、6.90、5.19 和 4.04 h。
各菌株在添加和不添加3.0 g/L 牛胆盐的MRS-巯基乙酸钠液体中,干酪乳杆菌 Zhang 与LcS、NCFM 生长情况没有显著差别(p>0.05),干酪乳杆菌 Zhang 较 LGG 生长快,而较 Bb12 生长慢(p<0.05< span="">)。干酪乳杆菌 Zhang 的生长延迟时间(LT)与Bb12 和 LcS 没有显著差异(p>0.05),而显著少于NCFM 和 LGG(p<0.05< span="">)。本试验结果表明,各菌株对 3.0 g/L 牛胆盐的耐受性为:LcS>干酪乳杆菌Zhang>Bb12 >NCFM>LGG。
对于活细胞来说,胆盐能破坏细胞膜[21],因此对胆盐的耐受性是评价益生菌的重要指标之一[22]。乳酸菌中有一些菌株可产生胆盐水解酶,此酶可将甘氨酸和牛磺酸结合的胆盐催化水解为氨基酸残基和游离胆盐。具有胆汁盐解离能力的乳酸菌可以降低高胆固醇人群的血清胆固醇水平和防止正常人高胆固醇血症的发生,因此人们对这方面的研究越来越感兴趣[23]。消化道中胆盐的浓度不是固定不变的,在进食消化的开始1 h,其质量浓度为 15~20 g/L,之后其质量浓度降为3 g/L左右[24]。乳酸菌在通过胃肠过程中,可以在正常的胆盐浓度下存活[25],然而,不同菌株对胆盐的耐受能力与菌株自身的特性和胆盐浓度有关。本试验结果印证了这一点。
2.1.3
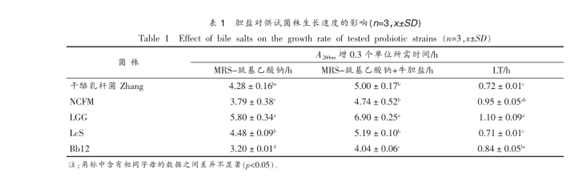
各菌株对低 pH 环境及人工胃液耐受能力的比较各菌株在 pH 值 2.5、3.0、4.0 的 PBS 溶液及人工胃液中 37 ℃消化 3 h 后,其存活率如图
2、图 3 所示。
pH 2.5 的 PBS 及人工胃液消化 3 h 后,干酪乳杆菌 Zhang 的存活率分别为 69.03%和 69.40%,与 NCFM、LGG、LcS 和 Bb12 差异性均显著(p<0.05< span="">),其中分别低于 NCFM 74.77%和 80.53%,分别高于 LGG 58.20%和 59.10%,分别高于 LcS 54.20%和 56.30%,分别高于 Bb12 43.33%和 46.40%。pH 3.0 的 PBS 保持 3 h 后,干酪乳杆菌 Zhang的存活率为 95.77%,与 LGG 差异不显著,与NCFM、LcS 和 Bb12 差异性均显著(p<0.05< span="">),其中高于 NCFM 0.47%,高于 Bb12 0.90%,低于 LcS 3.00%。在 pH 3.0 的人工胃液消化 3 h 后,干酪乳杆菌 Zhang 的存活率为 98.43%,其与 NCFM 和LGG 差异性不显著(p>0.05),高于 LcS 4.00%,高于 Bb12 2.16%,且差异性均显著(p<0.05< span="">)。
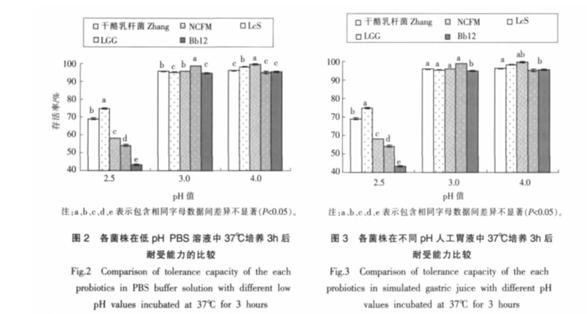
pH 4.0 时,干酪乳杆菌 Zhang 在 PBS 中存活率为96.20%,与 LGG 和 NCFM 差异性显著(p<0.05< span="">),其中低于 LGG 99.63%,低于 NCFM 98.33%,与 LcS(95.20%)和 Bb12(95.47%)差异性不显著(p>0.05)。 pH 4.0 的人工胃液消化 3 h 后,干酪乳杆菌 Zhang 的存活率为 101.40%,其高于 Bb12 3.20%,且差异性显著(p<0.05< span="">),与其它试验菌株差异性均不显著(p>0.05)。
与 pH 2.5 的 PBS 和人工胃液相比,所有供试菌株在 pH 3.0 和 pH 4.0 的 PBS 及人工胃液中均有很好的耐受性,保温 3 h 后,各菌株的存活率范围分别为 94.87%~99.63%和 94.43~101.4%。在pH 2.5 的 PBS 及人工胃液中保温 3 h 后,各菌株的存活率显著降低,存活率范围分别为 43.33%~74.77%和 46.40%~80.53%。 5 株益生菌中,NCFM对 pH 2.5 的人工胃液的耐受性最好,Bb12 是对酸最敏感的菌株,干酪乳杆菌 Zhang 对 pH 3.0 和 pH4.0 人工胃液的耐受性与 NCFM、LGG 和 LcS 的差异不明显(p>0.05)。
Jacobsen 等人对 44 株乳酸菌的研究表明,没有1株菌能在 pH 2.5 的 PBS 中生存[26]。 Charteris 等人指出干酪乳杆菌212.3和 LGG 在 pH 2.5 环境中 3 h,几乎完全失去活力[4],而 Goldin 等人指出LGG 可在 pH 3.0 环境中存活[27]。 Petros 研究表明,29 株乳杆菌在 pH 2.0 的含胃蛋白的溶液中保持1 h后,只有干酪乳杆菌 Shirota ACA-DC 6002 存活性最高,但 3 h 后便无存活菌株[28]。 Conway 等研究显示,NCFM 在 pH 3.0 的缓冲盐中保持 3 h 后,其活菌数降低约4个对数单位[29]。本文研究的干酪乳杆菌 Zhang 对 pH 2.5 的人工胃液的耐受性优于参照的商业益生菌 LGG、LcS 和 Bb12。
在食品贮藏期间和胃肠转运过程中,益生菌菌株能够耐受低 pH 值非常重要。本试验中的 5株益生菌菌株对低pH值有很好的耐受性。值得注意的是,这 5 株益生菌菌株在人工胃液中的存活率均高于同一pH值下PBS中的存活率,这可能是胃蛋白酶对菌体具有保护作用[30]的缘故。
Campos 和 Sancho 研究表明,胃酶抑制素A是一种胃蛋白酶抑制剂,其在不同 pH 值条件下的结构不同,低 pH 值条件对菌体的保护作用好于高pH 值条件[31]。
对酸的耐受性也是评价益生菌的重要指标之一。Petros 等人[28]对 29 株乳酸菌进行体外耐酸性评价,结果显示,供试菌株对人工胃液的耐受性差异明显。乳酸菌的种类及同种间的菌株差异决定了其对酸性环境耐受的差异,其中双歧杆菌对低pH 值环境最敏感[32],这与本试验结果一致。
2.1.4
各菌株在人工肠液中耐受能力的比较各18第 9 卷第5 期菌株在 pH3.0 人工胃液中 37 ℃保持 3 h,然后转入pH 8.0 的人工肠液中保持 8 h,其存活率如图4 所示。
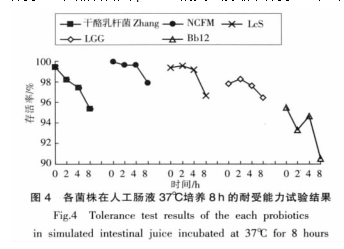
5 株益生菌菌株中,NCFM 在人工肠液中的耐受性最高,2、4 和 8 h 后,其存活率分别为 99.63%、99.63%、97.90%;而 Bb12 耐受性最低,其 2、4 和 8h 后存活率分别为 93.27%、94.63%、90.53%。 5 株益生菌菌株在人工肠液中培养4h 后,NCFM(99.63%)
和 LGG(99.17%)之间,干酪乳杆菌 Zhang(97.43%)和LcS (97.63%)之间的存活率没有显著差异(p>0.05)。本人工肠液中 8 h 后,干酪乳杆菌 Zhang的存活率为 95.37%,与 LGG(96.63%)和 LcS(96.47%)差异不显著(p>0.05),高于 Bb12(90.53%)。
2.2
脱脂乳中各菌株的发酵特性及贮藏稳定性
2.2.1 各菌株发酵及贮藏过程中产酸能力的变化各菌株在 37 ℃发酵及 4 ℃贮藏过程中 pH 值和滴定酸度的变化见图 5。
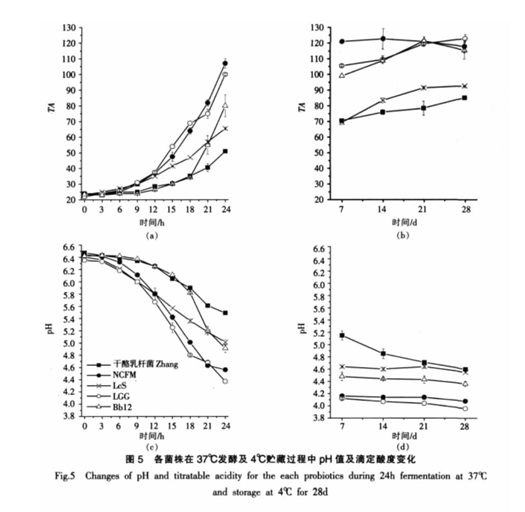
37 ℃、24 h 发酵过程中,各益生菌菌株发酵乳的 pH 值逐渐降低,滴定酸度逐渐升高,其中 LcS生长最快,发酵结束时 pH 4.37。发酵结束及贮藏28d 后,NCFM、LcS 和 Bb12 发酵乳的 pH 值低于干酪乳杆菌Zhang 发酵乳,但滴定酸度高于干酪乳杆菌 Zhang 发酵乳(p<0.05< span="">)。发酵结束后,干酪乳杆菌 Zhang 发酵乳在所有样品中具有较高的pH 值(5.59)和较低的滴定酸度(51°T)。贮藏 28 d期间,干酪乳杆菌 Zhang 发酵乳 pH 值继续下降(28 d 后 pH 值为 4.60),滴定酸度持续上升(28 d后滴定酸度为 92.80 °T),而其它菌株发酵乳的 pH值及滴定酸度变化缓慢。说明干酪乳杆菌 Zhang贮藏期间仍继续生长,活菌数继续增加,而其它参照益生菌的生长缓慢。
牛乳中不同的益生菌菌株的生长特性不同。Saxelin 指出副干酪乳杆菌 F19 在牛乳中产酸较慢,pH 值达 4.5 时所需发酵时间超过 20 h[33]。Dave和 Shah 指出,在牛乳中添加酪蛋白水解物(CH)会极大地促进益生菌的生长[34],其原因可能是水解的非蛋白氮能刺激蛋白水解能力弱的菌株生长[35]。乳酸菌在乳中保持高活力的原因之一是其自身的蛋白水解能力高[36]。本试验中对干酪乳杆菌 Zhang 与参照益生菌(NCFM、LGG、LcS 和Bb12)发酵的脱脂乳贮藏 28d 中游离氨基氮含量进行测定(数据没有显示)。结果表明,随贮藏时间的延长,添加干酪乳杆菌 Zhang、LGG 和 NCFM 的发酵乳样品的游离氨基氮含量逐渐增加,而添加LcS 和 Bb12 的发酵乳样品中的游离氨基氮含量逐渐减少。干酪乳杆菌 Zhang 发酵乳样品中游离氨基氮含量增加幅度较大,这也是干酪乳杆菌Zhang 贮藏期间仍在继续生长的原因之一。
2.2.2
各菌株贮藏期间活菌数的变化
各菌株在4 ℃、28 d 贮藏期间活菌数的变化如图6 所示。4 ℃贮藏 28 d 期间,各益生菌发酵乳中活菌数都有不同程度地上升。28 d 后,干酪乳杆菌Zhang、NCFM、LGG、LcS 和 Bb12 的活菌数(lgcfu/g)分别为 9.00、8.70、8.83、8.95、8.92。干酪乳杆菌Zhang 活菌数(lgcfu/g)的增加(0.21)与 LcS(0.23)差异不显著(p>0.05),但显著高于 NCFM (0.07)、LGG(0.11)、Bb12(0.12)(p<0.05< span="">)。而各菌株发酵乳贮藏期间 pH 值降低分别为 0.55、0.08、0.09、0.16、0.12,这与各菌株活菌数变化基本一致。28 d贮藏结束后,发酵乳中干酪乳杆菌 Zhang 活菌数显著高于其它 4 株益生菌(p<0.05< span="">),说明该菌贮藏过程中稳定性非常好。
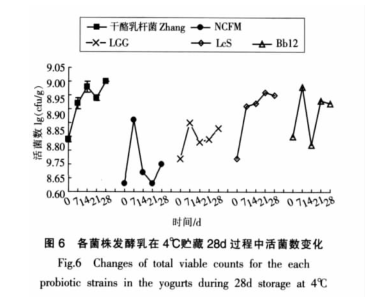
Kailasapathy 研究表明,嗜酸乳杆菌 DD910和乳双歧杆菌 DD920 的发酵乳贮藏 7 周后,其活菌数分别下降约4个和 3 个对数单位[37]。另一些研究结果表明某些益生菌菌株在发酵乳贮藏期间活菌数下降[38-41],其原因之一是β-葡萄糖苷酶在0~5 ℃条件下仍具有活性,导致发酵乳中氢离子浓度高于乳酸根离子浓度,pH 值降低,乳清分离,从而影响益生菌的存活[42]。而本试验中干酪乳杆菌Zhang 贮藏期间活菌数仍在显著上升,这可能与其蛋白水解能力高有关,还可能与其发酵乳贮藏初始 pH 值较高有关。
益生菌若要发挥益生效果,必须在肠道存活且其含菌食品的活菌数必须在 106cfu/g 以上[43]。贮藏 28 d 后,发酵乳中干酪乳杆菌 Zhang 活菌数远远高于 106cfu/g。对于研究人员来说,开发货架期内具有较高活菌数量的益生菌食品非常困难。
因此,对贮藏期间益生菌的稳定性要求很高,干酪乳杆菌 Zhang 发酵乳中存在较高的活菌数并具极佳的稳定性,为其益生菌制品的开发提供了保障。
3结论
将分离自内蒙古地区传统酸马奶中的 1 株益生菌干酪乳杆菌 Zhang 与国际知名的 4 种益生菌(NCFM、LGG、LcS 和 Bb12)进行比较,结果表明:
1)干酪乳杆菌 Zhang 对 pH 2.5 人工胃液消化 3 h的耐受性低于 NCFM,高于其它 3 株对照益生菌;与 4 株对照菌一样,对 pH 3.0 和 4.0 人工胃液有很好的耐受性。对 pH 8.0 的人工肠液消化 8 h 的耐受性低于 NCFM,高于 Bb12,与其它 2 株对照菌没有差别。其对 3.0g/L 牛胆盐的耐受性:LcS>干酪乳杆菌 Zhang > Bb12 > NCFM > LGG。虽然其对 pH 2.5 人工胃液和 pH 8.0 人工肠液的耐受性低于NCFM,但是其存活率仍然在 60%和 95%以上,显示出干酪乳杆菌 Zhang 对胃肠转运有很好的耐受性。 2)在脱脂乳中发酵 24 h,接种干酪乳杆菌Zhang 样品的酸度低于 4 株对照菌;4 ℃贮藏 28d,其样品 pH 值比 4 株对照菌降得快,其活菌数在 28 d 后达 1.0×109cfu/g,高于 4 株对照菌,显示出良好的贮藏稳定性。
参考文献
[1] Guarmer F., Schaafsma G. J. Probiotics[J]. International Journal of FoodMicrobiology, 1998, 39 (3):237-238.
[2] Piano M. D.,Morelli L., Strozzi G. P., et al. Probiotics: from research to consumer [J]. Digestive and Liver Disease, 2006,38(Suppl. 2):S248-S255.
[3] Bezkorovainy A. Probiotics: determinants ofsurvival and growth in the gut [J]. American Journal of Clinical Nutrition, 2001,73(2):399S-405S.
[4] Carteris W. P., Kelly P. M., Morelli L., et al. Development andapplication of an in vitro methodology todetermine the transit tolerance of potentially probiotics Lactobacilli andBifidobacterium species in the upper human gastrointesti-nal tract[J]. Journalof Applied Microbiology, 1998,84(5):759-768.
[5] Salminen S., Laine M., von Wright, et al. Development of selection criteria for probiotic strains toassess their po-tential in functional foods: a Nordic andEuropean approach[J]. Bioscience. Microflora,1996b, 15 (2):61-67.
[6] Samona A., Robinson R. K. Enumeration of bifidobacteria in dairy products[J].International Journal of Dairy Technol-ogy, 1991,44 (3):64-66.
[7] Vinderola C. G., Bailo N., Reinheimer J. A. Survival of probiotic microflora in Argentineanyoghurts during refriger-ated storage[J]. Food Research International, 2000, 33 (2): 97-102.
[8] Sanders M. E., Walker D. C., Walker K. M. Performance of commercial cultures in fluid milkapplication[J]. Journal of Dairy Science, 1996,79 (6): 943-955.
[9] Gregor Reid. The scientific basis for probiotic strains ofLactobacillus [J]. Applied and Environmental Microbiology, 1999,65 (9):3763-3766.
[10] Gilliland S. E., Speck M. L., Morgan C. G. Detection of L. acidophilus in feces of humans, pigs andchickens[J]. Journal of Applied Microbiology,1975,30 (4):541-545.
[11] 云月英,王立平,张和平,等. 喂饲 Lactobacillus casei Zhang 对大鼠体内脂质代谢的影响[J]. 微生物学通报,2006,33(3):60-64.
[12] 张和平,孟和毕力格,王俊国,等. 分离自内蒙古传统发酵酸马奶中 L. casei Zhang 潜在益生特性的研究[J]. 中国乳品工业,2006,34(4):4-10.
[13] 乌日娜,张和平,孟和毕力格. 酸马奶中乳杆菌 Lb.casei Zhang 和 ZL12-1 的 16S rDNA 的基因序列及聚类分析[J].中国乳品工业,2005, 33(6):4-9.
[14] 托娅,苏雅勒玛,张和平. 乳杆菌 Lb. casei Zhang 对小鼠血清中细胞因子水平的影响[J].食品科学,2006,27(11):488-491.
[15] M “att”o J., Malinen E., Suihko M-L, et al. Genetic heterogeneity and functional properties ofintestinal bifidobac-teria[J]. Journal of Applied Microbiology,2004,97 (3):459-470.
[16] Jaya Prasad, Harsharanjit Gill, John Smart, et al. Selection and characterisation of Lactobacillus andBifidobacteri-um strains for use as probiotics[J]. Dairy Journal, 1998, 8 (12): 993-1002.
[17] Lefteris Makras, Vagelis Triantafyllou, Domitille Fayol-Messaoudi, et al. Kineticanalysis of the antibacterial activity of probiotic lactobacilli towardsSalmonella enterica serovar Typhimurium reveals a role for lactic acid andother in-hibitory compounds[J]. Research in Microbiology, 2006, 157 (3):241-247.
[18] Sumangala Gokavi, Lanwei Zhang, Ming-kuei Huang, et al. Oat-based symbiotic beverage fermented by Lactobacil-lusplantarum, Lactobacillus paracasei ssp.casei and Lactobacillus acidophilus[J]. Journal of Food Science, 2005,70(4):216-223.
[19] Tuomola E.M.,Ouwehand A. C., Salminen S. J. The effect of probiotic bacteria on the adhesion ofpathogens to hu-man intestinal mucus[J]. FEMS Immunology and MedicalMicrobiology,1999, 138 (26):137-142.
[20] Usman A, Hosono. Bile tolerance, taurocholatedeconjugation, and binding of cholesterol by Lactobacillus gasseri Strains[J].Journal of Dairy Science, 1999, 82 (2):243-248.
[21] Luis Noriega, Isabel Cuevas, Abelardo Margolles,et al. Deconjugation and bile salts hydrolase activity by Bifidobac-teriumstrains with acquired resistance to bile[J]. International Dairy Journal, 2006, 16 (8):850-855.
[22] Succi M., Tremonte P., Reale A., et al. Bile salt and acid tolerance of Lactobacillus rhamnosusstrains isolated from Parmigiano Reggiano cheese[J].FEMS Microbiology Letters,2005,244 (1): 129-137.
[23] Liong M.T., Shah N.P. Bile salt deconjugation and BSH activity of fivebifidobacterial strains and their cholesterol co-precipitating properties[J].Food Research International, 2005, 38 (2): 135-142.
[24] Noriega L., Gueimonde M., Sánchez B., et al. Effect of the adaptation to high bile salts concentrationson glyco-sidic activity, survival at low pH and cross-resistance to bile salts inBifidobacterium [J]. International Journal of Food Microbiology, 2004, 94 (1): 79-86.
[25] Sanders M. E., Walker D. C., Walker K. M. Performance of commercial cultures in fluid milkapplication[J]. Journal of Dairy Science, 1996, 79 (6): 943-955.
[26] Jacobsen C. N., Rosenfeldt N. V., Hayford A. E., et al. Screening of probiotic activities of forty seven strains of Lactobacillusspp. by in vitro techniques and evaluation of colonization ability of fiveselected strains in human[J]. Applied and Environmental Microbiol, 1999, 65 (11): 4949-4956.
[27] Goldin B. R., Gorbach S. L., Saxelin M., et al. Survival of Lactobacillus species(strain GG) in human gastrointestinaltract[J]. Digestive Diseases Science, 1992, 37 (1): 121-128.
[28] Petros A. Maragkoudakis, GeorgiaZoumpopoulou, Christos Miaris, et al. Probiotic potential of Lactobacillus strains isolated fromdairy products[J]. International Dairy Journal, 2006,16 (3): 189-199.
[29] Conway P. L., Gorbach S. L., Goldin B. R. Survival of lactic acid bacteria in the human stomachand adhesion to intestinal cells[J]. Journal of Dairy Science, 1987, 70 (1): 1-12.
[30] Matto J., Alakomi H. L., Vaari A., Virkajarvi I., Saarela M. Influence of processing conditions on Bifidobacterium animalissubsp. lactis functionality with a special focus on acid tolerance and factorsaffecting it [J]. International Dairy Journal, 2006,16 (9):1029-1037.
[31] Campos L.A., Sancho J. The active site of pepsin is formed in the intermediateconformation dominant at mildly acidic pH[J]. FEBS Letters, 2003,538 (1):89-95.
[32] Yolanda Sanz. Ecological and functional implications of theacid-adaptation ability of Bifidobacterium: A way of se-lectingimproved probiotic strains[J]. International Dairy Journal, 2007,17 (11):1284-1289.
[33] Saxelin M., Grenov B., Svensson U., et al. The technology of probiotics [J]. Trends in Food Science andTechnolo-gy,1999,10 (12):387-392.
[34] Dave R. I.,Shah N. P. Ingredient supplementation effectson viability ofprobiotic bacteria in yogurt [J]. Journal of Dairy Science, 1998, 81 (11):2804-2816.
[35] Shihata A., Shah N. P. Proteolytic profiles of yogurt and probiotic bacteria[J]. International Dairy Journal, 2000,10(5/6):401-408.
[36] Donkor O. N., Henriksson A., Singh T. K., et al. ACE-inhibitory activity of probiotic yoghurt[J].International DairyJournal, 2007, 17(11):1321-1331.
[37] Kailasapathy K. Survival of free and encapsulated probioticbacteria and their effect on the sensory properties of yo-ghurt[J]. FoodScience Technology, 2006, 39 (10):1221-1227.
[38] Shah N.P. Probiotic bacteria: Selectiveenumeration and survival in dairy foods [J]. Journal of Dairy Science, 2000, 83 (4):894-907.
[39] Dave R.I., Shah N. P. Viability of yogurt and probiotic bcteria in yoghurtsmade from commercial starter cultures[J]. International Dairy Journal, 1997,7 (1): 31-41.
[40] Kailasapathy K., Rybka S. Lactobacillus acidophilus and Bifidobacterium spp.: Theirtherapeutic potential and sur-vival in yogurt[J]. The Australian Journal ofDairy Technology, 1997,52 (1): 28-35.
[41] Lourens-Hattingh A., Viljoen B. C.Review: Yoghurt as probiotic carrier food [J]. International Dairy Journal, 2001, 11(1/2): 1-17.
[42] Rasic J. L., Kurman J. A. Yoghurt-scientific grounds, technology, manufactureand preparations [M]. Copenhagen:Technical Dairy Publishing House,1978.
[43] Samona A., Robinson R. K. Effect of yogurt cultures on the survival ofbifidobacteria in fermented milks [J]. Journal of the Society of DairyTechnology, 1994, 47 (2): 58-60.
 妇产科在线APP下载
妇产科在线APP下载










 京公网安备 11010202008857号
京公网安备 11010202008857号