粘膜免疫系统是机体免疫系统的重要组成部分,其主要功能是作为机体的防御屏障,清除和排斥外源分子,保护机体免受损害,是机体抗感染的第一道防线。近年来,粘膜免疫日益受到人们的重视。它主要由单个或多个淋巴滤泡聚集成滤泡结节, 如Payer’s patches ( PP)节、盲肠扁桃体以及大量外分泌腺构成粘膜相关性淋巴组织(MALT) 。在肠道粘膜免疫系统中,派伊尔氏结和粘膜相关的淋巴细胞等粘膜相关淋巴组织直接参与了肠道抗原的识别、呈递和免疫效应,它们的功能和状态直接反映了肠道粘膜免疫系统的功能
和状态[1] 。
益生菌包括乳酸杆菌、双歧杆菌等,能调节肠粘膜屏障功能,有些益生菌能调节肠道粘膜免疫反应,有些能抑制肠道致病菌对肠上皮细胞的粘附,从而保护肠道免受致病菌损伤[2,3]。乳酸杆菌和双歧杆菌的代谢物和整个细胞等抗原物质能通过M细胞进入PP,激活Th2细胞,产生大量的IL-5,而IL-5是有效的IgA产生因子,能激活PP生发中心的B细胞,使其化为浆细胞,在生产Ig的过程中向IgA转化。肠粘膜上皮细胞还能产生分泌小体,与双体Ig分子结合,形成sIgA并排列在肠道内皮上, sIgA能预防肠道蛋白酶的分解,形成粘膜上
的抗体。由于益生菌一般含有其他菌的共同抗原,因此sIgA能与肠道内细菌和病毒进行免疫反应,阻断这些菌和病毒在肠道上皮的黏附和穿透,中和毒素,缓解腹泻、胃炎、过敏性皮炎等症状[4]。
本研究应用分离自内蒙古传统酸马奶,并经过耐酸性实验、人工胃肠消化液中存活能力实验筛选的具有潜在益生特性的干酪乳杆菌Zhang[5],前期大量实验研究表明该菌株具有显著的降血脂、免疫调节作用[6-8] 。将干酪乳杆菌Zhang 以活菌制剂的形式分高、中、低三个剂量灌服小鼠11 d 后,对小鼠局部肠粘膜免疫组织派伊尔氏结进行计数计分,采用免疫组化法检测小肠粘膜CD3+、IgA+细胞数量,并通过图像分析软件分析其阳性信号平均光密度值,以了解其表达情况,观察干酪乳杆菌Zhang 对小鼠肠粘膜免疫功能的影响,为传统乳制品益生菌的开发应用及进一步阐明其益生作用机理提供参考依据。
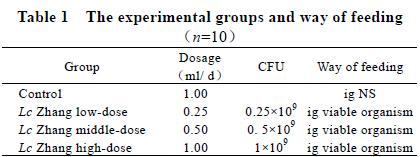
1 材 料 与 方 法
1.1 材料
1.1.1 实验菌株 干酪乳杆菌Zhang(Lactobacillus
casei Zhang,LcZhang),由内蒙古农业大学乳品生物技术与工程教育部重点实验室提供。
1.1.2 实验动物 清洁级昆明小40 只鼠,雌雄各半,
平均体重为(20±2)g,购自内蒙古大学实验动物研究中心。
1.1.3 主要试剂:羊抗鼠Ig A(α)抗体(SouthernBiotech),
纯化的抗鼠CD3+抗体(Biolegend),即用型SABC 免疫组织化学染色试剂盒(武汉博士德生物工程公司),DAB 酶底物显色试剂盒(美国MBI 公司),APES 粘片剂(博士德生物公司)。
1.2 方法
1.2.1 菌株的活化与菌悬液的制备:将冷冻干燥保存的干酪乳杆菌Zhang(Lc Zhang)接种于TPY培养液,37º 培养18h,3000 g、10 min 离心收集菌体,用灭菌0.01 mol/L、pH 7.4 的PBS 离心洗涤后分散于0.01 mol/L、pH 7.4 的PBS 中并调整其菌数为1.0×109cfu/ml(BC琼脂培养基培养活菌计数确认),按每日用量分装,液氮速冻后置-80℃保存备用。
1.2.2 实验动物处理:小鼠购进后适应性喂养4 d后,随机分成4 组(每组10 只),即Lc Zhang
高、中、低剂量组和对照组。具体剂量见表1。11d 后断颈处死。饲养期间,自由采食和饮水,控制动物房温度为(20±2)℃,湿度为50%~60%。
1.2.3 小鼠肠道派伊尔氏结观察,小肠粘膜CD3+、IgA+细胞免疫组化检测 将处死小鼠置于冰上,立即小心取出全小肠, 在Motic 视镜下计数并测量PP 的直径, (计分规则:每个PP 尺寸大于0.5 mm者计1 分,小于者计0.5 分)。分别取十二指肠(幽门后2~3 cm 处)、空肠中段和回肠(离回盲口3cm处)段肠管2~3 cm,迅速用新配置的生理盐水洗去肠内容物后,放入40 g/L 多聚甲醛磷酸盐缓冲液(pH 7.4)中固定。按常规方法脱水、透明、石蜡包埋,连续横断切片,切片厚5 μm。每隔10 张切片取1 张,进行免疫组化染色(SABC 法)观察
肠粘膜内CD3+和IgA+细胞的数量和表达强度。每份标本的三段肠管的切片各随机选取两张,在400 倍视野下选取5 个视野先进行阳性细胞计数并以计算机图像分析系统对所选视野进行图像采集,用Motic Image Advaneed3.0 图像分析软件检测其阳性信号平均光密度值以反映CD3+和IgA表达的强弱,光密度值越高,CD3+和IgA 的表达就越强。分别与对照组进行比较。
1.2.4 实验数据分析与统计:所有实验数据以x ±s 表示,应用SPSS 11.5 统计软件对测量数据进行Independent-Samples T Test 分析。检验水准α=0.05。
2 结 果 与 分 析
2.1 小鼠小肠派伊尔氏结的计数、计分(图1)
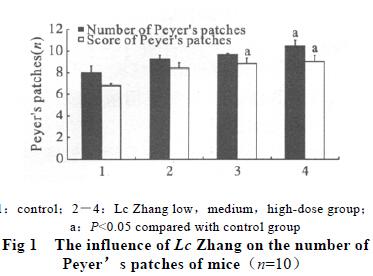
小鼠灌服LcZhang 11 d 后派伊尔氏结数量与对照组(8.0±1.6 个)比,高剂量组达10.4±1.6个(P<0.05),中、低剂量组分别为9.7±1.4个和9.3±1.1 个; 派伊尔氏结计分值与对照组(6.8±1.6)比较,高剂量组达9.0±2.0(P<
0.05),中、低剂量组分别为8.9±1.5(P<0.05)
和8.4±2.5。
2.2 小鼠小肠粘膜CD3+、IgA+细胞数及表达强度(表2,图2)
选取代表肠道粘膜屏障核心的上皮内淋巴细胞(IEL)和固有层浆细胞,分别用CD3+和IgA
阳性细胞为代表,反映肠道T 细胞和浆细胞的免疫状况。免疫组化染色结果表明,CD3+和IgA 阳性染色特异性较好,在胞浆和胞膜上均有明显表达。上皮内淋巴细胞中90%为CD3+ T 细胞,主要分布于小肠粘膜绒毛上皮细胞之间;IgA+浆细胞主要位于小肠粘膜上皮层之下的固有层中。
Table 2 Positive CD3+, IgA+ cells of each group and the comparisons of image-analyzed mean optical density values
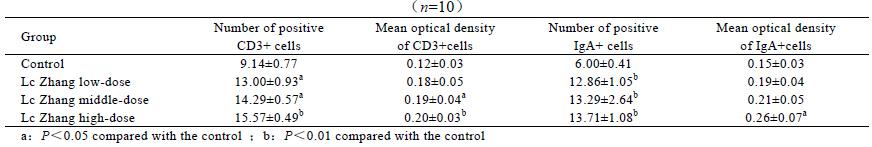
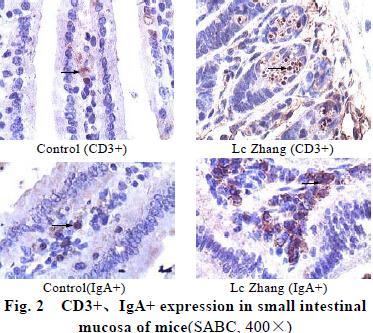
小肠免疫组化染色结果见图2。结果显示,CD3+阳性细胞主要分布于小肠粘膜绒毛上皮细胞之间位于上皮基底部;IgA+阳性细胞主要分布于粘膜固有层中,阳性颗粒定位于细胞的胞膜和胞浆内,呈棕黄色。小肠粘膜CD3+、IgA+细胞计数及图象分析平均光密度值结果见表2。
以上结果可知,Lc Zhang 高中低三个剂量组
小鼠的十二指肠、空肠和回肠三处的CD3+ 和IgA阳性细胞平均数与对照组相比显著增多;CD3+ 阳性信号平均光密度值Lc Zhang 高剂量组0.20±0.03,与对照组0.12±0.03 相比显著增高(P<0.01),中剂量组也达0.19±0.04(P<0.05);IgA 阳性信号平均光密度值Lc Zhang 高剂量组0.26±0.07,与对照组0.15±0.03 相比显著增高(P<0.05)。
3 讨 论
人和动物机体内都存在着粘膜免疫系统,粘膜免疫系统在抵抗感染方面起着极其重要的作用。粘膜表面与外界抗原直接接触,是机体抗感染的第一道防线[9]。粘膜免疫已经成为新的免疫研究热点,这是因为机体95%以上的感染发生在粘膜或由粘膜入侵机体。另外,粘膜既存在局部免疫,又存在共同粘膜免疫系统(common mucosalimmune system, CMIS)。动物的先天性或非特异性免疫应答,亦即机体免疫系统识别和排除各种异物,主要依靠机体粘膜的屏障作用。益生菌的细胞壁成分、代谢产物、菌体细胞等均可能刺激动物的肠道黏膜免疫系统[10]。益生菌可作为非特异的免疫调节因子,通过细菌本身或细胞壁成分刺激宿主免疫细胞,使其激活,产生促分裂因子,促进吞噬细胞活力或作为佐剂发挥作用。同时益生菌还可发挥特异性免疫功能,增强B 细胞产生抗体的能力。并可促进机体的免疫器官、组织的成熟,使这些器官、组织处于高度反应准备状态,使T 和B 淋巴细胞数量增多,并诱导其产生细因子,特别是腹腔巨嗜细胞所产生的IL-1,IL-6,IL-12 等[11]。
在肠道粘膜免疫系统中,派伊尔氏结、粘膜相关的淋巴细胞(包括上皮间淋巴细胞和固有层淋巴细胞)直接参与了肠道抗原的识别、呈递和免疫效应,它们的功能和状态直接反映了肠道粘膜免疫系统的功能和状态。派伊尔氏结大小间接反映了派伊尔氏结内T 淋巴细胞、B 淋巴细胞和浆细胞的数量和大小。Pollard[12]等人在动物实验中观察到,无菌动物的肠壁集合淋巴结很小,肠内有正常菌群定植后,肠壁集合淋巴结可以明显增大。胎儿出生后,肠壁集合淋巴结的大小和数目激增,从妊娠24 w时约50个,到成年时增至约250 个,说明环境中的抗原如微生物的刺激,可促进它的发育。MatsunagaK 等曾采用派伊尔氏结的数目为指标来研究云芝多糖(polysaccharideKrestin,PSK)的功能,而Nakasaki 等也发现全肠外营养时会引起派伊尔氏结数量的减少,而口服PSK 可改善这种情况[1]。
本研究结果表明,灌服Lc Zhang 活菌液11d后派伊尔氏结数量及大小都有所增加。本文用CD3+和IgA+细胞分别反映小肠粘膜上皮内淋巴细胞(IEL)和浆细胞的情况,特异性染色表明小鼠灌服Lc Zhang 后小肠粘膜T 细胞、浆细胞数量增加,免疫功能有所增强。而T 细胞和B 细胞对于维持肠粘膜的完整性、顺利发挥其屏障功能具重要意义。这提示Lc Zhang 对小鼠肠粘膜免疫功能具有显著的促进作用。为今后开发和利用传统发酵乳制品中有益菌株提供了实验依据,也为今后含益生菌产品的研究和开发提供了参考依据。
[参 考 文 献]
[1] Nakasaki H, Tajima T, Mitomi T, et al. Countermeasuresfor hypofunction of gut associated
lymphoid tissue during TPN in rats[J]. NipponShokakibyo. Gakkai-Zasshi, 1996;93:806-812
[2] Lammers KM, Brigidi P, Vitali B, et al. Immunomodulatoryeffects of probiotic bacteria DNA:
IL-1 and IL-10 response in human peripheralblood mononuclear cells[J]. FEMS Immunol Med
Microbiol, 2003,38:165-172.[3] Tejada Simon MV, Pestka JJ. Proinfammatorycytokine and nitric oxide induction in murinemacrophages by cell wall and cytoplasmicextracts of lactic acid bacteria [J].Food Prot,1999,62:1435-1444.[4] Famularo G, Moretti S, Marcellin I, et al.Stimulation of Immunity by Probiotics[M].London: Chapman and Hill, 1997.133-161.[5] 孟和毕力格,乌日娜,王立平,等.不同地区酸马奶中乳杆菌的分离及其生物学特性的研究[J].中国乳品工业,2004,32:6-11.[6] 张和平, 孟和毕力格,王俊国,等.分离自内蒙古传统发酵酸马奶(Koumiss)中L.casei Zhang 潜在益生特性的研究[J].中国乳品工业, 2006, 34:4-10.[7] 张和平,张七斤,孟和毕力格,等.L.casei zhang
对小鼠T 淋巴细胞亚群及血清IgG 和肠黏膜SIgA 的影响[J].中国乳品工业,2006,34:4-8.[8] 托娅,张和平. 一株分离自内蒙古传统酸马奶中的乳酸杆菌Lactobacillus casei.Zhang 对小鼠免疫功能的影响[J]. 中外医疗,2008,27:39-42.[9] Sartor RB.Therapeutic manipulation of the entericmicroflora in inflammatory bowel diseases;antibiotics,probiotics,and prebiotics[J].
Gastroenterol,2004,126:1620-1633.[10] Garriga M,Pascual M.Selection of lactobacillifor chicken probiotic adjuncts[J]. J ApplMicrobiol, 1998, 84(1):125-132.
[11] 王立生,潘令嘉,施理,等.双岐杆菌对裸鼠腹腔巨嗜细胞产生IL-1、IL-6、IL-12 的影响[J]. 中华微生物学和免疫学杂志,1998,18:373-375.[12] Pollard M, Sharon N. Response of the Peyer’spatches in germ-free mice to antigenicstimulation[J]. Infect Immun, 1970, 2:96-100.
 妇产科在线APP下载
妇产科在线APP下载










 京公网安备 11010202008857号
京公网安备 11010202008857号