妊娠期高血压疾病影响着近10%的孕产妇。随着生育观念和生活方式的改变,慢性高血压合并妊娠人群逐渐增多。高血压对母胎短期及长期影响是众所周知的。包括母体在孕期/围产期发生先兆子痫或子痫、中风、心脏衰竭、肺水肿、急性肾损伤、胎盘早剥和死亡风险,以及胎儿早产、发育不良和围产期死亡风险均明显升高。
成人高血压治疗指南建议起始治疗的血压阈值越来越低,以最大限度地降低长期死亡和并发症风险。对于有可能发生中风等急性并发症风险的严重高血压或合并肾病等共存病的孕产妇,支持高血压治疗的建议已经很明确。
然而,对较为健康的妊娠期轻度高血压进行降压治疗的小型研究并没有显示出明确或持久的益处。这些研究结果造成了决策上的混乱,因为担心积极降压带来的胎盘灌注压降低可能会造成胎儿发育不良或死亡的意外后果。
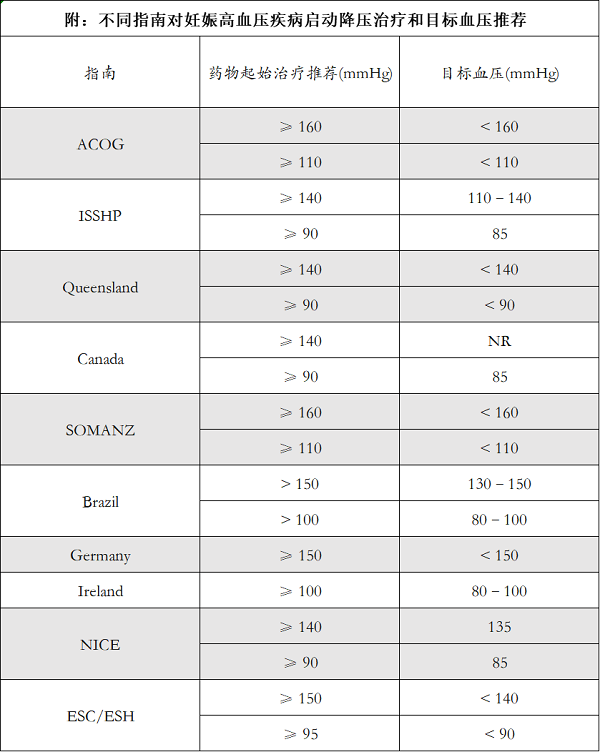
另外基于不同临床试验结论和专家们不同观点,国际上各指南之间对于慢性高血压起始降压阈值也有不同推荐,这在临床工作中造成一定的迷惑和混乱。基于此方面考虑,目前为止国际上完成的两项重大临床试验分别是CHIPS试验和CHAP试验,两项试验结论为解答目前关于该问题提供了重要参考依据,也为将来的指南或共识修订提供了强有力的循证证据。
2015年,发表于NEJM杂志上的妊娠高血压控制研究(CHIPS)中,Magee等比较了987例轻度高血压孕妇 "严格"与 "不严格"的降压控制,发现血压得到严格控制的孕妇并不会带来对胎儿生长的不利影响。然而,该试验并未也没能评估其他潜在的治疗效果。
NEJM于2022年4月2日发表了Tita等在美国61个医疗机构进行的大型多中心、开放标签、随机的慢性高血压和妊娠期(CHAP)试验结果, 以比较在两种不同的血压阈值下对无并发症高血压患者的治疗。参加试验的是轻度高血压孕妇,其定义是收缩压在140~160 mmHg之间,舒张压在90~105 mmHg之间。所有病例均为单胎,孕周均在23周以下。
这些病例按1:1比例随机接受以血压低于140/90 mmHg为目标的降压药物积极治疗,或接受标准(对照)治疗,只有当收缩压超过160 mmHg或舒张压超过105 mmHg(严重高血压)时才开始其他额外降压治疗。降压药物首选是拉贝洛尔或缓释硝苯地平。主要结果是有严重临床表现的子痫前期、医学指征早产(孕期少于35周)、胎盘早剥或围产期死亡。主要的安全结果是小于第10百分位数和小于第5百分位数的小于孕龄儿出生发生率。共筛选了29772例患者,其中大多数不符合条件,要么因为血压太高或太低,或者孕周不合适。
最终,共纳入积极治疗组1208例和对照组1200例患者。两组在人口统计和临床特征方面都很平衡。在入组前,两组中45%的患者正在服用阿司匹林,这一比例在分娩时增加到75%以上。在一些数据中,CHAP试验和CHIPS之间存在一些重要差别。在CHAP试验中,黑人占比47.5%,而CHIPS中只有12.5%,随机分组时的平均胎龄为15.4周,治疗时长为21周,而CHIPS中的平均胎龄为24周,治疗时长为13周。CHAP试验入组时的平均体重指数为37.5 kg/m2,而CHIPS组为31 kg/m2。
● 在CHAP试验中,主要结局发病方面,主动治疗组低于对照组(30.2% vs. 37.0%),调整后的风险比为0.82(95%置信区间,0.74~0.92;P<0.001),主要结局发病方面经过积极治疗风险下降了近20%。主要结局的降低主要因为严重子痫前期发病和孕周<35周医学指征的早产比例下降导致。在小于胎龄儿(SGA)方面两组间没有明显差异。两组间胎盘重量几乎相同,进一步保证了积极治疗的安全性。没有任何证据表明更积极的降压治疗会延缓胎儿生长,这一点也与CHIPS试验结果一致。
● 在目前CHAP试验中,由于对诸多次要结局缺少多重比较的校正调整,因此对次要结局的解释需要慎重。在积极治疗组观察到较低的严重高血压发病率与既往6项临床研究结果一致,包括CHIPS。该积极治疗组孕37周前早产和出生体重小于2500 g新生儿的风险较低,这与孕35周前医学指征早产的发生率降低是一致的,后者是主要结局的一个组成部分。剖宫产比例较高, 但在两组中相似,与CHIPS试验的比例一致。
● CHAP试验中最令人振奋的发现(可能由于大量病例入组)是,积极治疗组中各种子痫前期发生率明显减少,这些发现在以前的8项随机试验中没有观察到,包括CHIPS。对于次要结局分析必须谨慎地看待。然而,如果这些结果在随后研究中得到证实,那么这些结论将成为改变有关妊娠期轻度高血压患者治疗临床实践推荐的重要依据。
参考文献:
1. Martin JA, Hamilton BE, Osterman MJK, Driscoll AK. National vital statistics reports: births: final data for 2019. Atlanta: Centers for Disease Control and Prevention. March 23, 2021 (https://www.cdc.gov/nchs/data/nvsr/nvsr70/nvsr70-02-508.pdf).
2. Whelton PK, Carey RM, Aronow WS, et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the prevention, detection, evaluation,and management of high blood pressure in adults. J Am Coll Cardiol 2018;71(19): e127-e248.
3. AriasF, ZamoraJ. Antihypertensive treatment and pregnancy outcome in patients with mild chronic hypertension. Obstet Gynecol1979;53: 489-94.
4. Sibai BM, Mabie WC, Shamsa F, Villar MA, Anderson GD. A comparison of no medication versus methyldopa or labetalolin chronic hypertension during pregnancy. Am J Obstet Gynecol 1990;162: 960-6.
5. Magee LA, von Dadelszen P, Rey E, et al. Less-tight versus tight control of hypertension in pregnancy. N Engl J Med 2015; 372: 407-17.
6. Tita AT, Szychowski JM, Boggess K, et al. Treatment for mild chronic hypertension during pregnancy. N Engl J Med. DOI: 10.1056/NEJMoa2201295.
7. Webster LM, Conti-Ramsden F, Seed PT, Webb AJ, Nelson Piercy C, Chappe llLC. Impact of antihypertensive treatment on maternal and perinatal outcomes in pregnancy complicated bychronic hypertension: a systematic review and meta-analysis. J Am Heart Assoc 2017;6(5): e005526.
 妇产科在线APP下载
妇产科在线APP下载













