摘要
凝血功能异常,尤其是血液高凝状态——血栓前状态(prethrombotic state,PTS)是导致复发性流产(recurrent spontaneous abortion,RSA)等不良妊娠结局的常见原因。抗凝和/或抗血小板治疗在RSA合并PTS患者的防治方面疗效肯定,但由于缺乏相应的规范,过度检查、过度治疗和超适应证用药等现象普遍存在。为了进一步规范RSA合并PTS的诊治,国家妇幼健康研究会生殖免疫学专业委员会组织国内妇产科学、生殖免疫学、生殖医学、风湿免疫学、血液病学、检验医学以及循证医学专家,根据RSA合并PTS的诊治现状,结合国内外最新的研究证据和进展共同讨论,制定本共识,旨在为临床医师在临床实践中做出合理决策提供参考。
【关键词】复发性流产;凝血功能;血栓前状态;诊治;共识
在我国,目前将连续发生3次或3次以上在妊娠28周之前,胎儿体质量不足1000 g的胎儿丢失定义为复发性流产(recurrent spontaneous abortion,RSA),但专家们同时提出连续发生2次自然流产或生化妊娠即应重视并予评估[1-2]。目前国际上不同国家和地区关于RSA的定义不同。2012年美国生殖医学学会(American Society for Reproductive Medicine,ASRM)的标准是2次或2次以上的妊娠失败,明确排除生化妊娠[3];2011年英国皇家妇产科医师协会(Royal College of Obstetricians and Gynaecologists,RCOG)定义为与同一性伴侣连续发生3次或3次以上妊娠24周前的胎儿丢失[4];2018年欧洲人类生殖与胚胎学会(European Society of Human Reproduction and Embryology,ESHRE) 的定义是2次或2次以上在妊娠24周之前的胎儿丢失,包括生化妊娠[5]。
RSA病因复杂,目前已知的病因包括染色体或基因异常(包括胚胎染色体或基因异常和夫妻双方染色体或基因异常)、女性生殖道解剖结构异常、内分泌异常、母体免疫学异常及血栓前状态(prethrombotic state,PTS)等[6]。近年来的研究显示,约有66%的RSA患者存在至少1项凝血系统的功能异常[7]。患者体内存在凝血、抗凝血功能紊乱或者障碍等可导致血液中抗凝物质数量减少或功能下降,导致血液高凝状态,这种状态称为PTS。系列病例报告表明,PTS与RSA等不良妊娠结局存在密切关联[8]。然而,由于缺乏RSA合并PTS的诊疗规范,临床实践中过度检查、过度治疗和超适应证用药等现象普遍存在。为了进一步规范RSA合并PTS的诊治,国家妇幼健康研究会生殖免疫学专业委员会组织国内妇产科学、生殖免疫学、生殖医学、风湿免疫学、血液病学、检验医学以及循证医学专家,根据RSA合并PTS的诊治现状,结合国内外最新的研究证据和进展,共同讨论,制定本共识,旨在为临床医师在临床实践中做出合理决策提供参考。
文献检索
1. 文献检索方法:从PubMed、 FMRS、中国知网(CNKI)、万方等数据库中全面检索2001年至2021年关于RSA与PTS相关的文献,中文检索关键词包括复发性流产、血栓前状态、凝血功能,英文检索关键词包括recurrent spontaneous abortion、prethrombotic state、coagulation、anticoagulant proteins、V Leiden、homocysteine、antiphospholipid syndrome。检索截止日期为2020年12月31日,未限制语言种类。
2. 文献筛选:对检索到的相关文献均进行方法学评估,包括①研究对象是否符合RSA诊断标准,因不同国家和地区在不同时间段关于RSA的诊断标准不同,研究对象应符合研究者本国当时最新的诊断标准;②对失访的研究对象有所阐明,从而保证不产生样本偏倚;③研究结果有胎儿超声等影像学的客观评估。
3. 文献分析:根据上述文献检索方法,剔除重复文献,最终纳入文献82篇,其中队列研究8篇,病例对照研究19篇,系列病例报告3篇,描述性研究6篇,诊断性试验1篇,临床指南及专家共识18篇,综述22篇,博士及硕士毕业论文2篇,其他3篇。对纳入的文献进行质量评价。循证医学等级分级标准采纳英国牛津大学循证医学中心证据分级和推荐标准(表1)。

二、PTS的定义及分类
PTS是指血液中的有形及无形成分发生某些病理生理变化,使得血液呈高凝状态,易于形成血栓的一种表现。PTS可引起全身血流动力学改变,导致全身血管血栓形成。妊娠时期的病理性血液高凝状态或高血栓栓塞倾向会导致胎盘局部的微血栓形成,进而发生胎盘的微血管梗阻,供血供氧不足,最终可导致胚胎或胎儿发育不良以及死胎等不良妊娠结局。有研究表明PTS与RSA密切相关[9]。PTS根据病因分为遗传性PTS和获得性PTS两类[10]。遗传性PTS是指各种基因缺陷而导致易于发生血栓的一类遗传性疾病,包括凝血因子缺陷或基因突变、抗凝蛋白缺陷、异常纤维蛋白血症、遗传性高同型半胱氨酸血症(hyperhomocysteinemia,HHcy)等。研究表明遗传性PTS与RSA之间存在相关性[11],与深静脉血栓及妊娠中晚期胎儿丢失关系密切,而与早期RSA的关系尚不清楚[2]。获得性PTS主要包括抗磷脂综合征(antiphospholipid syndrome,APS)和获得性高同型半胱氨酸血症(acquired hyperhomocysteinemia,AHHcy) 以及其他引起血液高凝状态的疾病。APS是最常见的获得性易栓症,临床表现为典型的PTS,也是导致RSA常见的自身免疫性疾病(autoimmune disease,AID)[12]。HHcy是PTS的独立危险因素,可引起血管内皮细胞损伤,引起胎盘或子宫螺旋动脉血栓形成,引起胎儿供血不足。在严重的情况下,它会导致流产、胎儿死亡和其他不良妊娠结局[13]。
三、PTS与RSA
1.遗传性PTS:PTS的遗传因素存在显著的种族差异[14]。在汉族人群中,蛋白C、蛋白S和抗凝血酶(antithrombin,AT)缺乏是最常见的遗传性PTS类型。大约50%的静脉血栓栓塞症(venous thromboembolism,VTE)患者是由于抗凝蛋白的三类缺陷造成的。在白种人人群中,凝血因子Ⅴ基因Leiden(factor Ⅴ Leiden,FVL)突变和凝血酶原基因突变占VTE患者的50%以上,抗凝蛋白缺陷仅占10%~15%。在健康的西方受试者中,FVL突变、凝血酶原基因突变、AT、蛋白C和蛋白S缺陷的患病率分别为3%~7%、2%~3%、0.2%~0.5%、0.2%~0.4%和0.03%~0.21%。而在国内受试人群中,蛋白C、蛋白S和AT缺乏症的检出率分别为1.15%、1.49%和2.29%[15]。目前的研究结果表明,FVL突变、凝血酶原基因多态性、亚甲基四氢叶酸还原酶(5,10-methylenetetrahydrofolate reductase,MTHFR)基因突变与RSA的关系尚不完全清楚。因种族不同,RSA与FVL、MTHFR基因突变关系存在一定差异[16]。
(1)抗凝蛋白缺陷:蛋白C、蛋白S和抗凝血酶Ⅲ(antithrombin Ⅲ,AT-Ⅲ)是人体内的三种抗凝蛋白,参与维持凝血的动态稳态和机体的抗凝和纤溶系统平衡。蛋白C和蛋白S是维生素K依赖性丝氨酸蛋白酶原,蛋白C抗凝系统主要由血栓调节蛋白(thrombomodulin,TM)、蛋白S、内皮细胞蛋白C受体(endothelial protein C receptor,EPCR)和活化蛋白C抑制物(activated protein C inhibitor,APCI)组成。AT-Ⅲ是一种肝素依赖性丝氨酸蛋白酶抑制剂。加入肝素后,成分发生变化,功能可放大2000倍,导致凝血途径中的凝血因子Ⅱa、Ⅹa、Ⅺa、Ⅻa失活。抗凝蛋白缺陷主要是指蛋白C、蛋白S和AT-Ⅲ缺陷,均属于常染色体显性遗传病,三者活性降低都会使体内抗凝功能减弱,导致出现PTS[17]。蛋白C和蛋白S缺陷是活化蛋白C抵抗(activated protein C resistance, APCR)的主要原因。研究显示,汉族血栓性疾病患者中,三种抗凝蛋白缺陷占30%~55%,其中蛋白C和蛋白S缺陷最为常见[13]。蛋白C缺陷表明凝血活性增强,纤溶活性降低,这是造成PTS的原因之一。蛋白S是激活蛋白C发挥抗凝作用的重要辅助因子,可加速激活蛋白C失活凝血因子Va和Ⅷa,蛋白S缺陷也可导致血栓。正常情况下,妊娠女性的血液处于生理性高凝状态,天然抗凝系统的减弱体现在蛋白S、游离蛋白S减少和对活性蛋白C的抵抗力增加,而妊娠期AT-Ⅲ浓度和活性没有明显变化。蛋白C水平保持稳定或略有增加,活性降低,但仍在正常范围内。随着妊娠周数的增加,蛋白S和游离蛋白S的水平下降;妊娠中期继续下降到最低水平,然后保持稳定。当妊娠中期蛋白S水平低于30%,且妊娠晚期低于24%时,可诊断为蛋白S缺乏症[18]。
一项欧洲易栓症前瞻性队列研究(the European Prospective Cohort on Thrombophilia,EPCOT)评估了843例遗传性易栓症女性的妊娠结局,结果显示胎儿丢失的总体发生率增加,但蛋白C或蛋白S缺乏与早期流产之间的关系尚不清楚[19]。另有对31项研究(包括病例对照、队列和横断面)的荟萃分析显示,蛋白S缺乏症患者的RSA风险增加了15倍,但蛋白C缺乏症并未增加RSA的风险[20]。上海交通大学医学院附属仁济医院对1101例RSA患者的病因构成比分析结果显示,蛋白S活性降低占23.66%,蛋白C活性降低占1.10%,AT-Ⅲ活性降低为2.16%[21]。AT-Ⅲ除抑制凝血酶(thrombin,FⅡa)外,还可抑制凝血因子Ⅸa、Ⅹa、Ⅺa、Ⅻa以及与组织因子结合的Ⅶa。与其他遗传性PTS患者相比,AT-Ⅲ缺乏的孕妇更容易发生深静脉血栓形成。1.1%的血栓性疾病患者缺乏AT,其发生血栓栓塞的风险比一般人群高5倍。AT-Ⅲ缺乏在欧洲白人中发病率为0.02%~1.15%[22],亚洲人群的发病率为2%~5%[23]。由于发病率低,很难评估其对妊娠丢失的影响。EPCOT研究表明,AT-Ⅲ缺乏可使胎龄小于28周的胎儿丢失的风险增加(OR=1.7,95% CI=1.0~2.8)[19],但另一项荟萃分析并未得出一致的结果[24]。
(2)APCR和FVL基因突变:APCR是由于激活蛋白C无法有效地水解和灭活凝血因子Ⅴa和Ⅷa,导致凝血酶原复合物和凝血酶的产生增加,使血液处于高凝状态。FVL基因位于染色体1q21-25上,由于1691核苷酸位置的G-A错义突变,即Leiden突变,凝血因子Ⅴa难以分离失活,而出现APCR。FVL突变占APCR病因的95%。此外,凝血因子Ⅷ基因突变、蛋白C或蛋白S异常、TM异常、凝血酶原异常和APCI活性变化可能导致APCR产生。FVL基因突变是一种常染色体显性遗传病[25]。突变的类型主要分为杂合突变和纯合突变两种,不同种族之间发病率不同。杂合突变在欧美人群中的发生率为3%~8%,在非洲、中国、日本和其他亚洲人群中几乎不存在。在FVL杂合子人群中,血液高凝状态的概率比正常人群高5~10倍,而在FVL纯合子人群中,血液高凝状态的风险增加高达80倍[26]。2020年一篇荟萃分析显示,FVL突变增加RSA的发生风险(OR=2.15,95% CI=1.84~2.50),亚组分析显示,在亚洲、欧洲、非洲人群中存在显著关联,但在南美洲人群中则没有关联[27]。2010年和2015年的两篇荟萃分析均表明,FVL基因突变可增加早期和中期RSA的风险[28-29],且在妊娠中期流产的风险更高;另一项包括31项病例对照、队列和横断面研究的荟萃分析显示,FVL基因的突变与13周之前的RSA相关(OR=2.01,95% CI=1.13~3.58)[20]。现有大多数前瞻性研究结果未报道相关性,提示FVL基因突变与RSA的相关性仅限于高风险人群,且属于轻度关联,绝对风险并无显著升高。国内徐勇等[30]研究显示在中国妇女中,RSA与APCR和3种FVL基因多态性没有关联。
(3)遗传性HHcy和MTHFR基因突变:同型半胱氨酸(homocysteinemia,Hcy)是蛋氨酸在蛋氨酸循环过程中产生的一种含硫氨基酸。血清Hcy过多,除了直接的胚胎毒性外,还能刺激体内大量自由基的形成和释放,导致血管内皮细胞损伤、平滑肌细胞增殖、脂质代谢异常等,并作用于血管表面的各种凝血因子,破坏机体的凝血和纤溶系统,使机体进入PTS,引起胎盘微血栓形成[6]。遗传性HHcy主要是由于MTHFR基因的突变。MTHFR基因的染色体为1p36.3,第677位核苷酸发生C-T突变,导致翻译后第222位的丙氨酸被缬氨酸取代,其杂合突变可能使酶活性降低35%。纯合突变时活性降低70%[31]。MTHFR是调节半胱氨酸和四氢叶酸代谢的主要酶,在DNA甲基化过程中也起着重要作用。MTHFR活性降低使Hcy代谢减慢,导致Hcy在血液中蓄积,进而引起HHcy。Ren等[32]对MTHFR C677T与不明原因RSA的相关性进行荟萃分析,共纳入21项病例对照研究,其中不明原因RSA病例2120例,对照组2949例。结果表明,杂合/纯合MTHFR C677T突变与不明原因RSA的发生无显著相关性。刘志兰等[21]分析了1101例RSA患者的病因,Hcy水平升高者占1.10%,约占PTS患者的3.58%,且不同地域、不同人种间也会有差异。由于MTHFR C677T中的杂合子或纯合子突变均不与不良妊娠结局相关,且不会增加静脉血栓栓塞的风险,因此不建议筛查MTHFR基因突变或检测空腹Hcy水平[33]。
(4)凝血酶原基因突变:凝血酶原基因位于染色体11p11-q12上。例如,第20 210位核苷酸的G-A突变可能会增加microRNA的稳定性和翻译效率,从而增加凝血酶原水平。该突变属于一种常染色体显性遗传,因凝血酶异常突变导致凝血激活,是血栓形成的一个独立危险因素。我国学者进行的一项关于RSA与基因多态性关系的荟萃分析显示,凝血酶原基因多态性与RSA的关系目前仍未完全明确[16]。Lissalde-Lavigne等[34]大规模队列研究表明,G20210A可能会增加不明原因流产的风险(OR=2.36,95% CI=1.72~3.24,P<0.001)。研究表明,这种突变可使血栓栓塞风险增加3倍,流产风险增加2~3倍[20]。Gao等[35]荟萃分析结果提示,凝血酶原G20210A基因突变与RSA之间存在显著相关性(OR=1.81,95% CI=1.26~2.60),欧洲人群显著关联(OR=1.80,95% CI=1.35~2.41),而中东人群则不显著(OR=2.39,95% CI=0.96~5.92)。凝血酶原基因杂合突变的发生率在白人中介于1%至6%之间,而在非白人中几乎不可见。现有的研究显示,在中国人群中凝血酶原基因G20210A突变几乎不可见[36-37]。
(5)纤溶酶原激活物的抑制剂-1(plasminogen activator inhibitor-1,PAI-1)升高:血浆组织型纤溶酶原激活物(tissue-type plasminogenactivator,t-PA)是血管内皮细胞合成的纤溶系统的主要生理激活剂,t-PA可将纤溶酶原转化为纤溶酶以分解并去除纤维蛋白凝块。PAI-1是一种t-PA抑制剂,可以抑制纤溶酶原激活。PAI-1可能通过调节纤溶酶活性来影响胎盘血管重塑和胎盘植入[38]。血浆PAI-1浓度升高可刺激血管平滑肌细胞增殖,促进动脉粥样硬化的发展;同时,它可以增加血小板的黏附和聚集功能,导致血栓形成。如果纤维蛋白沉积在胎盘的绒毛间隙,胎盘灌注会减少,蜕膜的纤维蛋白样坏死会导致不良妊娠[39-40]。在正常孕期,血浆的纤溶活性会生理性降低。有研究显示,RSA患者血清t-PA活性明显低于健康妊娠对照组,PAI、FⅡa活性升高[41]。研究人员认为RSA可能会损伤内皮细胞并导致t-PA合成减少,从而导致PAI/t-PA部分不平衡,诱发了PTS,甚至与血栓形成有关[41]。PAI-1基因定位于染色体7q21.2-q22,PAI-1基因启动子区第675位核苷酸上一个G(鸟嘌呤)的插入/缺失(4G/5G)多态性与血浆PAI-1水平有关。PAI-1表达水平在4G/4G、4G/5G、5G/5G基因型个体中呈下降趋势。PAI-1基因的4G/4G突变与许多常见血栓栓塞性疾病的发生发展密切相关。与低纤维蛋白溶解状态相关的PAI-1基因突变已在汉族人群中得到证实。2015年的一项荟萃分析研究显示,PAI-1 4G/5G多态性与白种人RSA风险增加显著相关(OR=2.23,95% CI=1.44~3.46,P=0.000 3),然而在亚洲人群中未观察到显著的相关性(OR=1.47,95% CI=0.84~2.59,P=0.18)[42]。
(6)凝血因子异常:妊娠期凝血因子Ⅴ、Ⅶ、Ⅷ、Ⅸ、Ⅹ、Ⅻ和血管性血友病因子(von willebrand factor,vWF)显著升高,尤其是凝血因子Ⅶ可升高约10倍。而Ⅺ则有下降趋势。凝血因子异常主要包括FXⅢ、FⅫ、FⅧ等异常。FXⅢ是一种转谷氨酰胺转移酶,可催化可溶性纤维蛋白单体分子间的交联反应,促进纤维蛋白凝块的形成,在孕早期胎盘形成中起重要作用。FXⅢ缺乏不利于胎盘着床部位纤维蛋白和纤维结合素的形成,导致胎盘与子宫壁分离,增加流产的风险[43]。FⅫ是可直接或间接激活纤溶酶原并促进纤溶的接触活性物质,其纤溶作用远大于凝血途径中的作用[13]。目前尚未证实RSA和FⅫ之间存在关联。RSA患者中FⅫ活性降低占12%,而正常对照组只占1.5%[13]。此外,有研究报道36.4%的RSA患者出现FⅧ升高,RSA病例组和对照组FⅧ水平分别为152.85%与144.93%(P=0.012),提示FⅧ升高与RSA相关[44]。《自然流产诊治中国专家共识(2020年版)》中指出凝血因子的异常可导致RSA的发生,2016年复发性流产诊治的专家共识也提到PTS由于凝血因子异常可导致RSA的发生[1]。
(7)异常纤维蛋白原血症:纤维蛋白原(fibrinogen,Fg)主要在肝实质细胞中合成并释放到外周血中。遗传性Fg缺陷主要分为Fg含量缺陷和循环Fg功能障碍[45]。Fg基因位于染色体4q23-32,其β链基因有多个突变位点。Fg基因多态性可能导致血浆Fg浓度升高。异常纤维蛋白原血症可能会增加血栓形成的风险,导致循环凝血酶水平升高、纤溶酶原或t-PA与异常Fg的结合受损,并最终降低纤溶活性。目前的研究表明,高纤维蛋白原血症可能是血栓形成性疾病的独立危险因素;遗传性异常纤维蛋白原血症患者常见产科并发症,包括流产、阴道出血、胎盘早剥和血栓形成[46]。但静脉血栓患者的异常纤维蛋白原血症发生率较低,不推荐对PTS患者进行全面系统的异常纤维蛋白原血症的检查[47]。
专家观点及建议
针对遗传性PTS,2012年ASRM及2018年ESHRE指南均推荐对于RSA患者进行筛查;易栓症诊断中国专家共识(2012版)指出,中国人群最常见的遗传性PTS病因是抗凝蛋白缺陷,建议筛查蛋白C、蛋白S、AT-Ⅲ[39];2016年中国RSA诊治专家共识对PTS的筛查是条件性推荐[1];2020版自然流产诊治中国专家共识推荐对RSA患者进行PTS筛查[2]。
(1)推荐对RSA合并PTS患者进行凝血功能的筛查,常用指标包括凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶时间(thrombin time,TT)、Fg、D-二聚体、血小板聚集率、血清Hcy、抗磷脂抗体(antiphospholipid antibodies,aPLs)谱等。有条件者可开展血栓弹力图(thromboelastography,TEG)、凝血酶-抗凝血酶复合物(thrombin antithrombin complex,TAT)、TM、蛋白C、蛋白S、AT、凝血因子Ⅴ、凝血酶原等因子的功能检测,必要时可进行遗传性PTS基因筛查(推荐级别B,证据水平2b)。
(2)推荐对RSA合并PTS患者进行蛋白C、蛋白S和AT-Ⅲ三种抗凝蛋白的筛查。中国人群最常见的遗传性PTS类型是抗凝蛋白缺陷,因而建议筛查蛋白C、蛋白S和AT-Ⅲ三种抗凝蛋白,最有效的方法是检测其活性。在对抗凝蛋白进行筛查时,筛查时间应当避开妊娠期、筛查前避免使用抗凝或激素类药物。如果发生流产,至少在流产6周后进行筛查,以避免母体生理状态改变对抗凝蛋白水平的影响。非妊娠期游离蛋白S抗原水平小于55%者需要进行随访,其水平持续小于40%~55%的可以认为是蛋白S缺乏。在妊娠期间,早期低于40%、中期和晚期妊娠分别低于30%、24%可作为蛋白S活性的截断值(推荐级别B,证据水平2a)。
(3)不推荐对RSA合并PTS患者进行FVL突变、凝血酶原基因突变、PAI-1基因突变和MTHFR基因突变检测。由于汉族人群罕见有FVL突变、凝血酶原基因突变和PAI-1基因突变,因此,不推荐作为常规筛查项目;MTHFR C677T杂合突变或纯合突变目前没有足够的证据表明与不良妊娠结局以及静脉血栓栓塞发生存在关联,不推荐常规筛查MTHFR基因突变(推荐级别B,证据水平2a)。
(4)不推荐对RSA患者常规进行凝血因子和异常纤维蛋白原血症的筛查。凝血因子异常与异常纤维蛋白原血症可导致血栓的发生风险增加,可能与RSA和其他妊娠并发症关联,但发生率极低,因而不推荐对RSA患者常规进行凝血因子和异常纤维蛋白原血症的筛查(推荐级别B,证据水平3a)。
2. 获得性PTS:获得性PTS主要包括APS、AHHcy以及各种易导致血栓形成的结缔组织疾病,如系统性红斑狼疮(systemic lupus erythematosus,SLE)、长期控制不佳的高血压、糖尿病、慢性肾病、长期卧床休息、激素替代等。
(1)APS:APS是一种以血栓形成或病理妊娠为主要临床表现的AID。可分为原发性APS和继发性APS。aPLs可以影响凝血、抗凝、纤溶、血小板等系统,导致凝血紊乱,引起血栓形成[48]。目前APS是唯一被公认与RSA相关的AID,其主要致病机制是通过aPLs介导的血管内皮活化、急性炎症、补体激活、纤溶、抗凝异常等途径导致胎盘微血栓形成,甚至胎盘梗死导致流产、生长发育受限和胎死宫内等产科并发症[49]。在APS中以病理妊娠为主要临床特征时称为产科APS(obstetric APS,OAPS)[1-2,50]。APS的诊断分为典型OAPS和非典型OAPS[48,51]:①典型的OAPS必须至少有1项临床标准,包括3次或3次以上自然流产,孕周小于10周;1次或多次流产,孕周大于10周;1次或多次胎盘功能不全性疾病,孕周小于34周;以及至少1项实验室指标,即连续2次以上,间隔12周或以上,狼疮抗凝物(lupus anticoagulant,LA)阳性或抗心磷脂抗体(anticardiolipin antibody,aCL)或抗β2糖蛋白Ⅰ抗体(anti-β2glycoproteinⅠ antibody, anti-β2GPⅠAb)滴度>第99百分位数;②非典型OAPS中aPLs谱呈阳性但不具有临床表现(例如2次小于10周的不明原因流产;3次或3次以上非连续的不明原因流产);具有典型OAPS的临床表现,但aPLs间歇性阳性;aPLs的实验室指标不满足高滴度阳性(>第99百分位数),只有低滴度阳性(第95~99百分位数)。标准中的aPLs主要包括aCL、LA以及anti-β2GPⅠAb,标准aPLs对妊娠丢失的阳性预测值可达75%,其中LA的阳性预测值更高[51-52],APS被认为是RSA的最为重要的危险因素[53]。在诊断标准之外发现了20多种aPLs,包括抗β2GPⅠ结构域1抗体、抗磷脂酰丝氨酸抗体/抗凝血酶原复合物抗体(aPS/PT抗体)、抗波形蛋白抗体以及抗膜联蛋白A5抗体等。越来越多的证据表明,抗β2GPⅠ结构域1抗体的IgG亚型主要与APS患者的血管血栓形成有关,在一定程度上与OAPS表现有关[54]。有报道显示aPS/PT抗体是有诊断价值的非典型aPLs,抗膜联蛋白Ⅴ抗体可能成为预测血栓形成或流产的新的标志物[55]。
在2019年欧洲抗风湿病联盟成人APS治疗指南中,给出了中至高滴度aPLs、低风险及高风险aPLs谱[56],其中高风险aPLs谱的定义包括3种情况:①LA有2次以上阳性(需满足2次及2次以上,间隔大于12周的阳性结果);②2种或3种aPLs阳性;③持续存在的高滴度aPLs。目前认为APS女性有以下情况更易出现不良妊娠结局:①高风险的aPLs谱;②合并SLE或其他AID;③既往有血栓形成史和病理妊娠史[56]。
2011年RCOG[4]、2016年复发性流产专家共识[1]、2020年自然流产诊治中国专家共识均推荐对RSA患者进行标准aPLs筛查[2]。
(2) AHHcy:营养失调、咖啡摄入、药物、肾功能受损、甲状腺功能异常、吸烟和高龄等因素都会引起AHHcy;2020版自然流产专家共识推荐对RSA患者进行血清Hcy检测[2],2020年同型半胱氨酸专家共识中推荐对Hcy、叶酸、维生素B和叶酸代谢基因4项进行检测,以明确病因,及早干预[57]。
专家观点及建议
(1)推荐对RSA患者常规筛查aPLs谱,首先筛查标准抗体,包括LA、aCL和anti-β2GPⅠAb,至少间隔12周并且有2次以上阳性,才能诊断APS(推荐级别B,证据水平2a)。
(2)推荐对高度怀疑APS,而标准aPLs阴性的患者,进行非标准aPLs的检测,包括抗β2GPⅠ结构域1抗体(推荐级别B,证据水平2b)、抗PS/PT抗体、抗PE抗体以及抗膜联蛋白A5抗体等。
(3)推荐对RSA患者,常规进行血清Hcy检测,如Hcy升高,为了明确原因可进行叶酸、维生素B以及叶酸代谢基因等检测,否则不推荐常规进行叶酸、维生素B以及叶酸代谢基因等检测(推荐级别B,证据水平2c)。
(3)AID和自身抗体异常与PTS:妊娠丢失或反复妊娠丢失可能是妊娠合并自身抗体阳性或AID的首发临床表现[58]。AID约占RSA病因的15%,包括SLE、干燥综合征(Sjogren's syndrome,SS)、类风湿关节炎(rheumatoid arthritis,RA)、系统性硬化症(systemic sclerosis,SSc)和未分化结缔组织病(undifferentiated connective tissue disease,UCTD)以及APS等。AID可通过一系列复杂机制引起母体免疫功能和凝血功能紊乱,导致反复流产。
① SLE:SLE是一种多因素参与、自身免疫紊乱的弥漫性结缔组织病,在合并妊娠时不仅可引起疾病活动,还可明显增加流产、子痫前期、死胎、早产、胎儿宫内窘迫等妊娠不良事件发生的风险[59]。约有20%的妊娠合并SLE患者发生自发性流产(16.67%~18.52%比9.22%~16.42%)或死产(1.85%~2.87%比0.72%~0.75%)[60]。SLE患者如果继发出现APS,则血栓形成风险更大。在SLE人群中,30%~80%患者血清中存在aPLs,其中anti-β2GPⅠAb与β2GPⅠ相互作用,可刺激滋养细胞和蜕膜细胞分泌促血栓细胞粘连分子,降低活化蛋白C水平,激活补体通路,引发母体血管内血栓形成(OR=12.1)。这些患者发生严重产科并发症和不良妊娠结局风险更大[61]。
② UCTD:UCTD是存在一种以上的结缔组织病症状或体征,并伴有一种以上自身抗体,如抗核抗体(antinuclear antibodies,ANA)谱、抗ds-DNA抗体、SS-A、SS-B抗体等,但不符合任何其他结缔组织病的诊断/分类标准的一种AID[62]。现在认为 UCTD可能是一种从自身免疫异常到结缔组织疾病的过渡状态。UCTD会增加流产、早产、先兆子痫、胎死宫内、低出生体质量、胎儿和新生儿心脏传导阻滞以及新生儿SLE的风险。同时,妊娠也会增加患UCTD的风险。这种情况可能会增加将UCTD转化为特定结缔组织疾病的风险。凝血功能异常和免疫系统紊乱是UCTD引起流产的重要致病因素。大多数UCTD患者ANA阳性,约40%的患者有多种抗体,包括aPLs、SSA/Ro抗体等[63]。这些自身抗体可通过影响血小板活性、凝血或抗凝机制并破坏血管内皮细胞诱发血栓形成,从而对胚胎着床和胎儿发育产生不利影响。Spinillo等[64]的一项包含2458例患者的队列研究结果显示UCTD与流产的关系密切(OR=2.81,95% CI=1.29~6.18),UCTD对妊娠和胎儿结局的影响明确,包括流产或死产(3.23%)、子痫(11.29%)、胎儿发育迟缓(8.06%)、早产(3.23%)、先天性心脏传导阻滞(congenital heart block,CHB)、新生儿SLE。另一项41例UCTD孕妇的病例对照研究显示,UCTD患者RSA发生率约为9.5%,正常对照组仅为1.2%(P=0.000 4),提示UCTD患者更易发生RSA[65]。
③ SS:SS是一种AID,其特征是慢性炎症,影响外分泌腺,如唾液腺和泪腺,并可累及全身多个器官。其病理表现为大量淋巴细胞、浆细胞和单核细胞浸润基底层,伴有导管上皮细胞增生和中小血管炎。SS分为原发性SS(primary Sjogren's syndrome,pSS)和继发性SS。后者通常继发于其他艾滋病患者,如SLE、RA和APS。当SS患者妊娠时,胎盘可作为免疫损伤的靶器官,引起胎盘功能障碍,增加妊娠并发症和流产的风险。SS患者和正常人群相比自然流产率和早产率均明显增加。Upala等[66]进行了系统评价和荟萃分析,以评估pSS与不良妊娠结局之间的关联。共纳入7项研究,涉及544例患者1586次妊娠,荟萃分析结果显示,与健康妊娠相比,pSS新生儿死亡率更高,流产风险显著增加。
④ RA:RA是一种以关节病变为主的慢性全身AID。妊娠时,循环抗体及炎症因子可作用于胎盘或穿透胎盘屏障,从而影响胚胎着床及其生长发育。因此,RSA合并RA患者胎儿生长受限和胎膜早破的风险增加,RA的疾病活动度与早产、小于胎龄儿、新生儿低体质量等密切相关[67]。目前对RA与早期流产的研究不多,尚不能明确RA与早期流产的相关性。
⑤有关指南和共识的推荐:2016年复发性流产专家共识推荐对于诊断为APS的患者还应检查抗核抗体、抗ds-DNA抗体、SS-A抗体、SS-B抗体等,以排除SLE、RA等AID[1];推荐对不明原因的RSA患者进行自身抗体筛查;2020版自然流产诊治中国专家共识也推荐对RSA患者筛查有关免疫指标来排除RSA是否与自身免疫因素相关[2]。
专家观点及建议
(1)推荐对RSA患者常规进行相关自身抗体的筛查,包括ANA、可提取核抗原抗体(extractable nuclear antigens,ENA)、抗ds-DNA抗体、标准aPLs(包括LA、aCL IgG/IgM亚型、anti-β2GPⅠAb IgG/IgM亚型)、类风湿因子(rheumatoid factor,RF)、抗环瓜氨酸肽抗体(anti-cyclic citrullinated peptide antibody,anti-CCP)、抗中性粒细胞抗体(anti-neutrophil cell antibody,ANCA)、甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)、甲状腺球蛋白抗体(thyroglobulin antibody, TGAb)、ESR、补体C3、C4、CH50、免疫球蛋白IgG、IgM、IgA等(推荐级别B,证据水平2b)。
(2)推荐对RSA合并自身抗体阳性或自身免疫病者,常规进行凝血功能筛查(推荐级别B,证据水平2b)。
四、RSA合并PTS筛查与评估
针对RSA患者,2016年复发性流产诊治的专家共识推荐首先进行常用的凝血指标筛查[1],如PT、APTT、TT、Fg、D-二聚体等,有条件的实验室可根据病因开展不同的凝血项目检测甚至基因检测[68]。《自然流产诊治中国专家共识(2020版)》中对于RSA患者,PTS筛查推荐建议[2],除常规凝血指标外,有条件的实验室还可开展TEG、TAT等凝血分子标志物。《急性出血性凝血功能障碍诊治专家共识》建议对于临床情况复杂或者病因未明的患者,可以开展TEG、纤溶酶-α2纤溶酶抑制物复合物(α2-plasmininhibitor-plasmin complex,PIC)、TM、组织型纤溶酶原激活抑制复合物(tissue-type plasminogen activator-inhibitor complex,tPAI-C)等项目[69]。必要时可进行遗传性PTS基因筛查。复发性流产PTS评估筛查流程见图1。
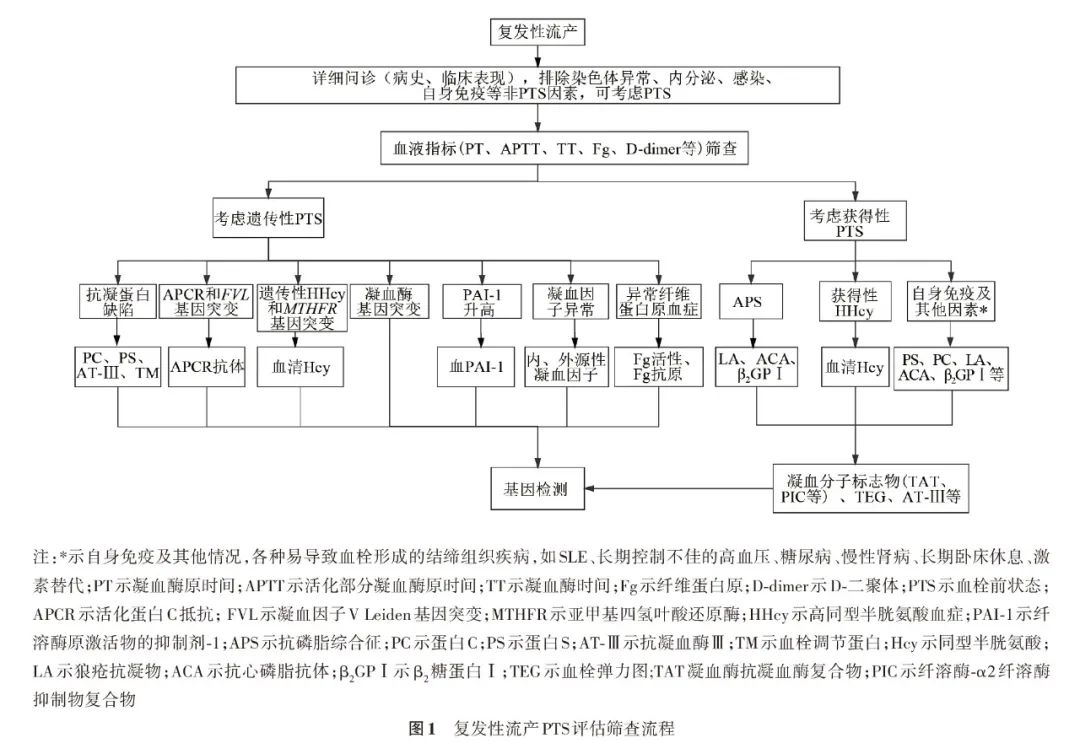
需要注意的是,目前绝大多数实验室给出的凝血指标参考范围都是非孕期和普通人群,缺乏妊娠期的凝血功能参数,而妊娠期孕妇的血液是处于生理性的高凝状态的,故孕妇不能参照非妊娠人群凝血指标的参考区间,如PT、APTT、TT、Fg、D-二聚体、AT-Ⅲ、TEG、TAT、TM、tPAI-C、PIC等[70-72]。建议建立本地区或本实验室的妊娠期凝血功能的参考区间。
五、治疗及监测
1. 治疗:对于各种病因所致的PTS合并RSA患者,治疗目的在于减少或消除血栓栓塞事件的风险,减少流产以及各种产科并发症的发生,从而改善妊娠结局。针对PTS和自身免疫异常所致的RSA,目前认为使用抗凝和/或抗血小板治疗能明显改善妊娠结局[2,10]。临床上常使用低分子肝素(low molecular weight heparin,LMWH)和/或联合使用低剂量阿司匹林(low dose aspirin,LDA,LDA≤100 mg/d)进行抗凝和抗血小板治疗[73-74]。
Dendrinos等[75]对合并APS的RSA患者进行的前瞻性、多中心试验结果显示,LDA联合LMWH治疗的活产率为72.5%(29/40),采用免疫球蛋白治疗组活产率为39.5%(15/38),两组的活产率比较有显著差异(P=0.007)。Triolo等[76]对RSA合并抗磷脂抗体(ACL和LA)阳性的妇女,在确诊为妊娠时开始使用LDA联合LMWH抗凝治疗,新生儿活产率为84%。对于有血栓史的女性APS患者,使用LDA和治疗剂量的肝素治疗可以使妊娠活胎率达79%左右[77]。
专家观点及建议
(1)遗传性PTS以静脉血栓为主(除了遗传性HHcy外),给药原则和方案参照《低分子肝素防治自然流产中国专家共识》[10],首选治疗方式为LMWH治疗。LMWH使用剂量有预防剂量和治疗剂量2种。预防剂量常用:那屈肝素钙注射液2850 IU(0.3 mL),达肝素钠注射液5000 IU(0.5 mL),依诺肝素钠注射液4000 IU(0.4 mL)皮下注射,qd;治疗剂量常用:那屈肝素钙注射液0.01 mL/kg (95 IU/kg)、达肝素钠注射液100 IU/kg或依诺肝素钠注射液100 IU/kg皮下注射,q12h。如果无近期血管栓塞表现或相关病史,推荐使用预防剂量;对有近期血管栓塞表现或相关病史的患者则推荐使用治疗剂量。获得性PTS动静脉血栓都可能发生,给药原则和方案参照《低分子肝素防治自然流产中国专家共识》以及《产科抗磷脂综合征诊断与处理专家共识》,首选治疗方式为联合使用LMWH和LDA。
(2)针对高风险aPLs谱携带者(伴或不伴有SLE)可单用LDA,但是临床证据等级并不高[77]。对有明确OAPS病史(无血栓史)的患者,建议受孕前即开始使用LDA(推荐级别B,证据水平2b),备孕当月月经干净开始或一旦受孕即开始使用预防剂量的普通肝素(unfractionated heparin,UFH)或LMWH。对于常规治疗失败的OAPS,又称难治性OAPS,目前尚缺乏高级别循证医学证据的二线治疗方案。最常见治疗方案是LWMH增加到治疗量;在妊娠前开始使用LDA和羟氯喹(hydroxychloroquine,HCQ)200~400 mg/d口服,妊娠期可考虑加用小剂量泼尼松(孕早期≤10 mg/d)或同等剂量的其他糖皮质激素。对于诊断“非标准的”APS患者,需要临床医生在全面评估后决定单用LDA或者联合肝素治疗(推荐级别D,证据水平5)。
(3)对于无血栓事件的OAPS患者,发生过≥3次小于10周的自发反复流产或1次及以上≥10周死胎的患者,建议妊娠期间联合使用LDA和预防剂量的肝素(推荐级别B,证据水平2b);发生过由于子痫或重度子痫前期或可被识别的胎盘功能不全导致的<34周早产患者,在考虑个体风险的前提下,建议使用LDA或LDA联合预防剂量的肝素治疗(推荐级别B,证据水平2b)。
(4)针对有血栓史的APS患者,需要长期服用抗凝剂,常用华法林治疗(推荐级别B,证据水平2b)。使用剂量可根据国际标准化比值(international normalized ratio,INR)调整,控制在2~2.5范围。华法林为香豆素类抗凝药,因相对分子质量低,可通过胎盘屏障,有导致“胎儿华法林综合征”的风险。因此,妊娠开始后3个月内应避免使用,妊娠3个月后可使用,在妊娠结束前1~2周,改用肝素替代。
(5)针对血小板功能亢进的RSA患者,建议在下次妊娠前2~3个月开始给予LDA,妊娠后继续使用LDA,并根据血小板聚集率和TEG结果调整阿司匹林用量。
(6)针对RSA合并HHcy患者,推荐常规使用LDA和/或联合使用LMWH,同时补充叶酸、维生素B族等药物以降低血清Hcy水平。建议将血清Hcy水平降到正常范围后再计划妊娠。
(7)对于RSA合并自身抗体阳性或自身免疫病患者,除了积极治疗原发病外,推荐常规使用LDA和/或联合使用LMWH,并且联合风湿免疫科共同管理(推荐级别B,证据水平2b)。
2. 监测:对RSA合并PTS的监测包括对抗凝药物使用的监测、妊娠期母体的监测和胎儿的监测。在RSA合并PTS、自身免疫异常患者使用LMWH或LDA等治疗过程中需要严密监测相关指标,在保证抗凝或抗血小板效果的同时,以最大限度减少不良反应的发生。
专家观点及建议
(1)抗凝药物使用的监测
① 肝素监测:LMWH是由UFH通过化学或酶解聚方法而成,其平均相对分子质量仅4500~5000,大小只为UFH的三分之一。虽然与UFH相比,LMWH相对分子质量较小、半衰期长、作用持久、使用更广泛、出血等不良反应更少[53,78-79],但由于存在个体差异,使用LMWH仍存在出血与抗凝不足的风险。一般情况下,使用预防剂量的LMWH抗凝治疗时,不需要常规监测抗Ⅹa活性,但对于特殊人群需要监测,如体质量过轻(≤45 kg)、体质量过重(≥80 kg)、肾功能异常以及有出血倾向者,可依据抗Ⅹa活性调整LMWH剂量,避免剂量不足或过量。在肌酐清除率<30 mL/min时,应慎用LMWH。虽然LMWH引起血小板减少[肝素诱导的血小板减少(heparin-induced thrombocytopenia,HIT)]罕见,但用药期间仍建议定期监测血小板数量。通常建议用药1周后复查血小板数量,以后每2~4周检测1次。此外,还应定期监测肝肾功能、其他凝血功能指标,还需密切观察有无出血、皮疹以及过敏等不良反应。
磺达肝癸钠是选择性的Ⅹa因子抑制剂,对Ⅱa因子以及血小板无抑制作用,与LMWH相比,具有更好的抗凝活性和更长的半衰期(10~15 h),同时能显著降低出血风险等不良反应。用抗Ⅹa活性分析试剂盒监测LMWH和磺达肝素时,需要根据各自的药物配制校准品制作校准曲线。药物峰值测量值检测的时间,应选择在皮下注射LMWH后4 h,注射磺达肝素后3 h应进行采样检测。由于原材料来源和生产工艺不同,每种LMWH的药代动力学、抗凝谱存在差异,在临床使用中不宜随意替换[80-81]。
② 阿司匹林监测:在孕期合理使用LDA,一般无明显不良反应,且无明显致畸作用,在治疗过程中要注意监测血小板计数、凝血功能及纤溶指标以及是否有明显出血倾向,如鼻出血、消化道出血、泌尿道出血等表现。可根据血小板聚集率来调整LDA用量。考虑到有相当部分患者存在阿司匹林抵抗,建议联合使用血小板聚集率和TEG来评估患者是否存在阿司匹林抵抗,如果存在,建议使用其他抗血小板药物,如氯吡格雷进行替代。
③ 华法林监测:使用禁忌证包括对华法林过敏或不耐受等,剂量需要根据INR调整,控制在2~2.5范围。开始用药时应每周检测1~2次,调整药量当INR达到治疗目标范围且稳定时,可改为每月检测1次。
使用LMWH、LDA、华法林监测指标及流程见图2。
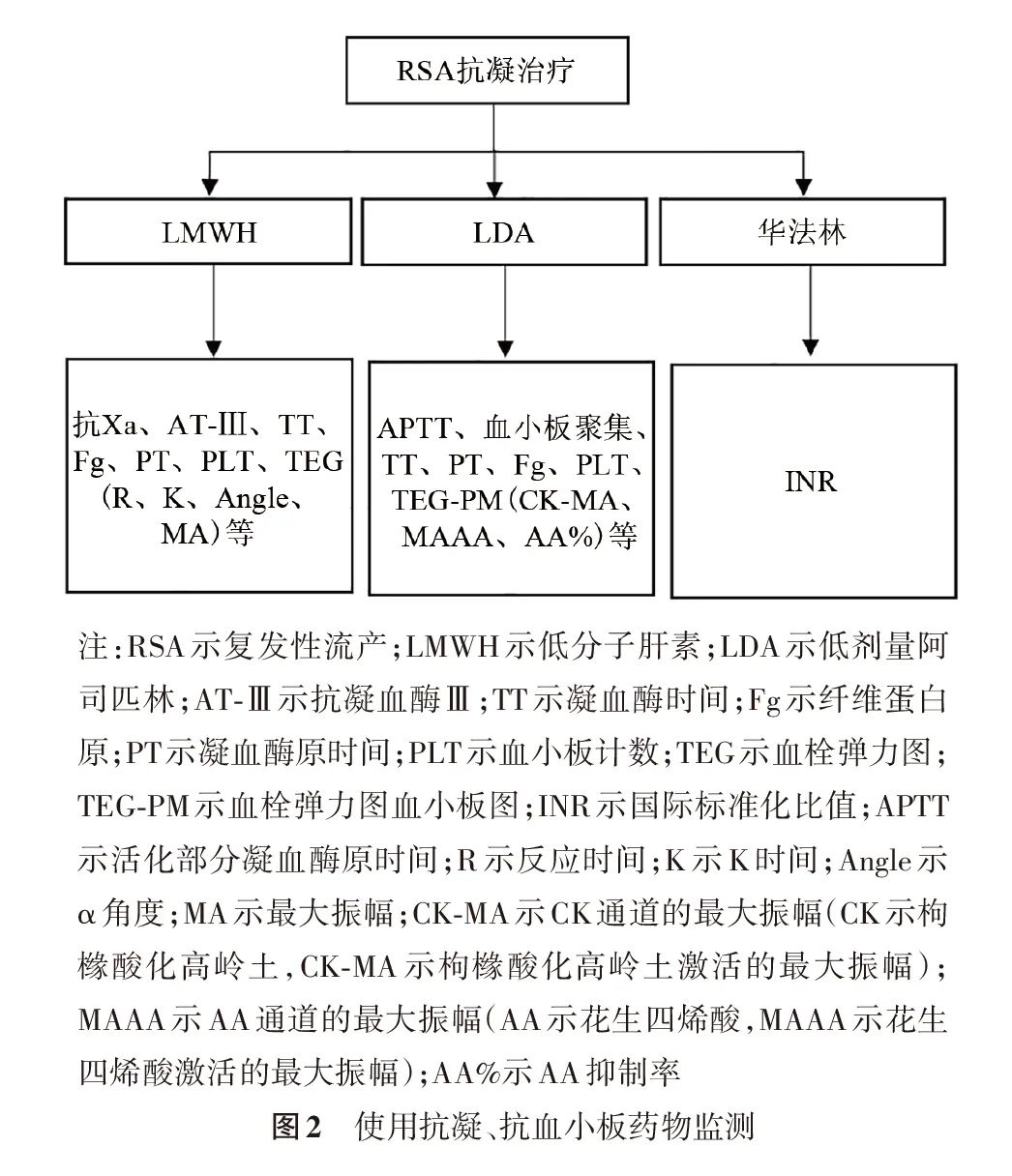
(2)其他药物使用的监测
① HCQ:HCQ是妊娠C类药物,具有抗炎、免疫调节和抗血小板等特性,可降低LA活性以及aPLs的抗体效应。它是除阿司匹林和肝素之外治疗APS和其他AID的重要药物。使用禁忌证包括过敏、眼底改变等不良反应或不耐受。目前国际上大多数专家已达成共识,孕期使用HCQ是安全的[82]。长期服用HCQ,应注意患者的视力、视野变化,可在服药前排除眼底病变,在服药5年后每年行眼科评估。肥胖等高危患者应每年检查眼底。同时,注意监测患者肝肾功能等指标。
② 糖皮质激素:能抑制抗体的产生和抗原抗体反应,减少血小板破坏。临床上常用的糖皮质激素为泼尼松和甲基泼尼松龙。当APA滴度明显升高或APS伴发血小板明显减少、溶血性贫血时应考虑使用。长期服用糖皮质激素,建议补充维生素D、钙片,根据情况加用保护胃黏膜的药物,同时应注意监测血压、血糖、体质量变化。
(3)母体的监测
① 孕前风险评估:对PTS合并RSA的患者再次妊娠前应进行充分的孕期风险评估。尤其是合并APS、SLE和UCTD等AID患者,要详细询问病史,包括以往的血栓形成、妊娠丢失史、目前治疗情况、有无器官受累(如心、脑、肺动脉和肾等重要器官)等情况,告知患者可能存在血栓或中风等风险,以及发生早期流产、子痫前期、胎儿生长受限、早产和死胎等不良妊娠结局。
② 孕期监测:随着妊娠的进展,PTS合并RSA患者妊娠合并症的病情可能会加重,各种妊娠并发症的发生危险也逐渐增加。孕期应通过相关检查来监测病情变化,除了常规监测凝血功能外,还需要进行传统心血管危险因素的筛查,包括高血压、血脂异常和糖尿病等因素,并与其他妊娠并发症/合并症进行鉴别。对于孕前或孕早期已确诊的APS患者,妊娠期aPLs抗体滴度变化不应作为药物剂量调整或停药的依据。对于仅是OAPS的妇女和无症状携带者应该保护防止发生第一次血栓。合并APS和SLE等AID的患者应采取多学科管理模式,即需要妇产科、风湿免疫科和血液科等多学科医师共同参与管理,严密观察母体病情变化。
(4)胎儿的监测
① 妊娠早期:通过超声检查核准孕周,建议于妊娠6~7周时行首次超声检查,如见异常应每隔1~2周定期复查,根据孕囊大小、胚芽发育、心管搏动以及卵黄囊等情况综合判断胚胎发育是否正常,避免盲目保胎。
② 妊娠中期:做好遗传咨询,加强胎儿出生缺陷监测,必要时行产前诊断。对于继发性APS患者,如果抗Ro/SSA和抗La/SSB抗体阳性,临床应重视两者对胎儿心脏传导系统的影响。
③ 妊娠晚期:加强对胎儿安危的监测,每3~4周超声评估胎儿生长情况、羊水量、脐动脉血流及胎心监护,结合其他检查评估胎儿胎盘功能,适时终止妊娠。
本共识检索国内外有关领域的文献,并进行筛选和分析,从PTS的定义及分类、PTS与RSA发生原因及机制、RSA合并PTS筛查、评估以及治疗及监测等进行了全面的梳理及归纳,形成本共识建议。对于临床上合并多种因素导致RSA的PTS的分析,本文未纳入讨论;抗凝药物使用时,对原发病因的治疗及剂量标准、停药时间和判断标准等未进行详细的说明,是本共识不足之处。随着人们对RSA的病因学及发病机制研究的不断深入,合并PTS诊治将获得更多的证据加以充实。本共识也将会不断更新和完善,期待所有的临床医师在未来临床实践中共同努力,为RSA合并PTS诊治的合理决策献言献策。
通信作者

赵爱民
医学博士、教授、主任医师、博士研究生导师。
现任上海交通大学医学院附属仁济医院妇产科主任,仁济—生殖免疫诊疗中心主任。
主要学术任职:中国复发性流产诊治精英联盟主席、中国免疫学会生殖免疫分会副主任委员、妇幼健康研究会生殖免疫专业委员会副主任委员、国家卫生应急处置指导专家、国家卫健委妇科内镜推广专家委员会委员、中国优生优育科学协会生殖道疾病常委、上海市医学会妇产科分会委员、上海市免疫学生殖免疫分会委员、上海市妇科肿瘤重点实验室学术委员会委员、《中华妇产科杂志》、 《中国实用妇科与产科杂志》、 《实用妇产科杂志》、 《中华生殖与避孕杂志》、《上海交通大学学报(医学版)》、《中国免疫学》、《上海医学》、Frontiers in Medicine、Frontiers in Surgery、Editorial Board of Obstetrics and Gynecology、Am J of ReprodImmunol 等多本杂志的编委和审稿专家。
赵爱民教授长期从事妇产科的医疗、教学、科研及管理工作,具有丰富的临床经验,尤其擅长反复自然流产、妇科良恶性肿瘤的综合诊治和妇科微创手术以及院内VTE的防治。主要研究方向:妊娠免疫耐受机制及相关疾病的诊断与治疗,建立了一整套有关免疫异常、PTS(血栓前状态)等有关的反复流产患者免疫学病因、凝血功能异常的筛查、诊断、治疗以及孕期监测方案。发表论文100余篇。近年来,为了推动和进一步规范我国复发性流产的诊治,赵爱民教授牵头组织全国专家、执笔撰写和参与讨论制定了有关复发性流产诊治专家共识6个:《低分子肝素防治流产的中国专家共识》(牵头,执笔撰写,中华生殖与避孕杂志,2018)、《复发性流产合并风湿免疫病免疫抑制应用中国专家共识》(牵头,执笔撰写,中华生殖与避孕杂志,2020)、《自然流产合并诊治中国专家共识2020版》(牵头,执笔撰写,中国实用妇科与产科杂志,2020)、《复发性流产合并血栓前状态诊治中国专家共识》(牵头,中华生殖与避孕杂志,2021)、《孕激素维持早期妊娠及防治流产的中国专家共识》(参与讨论专家,中华妇产科杂志,2016)、《复发性流产免疫学诊断和治疗共识》(参与讨论专家,生殖医学杂志,2008)。这些共识为规范复发性流产的诊治作出了杰出贡献。有关研究成果曾获得省部级科技进步奖5项,国家科技进步二等奖1项。

韦相才
妇产科教授,主任医师,医学博士,博士研究生导师 。
广东省妇幼保健院副院长,生殖免疫学科带头人。国家妇幼健康研究会生殖免疫专委会主任委员,中国妇幼健康生殖免疫专科联盟理事长,中国复发性流产诊治精英联盟首任共同主席,广东省免疫学会副理事长兼任殖免疫专委会主任委员,广东省医学会生殖免疫与优生学分会首任主任委员。
从事妇产科学、生殖医学及辅助生殖技术等妇幼保健临床和研究工作近30年。研究领域包括生殖医学基础与临床应用研究,专注生殖内分泌、生殖免疫及遗传相关性疾病方面研究,对多囊卵巢综合征、卵巢早衰、复发性流产等相关疾病的分子基础、发病机制、流行病学及临床治疗等有深入的研究。
擅长女性不孕不育症、妇科生殖内分泌性疾病、生殖免疫性疾病诊治相关领域;专注早期胚胎停育、胚胎妊娠丢失及复发性流产治疗;对多囊卵巢综合征、早发性卵巢功能不全及复发性流产有独特的诊治经验。
承担国家科技支撑项目子课题2项和国家自然科学基金2项目,省部级课题15项目。在国内外期刊杂志发表文章近100篇,其中发表有高水平 SCI 论文 25 篇。培养博士、硕士研究生26名。
2015年主编《生殖免疫学理论和临床新进展》、2016年副主编《复发性流产》。2020年副主译《反复妊娠丢失》。2015年获国家妇幼健康科学技术奖自然科学奖二等奖1项(排名第1)、2016年获得广东省优生优育科技金域奖二等奖1项(排名第1)、2019年获得国家妇幼健康科学技术奖科技进步奖二等奖1项(排名第1)及2019年广东省科学技术奖科技进步奖二等奖1项(排名第1);共获得知识产权6项。
执笔专家
钟兴明(广东省生殖医院)、穆小萍(广东省妇幼保健院)
共识编写专家组成员(按姓氏汉语拼音排序)
鲍时华(上海市第一妇婴保健院)、曹云霞(安徽医科大学附属第一医院)、陈慧(中山大学附属孙逸仙纪念医院)、陈耀龙(兰州大学循证医学中心)、陈子江(山东大学附属生殖医院)、崔金全(郑州大学附属第二医院)、邓小燕(广州医科大学金域检验学院)、刁红录(湖北医药学院附属人民医院)、杜美蓉(复旦大学附属妇产科医院)、冯莹(广州医科大学附属第二医院)、冯云(云南省第一人民医院)、高玉平(上海交通大学医学院附属新华医院)、胡振兴(徐州医科大学附属徐州妇幼保健院)、黄官友(贵州医科大学附属第一医院)、黄元华(海南医学院附属第一医院)、金莉萍(上海市第一妇婴保健院)、康晓敏(云南省第一人民医院)、李大金(复旦大学附属妇产科医院)、李蓉(北京大学第三医院)、李豫峰(华中科技大学附属同济医院)、廖爱华(华中科技大学同济医学院)、刘嘉茵(江苏省人民医院)、刘建荣(山西省人民医院)、罗克燕(遵义医科大学附属医院)、吕良敬(上海交通大学医学院附属仁济医院)、马黔红(四川大学华西第二医院)、马延敏(首都医科大学附属北京妇产医院)、穆小萍(广东省妇幼保健院)、漆洪波(重庆医科大学附属第一医院)、乔宠(中国医科大学盛京医院)、秦朗(四川大学华西第二医院)、谭季春(中国医科大学盛京医院)、王海燕(北京大学第三医院)、王华(湖南省妇幼保健院)、王俊利(右江民族医学院检验学院)、王琼(中山大学附属第一医院)、王玮(河北医科大学第二医院)、王文娟(青岛大学附属烟台毓璜顶医院)、韦相才(广东省妇幼保健院)、肖青(中山大学附属第八医院)、颜军昊(山东大学附属生殖医院)、杨菁(武汉大学人民医院)、张翠莲(河南省人民医院)、张丹(浙江大学医学院附属妇产科医院)、张弘(苏州大学附属第二医院)、张建平(中山大学附属孙逸仙纪念医院)、张松英(浙江大学医学院附属邵逸夫医院)、赵爱民(上海交通大学医学院附属仁济医院)、郑鹏生(西安交通大学附属第一医院)、钟兴明(广东省生殖医院)、钟依平(中山大学附属第一医院)、周红(广西壮族自治区妇幼保健院)
参考文献
[1] 中华医学会妇产科学分会产科学组. 复发性流产诊治的专家共识(2016年版)[J]. 中华妇产科杂志, 2016, 51 (1): 3-9. DOI: 10.3760/cma.j.issn.0529-567x.2016.01.002.
Obstetrics Science Group of Obstetrics and Gynecology Branch of Chinese Medical Association. Expert consensus on the diagnosis and treatment of recurrent abortion (2016)[J]. Chin J Obstet Gynecol, 2016, 51(1): 3-9. DOI: 10.3760/cma.j.issn.0529-567x.2016.01.002.
[2] 自然流产诊治中国专家共识编写组. 自然流产诊治中国专家共识(2020年版)[J]. 中国实用妇科与产科杂志, 2020, 36 (11): 1082-1090. DOI: 10.19538/j.fk2020110113.
Chinese Expert Consensus Writing Group for the Diagnosis and Treatment of Natural Abortion. Chinese expert consensus on the diagnosis and treatment of natural abcarriages (2020)[J]. Chin J Pract Gynecol Obstet, 2020, 36 (11): 1082-1090. DOI: 10.19538/j.fk2020110113.
[3] Practice Committee of the American Society for Reproductive Medicine. Evaluation and treatment of recurrent pregnancy loss: a committee opinion[J]. Fertil Steril, 2012, 98(5): 1103-1111. DOI: 10.1016/j.fertnstert.2012.06.048.
[4] Royal College of Obstetricians and Gynaecologists. The investigation and treatment of couples with recurrent first-trimester and second-trimester miscarriage [EB/OL]. (2011-04) [2021-07-28]. https://www.rcog.org.uk/globalassets/documents/guidelines/gtg_17.pdf.
[5] ESHRE Early Pregnancy Guideline Development Group. Recurrent pregnancy loss [OL]. (2018-03-05) [2021-07-28]. https://www.eshre.eu/Guidelines-and-Legal/Guidelines/Recurrent-pregnancy-loss.
[6] 张丽梅, 杨燕宁, 张瑞晓, 等. 自然流产两次与三次及以上的早期复发性流产患者病因构成的比较[J]. 中华妇产科杂志, 2018, 53 (12): 855-859. DOI: 10.3760/cma.j.issn.0529-567x.2018.12.010.
Zhang LM, Yang YN, Zhang RX, et al. Comparison of the etiological constitution of two and three or more recurrent miscarriage[J]. Chin J Obstet Gynecol, 2018, 53 (12): 855-859. DOI: 10.3760/cma.j.issn.0529-567x.2018. 12.010.
[7] Sarig G, Younis JS, Hoffman R, et al. Thrombophilia is common in women with idiopathic pregnancy loss and is associated with late pregnancy wastage [J]. Fertil Steril, 2002, 77 (2): 342-347. DOI: 10.1016/s0015-0282(01)02971-5.
[8] Mitić G, Novakov Mikić A, Povazan L, et al. Thromboprophylaxis implementation during pregnancy in women with recurrent foetal losses and thrombophilia [J]. Med Pregl, 2011, 64 (9/10): 471-475.
[9] 李洁. 2016年中国"复发性流产诊治的专家共识"与2017年欧洲"复发性流产诊治指南"的解读 [J]. 实用妇产科杂志, 2018, 34 (11): 822-825.
Li J. Interpretation of 2016 "expert consensus on the diagnosis and treatment of recurrent abortion" and european "guidelines for the diagnosis and treatment of recurrent abortion" in 2017 [J]. J Pract Obstet Gynecol, 2018, 34 (11): 822-825.
[10] 低分子肝素防治自然流产中国专家共识编写组. 低分子肝素防治自然流产中国专家共识(2018年版) [J]. 中华生殖与避孕杂志, 2018, 38 (9): 701-708. DOI: 10.3760/cma.j.issn.2096-2916.2018.09.001.
Chinese Experts Consensus Group on Low Molecular Weight Heparin for Prevention and Treatment of Spontaneous Abortion. Chinese experts consensus on prevention and treatment of spontaneous abortion with low molecular weight heparin (2018)[J]. Chin J Reprod Contracep, 2018, 38 (9): 701-708. DOI: 10.3760/cma.j.issn.2096-2916. 2018.09.001.
[11] Liu X, Chen Y, Ye C, et al. Hereditary thrombophilia and recurrent pregnancy loss: a systematic review and meta-analysis [J]. Hum Reprod, 2021, 36 (5): 1213-1229. DOI: 10.1093/humrep/deab010.
[12] 李凡, 乔宠. 复发性流产患者易栓症的筛查 [J]. 中国实用妇科与产科杂志, 2020, 36 (11): 1054-1057. DOI: 10.19538/j.fk2020110106.
Li F, Qiao C. Attention should be paid to the screening and diagnosis of thrombophilia in patients with recurrent spontaneous abortion [J]. Chin J Pract Gynecol Obstet, 2020, 36 (11): 1054-1057. DOI: 10.19538/j.fk2020110106.
[13] 王统菲, 贺立颖, 刘志兰, 等. 重视复发性流产患者的血栓前状态诊断 [J]. 妇产与遗传(电子版), 2015, 5 (3): 37-43. DOI: 10.3868/j.issn.2095-1558.2015.03.009.
Wang TF, He LY, Liu ZL, et al. Pay attention to the diagnosis of prethrombotic status in patients with recurrent abortion[J]. Obstetrics-Gynecology and Genetics (Electronic Edition), 2015, 5 (3): 37-43. DOI: 10.3868/j.issn.2095-1558.2015.03.009.
[14] Ormesher L, Simcox L, Tower C, et al. Management of inherited thrombophilia in pregnancy [J]. Womens Health (Lond), 2016, 12 (4): 433-441. DOI: 10.1177/1745505716653702.
[15] 王晓燕, 朱铁楠, 赵永强, 等. 汉族人群蛋白C、蛋白S和抗凝血酶活性水平及活性缺乏发生率的研究[J]. 中华血液学杂志, 2012, 33 (2): 127-130. DOI: 10.3760/cma.j.issn.0253- 2727.2012.02.015.
Wang XY, Zhu TN, Zhao YQ, et al. The activity levels and prevalence of deficiency of protein C, protein S and antithrombin in Chinese Han population [J]. Chin J Hemat, 2012, 33 (2): 127-130. DOI: 10.3760/cma.j.issn.0253-2727. 2012.02.015.
[16] 陈灿明, 王奕芳, 魏桂兰, 等. 复发性流产血栓前状态病因学及治疗研究进展 [J]. 国际生殖健康/计划生育杂志, 2018, 37 (2): 150-153. DOI: 10.3969/j.issn.1674-1889.2018.02.015.
Chen CM, Wang YF, Wei GL, et al. Prethrombotic state of recurrent spontaneous abortion and its treatment: a mini review [J]. J Int Reprod Health/Fam Plann, 2018, 37 (2): 150-153. DOI: 10.3969/j.issn.1674-1889.2018.02.015.
[17] 赵莹琰. 凝血-纤溶系统相关因子与复发性流产的关联研究 [D]. 苏州: 苏州大学, 2019. DOI: 10.27351/d.cnki.gszhu. 2019.001490.
Zhao YY. Association between coagulation-fibrinolysis system correlation factors and recurrent spontaneous abortion [D]. Suzhou: Suzhou University, 2019. DOI: 10. 27351/d.cnki.gszhu.2019.001490.
[18] 连岩, 王谢桐. 遗传性易栓症的妊娠期筛查与抗凝治疗评价[J]. 中国实用妇科与产科杂志, 2017, 33 (7): 678-684. DOI: 10.19538/j.fk2017070105.
Lian Y, Wang XT. Evaluation of the screening and anticoagulation therapy for inherited thrombophilias in pregnancy [J]. Chin J Pract Gynecol Obstet, 2017, 33 (7): 678-684. DOI: 10.19538/j.fk2017070105.
[19] Simcox LE, Ormesher L, Tower C, et al. Thrombophilia and pregnancy complications [J]. Int J Mol Sci, 2015, 16 (12): 28418-28428. DOI: 10.3390/ijms161226104.
[20] Rey E, Kahn SR, David M, et al. Thrombophilic disorders and fetal loss: a meta-analysis [J]. Lancet, 2003, 361 (9361): 901-908. DOI: 10.1016/S0140-6736(03)12771-7.
[21] 刘志兰, 康晓敏, 张晓欣, 等. 复发性自然流产1101例病因分析 [J]. 上海交通大学学报(医学版), 2015, 35 (3): 396-401,417. DOI: 11.3969/j.issn.1674-8115.2015.03.018.
Liu ZL, Kang XM, Zhang XX, et al. Analysis of etiology of 1101 cases of recurrent spontaneous abortion [J]. J Shanghai Jiao Tong Univ Med Sci, 2015, 35 (3): 396-401,417. DOI: 11. 3969/j.issn.1674-8115.2015.03.018.
[22] American College of Obstetricians and Gynecologists Women's Health Care Physicians. ACOG Practice Bulletin No. 138: Inherited thrombophilias in pregnancy [J]. Obstet Gynecol, 2013, 122 (3): 706-717. DOI: 10.1097/01.AOG. 0000433981.36184.4e.
[23] Margaglione M, Grandone E. Population genetics of venous thromboembolism. A narrative review [J]. Thromb Haemost, 2011, 105 (2): 221-231. DOI: 10.1160/TH10-08-0510.
[24] Farahmand K, Totonchi M, Hashemi M, et al. Thrombophilic genes alterations as risk factor for recurrent pregnancy loss [J]. J Matern Fetal Neonatal Med, 2016, 29 (8): 1269-1273. DOI: 10.3109/14767058.2015.1044431.
[25] Kujovich JL. Factor Ⅴ Leiden thrombophilia [J]. Genet Med, 2011, 13(1): 1-16. DOI: 10.1097/GIM.0b013e3181faa0f2.
[26] 王曌华, 张建平. 血栓前状态与复发性流产及抗凝治疗 [J]. 中国实用妇科与产科杂志, 2013, 29 (2): 102-106.
Wang ZH, Zhang JP. Prethrombotic status and recurrent abortion and anticoagulant therapy [J]. Chin J Pract Gynecol Obstet, 2013, 29 (2): 102-106.
[27] Eslami MM, Khalili M, Soufizomorrod M, et al. Factor Ⅴ Leiden 1691G>A mutation and the risk of recurrent pregnancy loss (RPL): systematic review and meta-analysis [J]. Thromb J, 2020, 18: 11. DOI: 10.1186/s12959-020-00224-z.
[28] Sergi C, Al Jishi T, Walker M. Factor Ⅴ Leiden mutation in women with early recurrent pregnancy loss: a meta-analysis and systematic review of the causal association [J]. Arch Gynecol Obstet, 2015, 291 (3): 671-679. DOI: 10. 1007/s00404-014-3443-x.
[29] Rodger MA, Betancourt MT, Clark P, et al. The association of factor Ⅴ leiden and prothrombin gene mutation and placenta-mediated pregnancy complications: a systematic review and meta-analysis of prospective cohort studies [J]. PLoS Med, 2010, 7 (6): e1000292. DOI: 10.1371/journal.pmed. 1000292.
[30] 徐勇, 霍梅, 方红辉. 习惯性流产妇女活化的蛋白C抵抗、凝血因子Ⅴ基因多态性与血栓前状态的关系研究[J]. 中国实验诊断学, 2002, 6 (5): 283-286. DOI: 10.3969/j.issn. 1007-4287.2002.05.001.
Xu Y, Huo M, Fang HH. Association of activated protein resistance and coagulation factor Ⅴ gene polymorphism with prethrombotic in habitual abortion women [J]. Chin J Lab Diagn, 2002, 6 (5): 283-286. DOI: 10.3969/j.issn.1007-4287.2002.05.001.
[31] 李晓梅, 张友忠, 许燕雪, 等. MTHFR基因C677T位点多态性与不明原因重复性自然流产的相关性[J]. 中华医学遗传学杂志, 2004, 21 (1): 39-42. DOI: 10.3760/j.issn:1003-9406. 2004.01.010.
Li XM, Zhang YZ, Xu YX, et al. Study on the relationship of MTHFR polymorphisms with unexplained recurrent spontaneous abortion [J]. Chin J Med Genet, 2004, 21 (1): 39-42. DOI: 10.3760/j.issn:1003-9406.2004.01.010.
[32] Ren A, Wang J. Methylenetetrahydrofolate reductase C677T polymorphism and the risk of unexplained recurrent pregnancy loss: a meta-analysis [J]. Fertil Steril, 2006, 86 (6): 1716-1722. DOI: 10.1016/j.fertnstert.2006.05.052.
[33] Hickey SE, Curry CJ, Toriello HV. ACMG Practice Guideline: lack of evidence for MTHFR polymorphism testing [J]. Genet Med, 2013, 15 (2): 153-156. DOI: 10.1038/gim. 2012.165.
[34] Lissalde-Lavigne G, Fabbro-Peray P, Cochery-Nouvellon E, et al. Factor Ⅴ Leiden and prothrombin G20210A polymorphisms as risk factors for miscarriage during a first intended pregnancy: the matched case-control 'NOHA first' study [J]. J Thromb Haemost, 2005, 3 (10): 2178-2184. DOI: 10.1111/j.1538-7836.2005.01581.x.
[35] Gao H, Tao FB. Prothrombin G20210A mutation is associated with recurrent pregnancy loss: a systematic review and meta-analysis update [J]. Thromb Res, 2015, 135 (2): 339-346. DOI: 10.1016/j.thromres.2014.12.001.
[36] Sonne SR, Bhalla VK, Barman SA, et al. Hyperhomocysteinemia is detrimental to pregnancy in mice and is associated with preterm birth[J]. Biochim Biophys Acta, 2013, 1832 (8): 1149-1158. DOI: 10.1016/j.bbadis.2013.04.006.
[37] Wu W, Shen O, Qin Y, et al. Methylenetetrahydrofolate reductase C677T polymorphism and the risk of male infertility: a meta-analysis [J]. Int J Androl, 2012, 35(1): 18-24. DOI: 10.1111/j.1365-2605.2011.01147.x.
[38] Ivanov P, Komsa-Penkova R, Konova E, et al. Combined thrombophilic factors among women with late recurrent spontaneous abortions [J]. Akush Ginekol (Sofiia), 2011, 50 (3): 8-12.
[39] 中华医学会血液学分会血栓与止血学组. 易栓症诊断中国专家共识(2012年版)[J]. 中华血液学杂志, 2012, 33 (11): 982. DOI: 10.3760/cma.j.issn.0253-2727.2012.11.024.
Thrombosis and Hemostatic Group, Hematology Branch of Chinese Medical Society. The Chinese expert consensus on the diagnosis of easy embolia (2012)[J]. Chin J Hematol, 2012, 33 (11): 982. DOI: 10.3760/cma.j.issn.0253-2727.2012. 11.024.
[40] 胡立豪, 张建平. 低分子肝素在复发性流产中的应用及监测[J]. 中国实用妇科与产科杂志, 2020, 36 (11): 1057-1061. DOI: 10.19538/j.fk2020110107.
Hu LH, Zhang JP. Application and monitoring of LMWH in patients with RSA[J]. Chin J Pract Gynecol Obstet, 2020, 36 (11): 1057-1061. DOI: 10.19538/j.fk2020110107.
[41] 曹轶磊, 赵爱民. 高凝状态的习惯性流产的病因机制 [J]. 中国妇幼保健, 2014, 29 (10): 1630-1633. DOI: 10.7620/zgfybj.j.issn.1001-4411.2014.10.61.
Cao YL, Zhao AM. Etiological mechanism of habitual abortion in a hypercoagulation state[J]. Matern Child Health Care China, 2014, 29 (10): 1630-1633. DOI: 10.7620/zgfybj.j.issn.1001-4411.2014.10.61.
[42] Li X, Liu Y, Zhang R, et al. Meta-analysis of the association between plasminogen activator inhibitor-1 4G/5G polymorphism and recurrent pregnancy loss [J]. Med Sci Monit, 2015, 21: 1051-1056. DOI: 10.12659/MSM.892898.
[43] Jung JH, Kim JH, Song GG, et al. Association of the F13A1 Val34Leu polymorphism and recurrent pregnancy loss: a meta-analysis [J]. Eur J Obstet Gynecol Reprod Biol, 2017, 215: 234-240. DOI: 10.1016/j.ejogrb.2017.06.032.
[44] Ali A, Mohan P, Kareem H, et al. Elevated factor Ⅷ levels and shortened APTT in recurrent abortions [J]. J Clin Diagn Res, 2016, 10(1): EC04-06. DOI: 10.7860/JCDR/2016/17841.7080.
[45] 欧宁江, 汤敏中. 遗传性纤维蛋白原缺陷症的研究进展 [J]. 中国实验血液学杂志, 2014, 22 (4): 1188-1192. DOI: 10.7534/j.issn.1009-2137.2014.04.058.
Ou NJ, Tang MZ. Research progress on hereditary fibrinogen abnormalities [J]. J Experimental Hematol, 2014, 22 (4): 1188-1192. DOI: 10.7534/j.issn.1009-2137.2014.04.058.
[46] Hayes T. Dysfibrinogenemia and thrombosis[J]. Arch Pathol Lab Med, 2002, 126 (11): 1387-1390. DOI: 10.5858/2002-126-1387-DAT.
[47] Pike GN, Bolton-Maggs PH. Factor deficiencies in pregnancy[J]. Hematol Oncol Clin North Am, 2011, 25 (2): 359-378, viii-ix. DOI: 10.1016/j.hoc.2011.01.007.
[48] Alijotas-Reig J, Esteve-Valverde E, Ferrer-Oliveras R, et al. Comparative study of obstetric antiphospholipid syndrome (OAPS) and non-criteria obstetric APS (NC-OAPS): report of 1640 cases from the EUROAPS registry [J]. Rheumatology (Oxford), 2020, 59 (6): 1306-1314. DOI: 10.1093/rheumatology/ kez419.
[49] McNamee K, Dawood F, Farquharson R. Recurrent miscarriage and thrombophilia: an update [J]. Curr Opin Obstet Gynecol, 2012, 24 (4): 229-234. DOI: 10.1097/GCO. 0b013e328355 85dc.
[50] 中华医学会围产医学分会. 产科抗磷脂综合征诊断与处理专家共识(2020年版)[J]. 中华围产医学杂志, 2020, 23(8): 517-522. DOI: 10.3760/cma.j.cn113903-20200402-00299.
Society of Perinatal Medicine, Chinese Medical Association. Expert consensus on diagnosis and management of obstetric antiphospholipid syndrome (2020)[J]. Chin J Perinat Med, 2020, 23 (8): 517-522. DOI: 10.3760/cma.j.cn113903-20200402-00299.
[51] 中华医学会风湿学分会. 抗磷脂综合征诊断和治疗指南(2011年版) [J]. 中华风湿病学杂志, 2011, 15 (6): 407-410. DOI: 10.3760/cma.j.issn.1007-7480.2011.06.012.
Rheumatology branch of Chinese Medical Association. Guidelines for the diagnosis and treatment of antiphospholipid syndrome(2011) [J]. Chin J Rheumatol, 2011, 15 (6): 407-410. DOI: 10.3760/cma.j.issn.1007-7480.2011.06.012.
[52] 中国医师协会风湿免疫科医师分会自身抗体检测专业委员会, 国家风湿病数据中心, 国家免疫疾病临床医学研究中心. 抗磷脂抗体检测的临床应用专家共识(2019年版)[J]. 中华内科杂志, 2019, 58 (7): 496-500. DOI: 10.3760/cma.j.issn.0578-1426.2019.07.003.
The Committee of the Autoantibodies Detection of Rheumatology and Immunology Physicians Committee of Chinese Medical Doctor Association. Experts consensus on clinical application of antiphospholipid antibodies detection(2019) [J]. Chin J Intern Med, 2019, 58 (7): 496-500. DOI: 10.3760/cma.j.issn.0578-1426.2019.07.003.
[53] Babin JL, Traylor KL, Witt DM. Laboratory monitoring of low-molecular-weight heparin and fondaparinux [J]. Semin Thromb Hemost, 2017, 43 (3): 261-269. DOI: 10.1055/s-0036-1581129.
[54] Tonello M, Mattia E, Del Ross T, et al. Clinical value of anti-domain I-β2Glycoprotein 1 antibodies in antiphospholipid antibody carriers. A single centre, prospective observational follow-up study [J]. Clin Chim Acta, 2018, 485: 74-78. DOI: 10.5468/ogs.2018.61.3.359.
[55] 冯莹. 抗磷脂综合征的临床管理[J]. 临床血液学杂志, 2017, 30 (1): 8-11. DOI: 10.13201/j.issn.1004-2806.2017.01.003.
Feng Y. Clinical management of antiphospholipid syndrome [J]. J Clin Hemat, 2017, 30 (1): 8-11. DOI: 10. 13201/j.issn.1004-2806.2017.01.003.
[56] Tektonidou MG, Andreoli L, Limper M, et al. EULAR recommendations for the management of antiphospholipid syndrome in adults [J]. Ann Rheum Dis, 2019, 78 (10): 1296-1304. DOI: 10.1136/annrheumdis-2019-215213.
[57] 中国营养学会骨健康与营养专业委员会, 中华医学会肠外肠内营养学分会, 中国老年医学学会北方慢性病防治分会. 高同型半胱氨酸血症诊疗专家共识(2020年版) [J]. 肿瘤代谢与营养电子杂志, 2020, 7 (3): 283-288. DOI: 10.16689/j.cnki.cn11-9349/r.2020.03.007.
Bone health and Nutrition Committee of Chinese Nutrition Society. Expert consensus on hyperhomocysteinemia (2020) [J]. Elect J Metab Nutrit Cancer, 2020, 7 (3): 283-288. DOI: 10. 16689/j.cnki.cn11-9349/r.2020.03.007.
[58] 郭宏霞, 杨孜. 自身免疫性疾病与病理妊娠 [J]. 中国实用妇科与产科杂志, 2014, 30 (6): 489-492. DOI: 10.7504/fk2014050124.
Guo HX, Yang Z. Autoimmune diseases and pathologic pregnancy [J]. Chin J Pract Gynecol Obstet, 2014, 30(6): 489-492. DOI: 10.7504/fk2014050124.
[59] Zhan Z, Yang Y, Zhan Y, et al. Fetal outcomes and associated factors of adverse outcomes of pregnancy in southern Chinese women with systemic lupus erythematosus [J]. PLoS One, 2017, 12(4): e0176457. DOI: 10.1371/journal.pone. 0176457.
[60] Bundhun PK, Soogund MZ, Huang F. Impact of systemic lupus erythematosus on maternal and fetal outcomes following pregnancy: a meta-analysis of studies published between years 2001-2016 [J]. J Autoimmun, 2017, 79: 17-27. DOI: 10.1016/j.jaut.2017.02.009.
[61] Ostensen M, Clowse M. Pathogenesis of pregnancy complications in systemic lupus erythematosus[J]. Curr Opin Rheumatol, 2013, 25 (5): 591-596. DOI: 10.1097/BOR.0b013e328363ebf7.
[62] 吕良敬, 倪若柠. 重视复发性流产患者中未分化结缔组织病的诊断[J]. 诊断学理论与实践, 2018, 17 (3): 235-237. DOI: 10.16150/j.1671-2870.2018.03.001.
Lyu LJ, Ni RN. Emphasis is placed on the diagnosis of undifferentiated connective tissue disease in patients with recurrent abortion[J]. J Diagn Concepts Pract, 2018, 17 (3): 235-237. DOI: 10.16150/j.1671-2870.2018.03.001.
[63] 倪若柠. 未分化结缔组织病合并妊娠的预后 [D]. 上海: 上海交通大学, 2019. DOI: 10.27307/d.cnki.gsjtu.2019.000679.
Ni RN. Prognosis of undifferentiated connective tissue disease complicated with pregnancy [D]. Shanghai: Shanghai Jiao Tong University, 2019. DOI: 10.27307/d.cnki.gsjtu.2019. 000679.
[64] Spinillo A, Beneventi F, Locatelli E, et al. The impact of unrecognized autoimmune rheumatic diseases on the incidence of preeclampsia and fetal growth restriction: a longitudinal cohort study [J]. BMC Pregnancy Childbirth, 2016, 16 (1): 313. DOI: 10.1186/s12884-016-1076-8.
[65] Spinillo A, Beneventi F, Epis OM, et al. The effect of newly diagnosed undifferentiated connective tissue disease on pregnancy outcome [J]. Am J Obstet Gynecol, 2008, 199 (6): 632.e1-6. DOI: 10.1016/j.ajog.2008.05.008.
[66] Upala S, Yong WC, Sanguankeo A. Association between primary Sjögren's syndrome and pregnancy complications: a systematic review and meta-analysis [J]. Clin Rheumatol, 2016, 35 (8): 1949-1955. DOI: 10.1007/s10067-016-3323-9.
[67] Bharti B, Lee SJ, Lindsay SP, et al. Disease severity and pregnancy outcomes in women with rheumatoid arthritis: results from the organization of teratologyinformation specialists autoimmune diseases in pregnancy project [J]. J Rheumatol, 2015, 42 (8): 1376-1382. DOI: 10.3899/jrheum. 140583.
[68] Romagnuolo I, Attanasio M, Cozzolino M, et al. Thrombin potential and traditional coagulation assay: are they useful in exploring recurrent pregnancy loss risk? [J]. Blood Coagul Fibrinolysis, 2018, 29 (2): 160-166. DOI: 10. 1097/MBC.0000000000000675.
[69] 急性出血性凝血功能障碍诊治专家共识组, 邵勉, 薛明明,等. 急性出血性凝血功能障碍诊治专家共识(2020年版) [J]. 中华急诊医学杂志, 2020, 29 (6): 780-787. DOI: 10.3760/cma.j.issn.1671-0282.2020.06.007.
Expert consensus group on the diagnosis and treatment of acute hemorrhagic coagulation dysfunction. Expert consensus on the diagnosis and treatment of acute hemorrhagic coagulation dysfunction (2020) [J]. Chin J Emerg Med, 2020, 29 (6): 780-787. DOI: 10.3760/cma.j.issn. 1671-0282.2020.06.007.
[70] Wu Y, Qiao Y, Zhang Y, et al. Trimester-specific reference intervals of TAT, TM, tPAI-C and PIC for healthy Chinese pregnant women [J]. J Obstet Gynaecol Res, 2021, 47 (1): 368-374. DOI: 10.1111/jog.14536.
[71] Yang J, Yang H, Tang A, et al. Trimester-specific reference intervals for kaolin-activated thromboelastography (TEG®) in healthy Chinese pregnant women [J]. Thromb Res, 2019, 184: 81-85. DOI: 10.1016/j.thromres.2019.09.030.
[72] 樊凤娇, 宋睿, 吴秉毅, 等. 孕期凝血功能参考区间的建立及在静脉栓塞和产后出血中的运用[J]. 广东医学, 2019, 40(2): 250-255. DOI: 10.13820/j.cnki.gdyx.20182192.
Fan FJ, Song R, Wu BY, et al. Establishment of the reference interval of pregnancy coagulation function and its application in venous embolism and postpartum hemorrhage [J]. Guangdong Med J, 2019, 40 (2): 250-255. DOI: 10.13820/j.cnki.gdyx.20182192.
[73] Grandone E, Villani M, Tiscia GL. Aspirin and heparin in pregnancy[J]. Expert Opin Pharmacother, 2015, 16 (12): 1793-1803. DOI: 10.1517/14656566.2015.1066335.
[74] Giancotti A, La Torre R, Spagnuolo A, et al. Efficacy of three different antithrombotic regimens on pregnancy outcome in pregnant women affected by recurrent pregnancy loss [J]. J Matern Fetal Neonatal Med, 2012, 25 (7): 1191-1194. DOI: 10.3109/14767058.2011.600366.
[75] Dendrinos S, Sakkas E, Makrakis E. Low-molecular-weight heparin versus intravenous immunoglobulin for recurrent abortion associated with antiphospholipid antibody syndrome [J]. Int J Gynaecol Obstet, 2009, 104 (3): 223-225. DOI: 10.1016/j.ijgo.2008.11.010.
[76] Triolo G, Ferrante A, Ciccia F, et al. Randomized study of subcutaneous low molecular weight heparin plus aspirin versus intravenous immunoglobulin in the treatment of recurrent fetal loss associated with antiphospholipid antibodies [J]. Arthritis Rheum, 2003, 48 (3): 728-731. DOI: 10.1002/art.10957.
[77] 石慧, 杨程德. 2019年欧洲抗风湿病联盟成人抗磷脂综合征治疗推荐解读: 高风险抗体谱的定义和抗凝方案细化 [J]. 中华风湿病学杂志, 2020, 24 (2): 73-78. DOI: 10. 3760/cma.j.issn.1007-7480.2020.02.001.
Shi H, Yang CD. Interpretation of 2019 European League Against Rheumatism recommendations for the management of antiphospholipid syndrome in adults: definition of high-risk antiphospholipid antibodies profile and refinement of anticoagulation regimen [J]. Chin J Rheumatol, 2020, 24 (2): 73-78. DOI: 10.3760/cma.j.issn.1007-7480.2020.02.001.
[78] Amengual O, Fujita D, Ota E, et al. Primary prophylaxis to prevent obstetric complications in asymptomatic women with antiphospholipid antibodies: a systematic review [J]. Lupus, 2015, 24 (11): 1135-1142. DOI: 10.1177/0961203315578765.
[79] Gray E, Hogwood J, Mulloy B. The anticoagulant and antithrombotic mechanisms of heparin [J]. Handb Exp Pharmacol, 2012 (207): 43-61. DOI: 10.1007/978-3-642-23056-1_3.
[80] Simeone R, Giacomello R, Bruno G, et al. Thrombogenesis in thrombophilic pregnancy: evaluation of low-molecular-weight heparin prophylaxis [J]. Acta Haematol, 2017, 137 (4): 201-206. DOI: 10.1159/000467385.
[81] Lin A, Vazquez SR, Jones AE, et al. Description of anti-Xa monitoring practices during low molecular weight heparin use [J]. J Thromb Thrombolysis, 2019, 48 (4): 623-628. DOI: 10.1007/s11239-019-01920-y.
[82] 复发性流产合并风湿免疫病免疫抑制剂应用中国专家共识编写组. 复发性流产合并风湿免疫病免疫抑制剂应用中国专家共识 [J]. 中华生殖与避孕杂志, 2020, 40 (7): 527-534. DOI: 10.3760/cma.j.cn101441-20200419-00226.
Chinese Experts Consensus Group on Application of Immunosuppressants in Recurrent Spontaneous Abortion Complicated with Rheumatic Diseases. Chinese experts consensus on application of immunosuppressants in recurrent spontaneous abortion complicated with rheumatic diseases [J]. Chin J Reprod Contracep, 2020, 40 (7): 527-534. DOI: 10.3760/cma.j.cn101441-20200419-00226.
本文刊登于《中华生殖与避孕杂志》
2021, 41(10): 861-875.
作者:国家妇幼健康研究会生殖免疫学专业委员会专家共识编写组
通信作者:
赵爱民,Email:Zamzkh0526@126. com,电话:+86-21-68383064;韦相才, Email:Dxcwei@163.com,电话:+86-20-39151663
本文来源: 中华生殖与避孕杂志
 妇产科在线APP下载
妇产科在线APP下载













