作者:张师前,林仲秋,张颖
通讯作者:林仲秋,中山大学孙逸仙纪念医院,广东 广州 510120,电子信箱:lin-zhongqiu@163.com;张师前,山东大学齐鲁医院,山东 济南 250012,电子信箱:r370112@126.com
外阴、阴道黑色素瘤是罕见的妇科恶性肿瘤,由于发病率极低,缺乏前瞻性临床试验依据,治疗原则大多参考皮肤型黑色素瘤,但外阴、阴道黑色素瘤没有明确的高危因素,而且其与皮肤型黑色素瘤在分子生物学及基因变异类型方面互有特点,导致两者的预后迥异。
1、临床表现
外阴黑色素瘤的主要临床表现有外阴肿块、疼痛、出血和瘙痒等,少数患者无任何症状。病灶通常为不规则着色且边界不对称的结节、息肉、丘疹或斑点,表面可有溃疡。约20%的患者在初诊时有2个或以上的病灶[1]。大多数病灶有色素沉着,呈黑色或棕褐色、粉色、蓝色等,约25%的病灶呈无色素沉着[2]。病变好发于大小阴唇,其次是阴蒂和尿道周围。约15%的病灶位于外阴毛发覆盖区[3]。区域淋巴结(盆腔或腹股沟)转移率为9%~55%[4-6]。
外阴黑色素瘤常为新发病灶,需与色素痣鉴别,但应警惕色素痣的早期恶变症状[2]。鉴别要点归纳为ABCDE原则,A(asymmetric)非对称性:色素病变不对称;B(border irregularity)边缘不规则:边缘有切迹或呈锯齿状,正常色素痣常为圆形或椭圆形;C(color variation)颜色改变:黑色素瘤的颜色较多,主要为污浊的黑色,也可呈褐、棕、白、红、蓝或粉色,正常色素痣常为单色;D(diameter)直径:黑色素瘤通常直径>5mm或短期内(几周或几个月内)明显增大;E(elevation)隆起:早期黑色素瘤的瘤体可有轻微隆起。对于长期存在并稳定的色素病变,应该留存图片资料,定期随访。任何绝经后新出现的外阴色素性病变均应行活检或切除,以排除黑色素瘤[7-8]。
阴道黑色素瘤最常见的症状是阴道流血,其次有阴道肿块、疼痛或异常排液等。约10%的患者无任何症状[9-10]。病灶通常为不均匀的色素斑块、溃疡或息肉样病变,多位于阴道下1/3段,其次是上1/3段[9,11]。病变以阴道前壁居多,其次为侧壁及后壁[10-11]。病灶常为单发,20%的患者初诊时有2个或以上的病灶[9]。病灶多有色素沉着,30%的病灶可呈无色素沉着。区域淋巴结(盆腔或腹股沟)转移率为25%~50%[3,5-6,12]。
推荐意见:在外阴及阴道区域,新发且近期增大的、不对称色素沉着的病灶需警惕黑色素瘤。
2诊断
根据病史及临床表现,对原发病灶、周围受累组织及区域淋巴结的视诊和触诊是外阴、阴道黑色素瘤的常规检查方法。病灶的组织病理学检查可以明确诊断。外阴色素性病变可通过皮肤镜协助诊断[7]。根据情况选择腹股沟淋巴结超声、胸部CT、腹盆腔增强CT或MRI、膀胱镜/直肠镜、颅脑增强MRI、全身骨扫描或PET-CT等检查,评估局部侵袭及远处转移,用以评估分期。
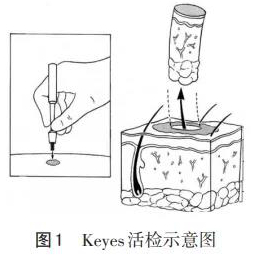
2.1 病灶活检 对可疑的色素性病灶建议完整切除,距周边切缘0.1~0.3cm[13-14]。病灶较大无法完整切除者,可行部分切取活检。阴道镜指导下钳夹活检,可提高阳性诊断率。外阴病灶较大者可考虑打孔活检(punch biopsy),应用直径4~6mm的Keyes活检器(图1),完整获取深度约4mm的圆柱形上皮组织[8]。不推荐冰冻病理检查[15]。
2.2 影像学检查 腹股沟淋巴结超声检查可对浅表淋巴结的形态、边缘、内部结构及异常血流进行评估,协助判定腹股沟淋巴结转移情况(敏感度86%,特异度96%)。超声联合细针穿刺活检(FNAC),评估阳性淋巴结的敏感度达93%,特异度达100%[16]。MRI平扫及增强扫描能清晰显示病灶及周围组织的浸润情况,可为手术方案的制定提供重要信息[17]。CT平扫及增强扫描对黑色素瘤的远处转移、分期及疗效评估具有重要参考价值。推荐存在淋巴转移或远处转移的患者,进行颅脑增强MRI[7]。
2.3 血清肿瘤标志物 黑色素瘤缺乏特异性的血清肿瘤标志物。有研究发现,乳酸脱氢酶(LDH)升高可能预示复发或转移。在美国癌症联合委员会(AJCC)的TNM分期中,LDH是M分期的重要指标[18]。早期黑色素瘤患者LDH敏感度低。循证医学证据表明,LDH是Ⅳ期患者的独立预后因素,LDH升高预示更低的生存率[19]。
推荐意见:推荐完整切除活检,病灶较大时可行Keyes活检或部分切取活检。推荐腹股沟淋巴结超声、胸部CT和腹盆腔增强CT作为主要的影像学检查方法。存在淋巴或远处转移者需行颅脑增强MRI。晚期、转移患者检测LDH有一定意义。
3转移及组织病理学
3.1 转移途径 外阴、阴道黑色素瘤除直接浸润外,可通过淋巴或血行转移。约2/3的转移局限于区域淋巴结。外阴的区域引流淋巴结主要是腹股沟淋巴结;阴道上1/3段主要引流至盆腔淋巴结,阴道下1/3主要引流至腹股沟淋巴结,阴道中1/3段引流两者兼有。一般认为,单侧病灶引流至同侧的区域淋巴结,而中线部位的病灶可引流至双侧腹股沟淋巴结。区域转移主要表现为卫星转移、中途转移/移行转移、微卫星转移和淋巴结转移[7]。
卫星转移(satellite)是指位于黑色素瘤原发灶周围(直径2cm内)的肉眼可见转移灶。中途转移/移行转移(in-transit metastasis)是指位于黑色素瘤原发灶(直径2cm外)及首站淋巴结之间的肉眼可见转移灶。微卫星转移(microsatellites)是指显微镜下的转移灶,邻近或深于原发灶,但与原发灶不相连。2016年美国病理医师协会(CAP)将微卫星转移定义为,在深于原发灶0.3mm以上的真皮网状层、脂膜或脉管中,出现直径>0.05mm的瘤巢;2017年AJCC对转移灶的大小和距离不再要求。上述3种转移在外阴、阴道黑色素瘤中研究较少。淋巴结转移是影响外阴及阴道黑色素瘤预后的独立危险因素[5-6]。
3.2 病理报告规范 除肿瘤的部位及大小外,外阴、阴道黑色素瘤的病理报告应包括以下内容:(1)组织学类型。(2)肿瘤的Breslow厚度(mm)。(3)有无溃疡。(4)有丝分裂率。(5)有无微卫星灶。(6)侧切缘及深切缘情况。病理报告还需体现其他指标如脉管癌栓、神经侵犯、肿瘤浸润淋巴细胞等。免疫组化检测和基因检测可协助诊断黑色素瘤。切除淋巴结者,需报告淋巴结数目、转移个数和有无淋巴结包膜外扩散[7,20]。
黑色素瘤组织学类型主要包括浅表扩散型、结节型、恶性雀斑型和肢端雀斑型4种,少见的有上皮样、梭形细胞样、促纤维组织增生性、浆细胞样、气球样细胞和混合型黑色素瘤等。外阴黑色素瘤以浅表扩散型、结节型和肢端雀斑型为主。阴道黑色素瘤以结节型为主[5,21]。浅表扩散型黑色素瘤预后相对较好,而结节型黑色素瘤预后较差[5]。
Breslow厚度用于衡量黑色素瘤的垂直浸润深度,是AJCC分期的主要指标。在非溃疡性病变中,Breslow厚度是指表皮颗粒层至肿瘤浸润最深处的垂直距离;在溃疡性病变中,Breslow厚度则指溃疡基底部至肿瘤浸润最深处的垂直距离。Breslow厚度值越大,预后越差[5]。
溃疡形成是黑色素瘤AJCC分期的重要指标,指除外手术活检等因素,显微镜下肿瘤表面组织缺损,伴有纤维素沉积或中性粒细胞浸润等炎症反应。溃疡形成提示预后较差[5]。有丝分裂率虽不再纳入外阴、阴道黑色素瘤分期,但对预后有重要意义。有丝分裂率≥2/mm2提示预后变差,>10/mm2提示预后更差[1,5-6]。
根据肿瘤浸润淋巴细胞的密度和范围分为:无、有但不活跃(局灶分布)、活跃(弥漫分布)。当肿瘤浸润淋巴细胞少时,提示外阴、阴道黑色素瘤的预后差[6]。肿瘤浸润淋巴细胞的病理诊断可用CD8+的细胞毒性T细胞进行免疫组化标记。
3.3 免疫组化检测 常用的黑色素瘤特征性标志物有S-100蛋白、HMB45、Melan A和酪氨酸酶等。黑色素瘤对S-100蛋白的敏感度最高,但特异度差。HMB45、Melan A和酪氨酸酶等特异度较高,但敏感度不一。由于黑色素瘤细胞的多样性,一般建议免疫组化选用2~3种特异度高的标志物,结合S-100蛋白综合分析[22]。黑色素瘤靶向治疗的相关标志物主要有PD-L1和BRAF VE1(V600E)2种,但目前尚无统一的指南或共识参考。PD-L1阳性(>5%)结合肿瘤浸润淋巴细胞高分布预示黑色素瘤的免疫治疗效果较好[23]。BRAF VE1在免疫组化中假阳性率太高,应考虑进行基因检测。
3.4 基因检测 基因检测既能辅助疑难病例的诊断,又能用于指导靶向药物的临床应用。建议所有存在淋巴结转移或远处转移的患者进行基因检测[7,15]。外阴、阴道黑色素瘤常见的基因异常类型为NRAS突变和KIT突变/扩增[24-25]。BRAF突变在外阴、阴道黑色素瘤中极少见。有研究发现,KIT突变主要存在于外阴黑色素瘤,在阴道黑色素瘤中少见,说明两者虽然在解剖结构上相近,但在发生学上不能完全归于一类。
推荐意见:需认识外阴、阴道各段区域淋巴转移路径,指导手术切除淋巴结部位和范围。规范的病理报告需包括常规病理项目和预后相关的组织学指标。相关免疫组化染色有助于诊断和鉴别诊断。推荐基因检测寻找相关治疗靶点。
4分期
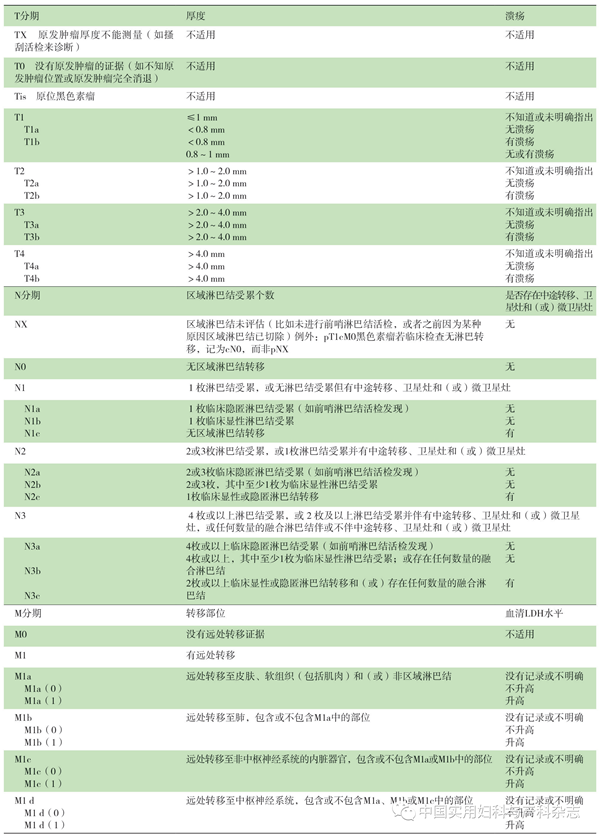
外阴黑色素瘤推荐采用AJCC的黑色素瘤TNM分期系统(第8版)[18]。见表1。
表1 黑色素瘤TNM分期(AJCC第8版)
阴道黑色素瘤目前尚无优化的推荐分期系统。Breslow厚度作为TNM分期的重要指标,目前有限的临床数据表明其与阴道黑色素瘤预后关系不大,所以AJCC分期系统不包括阴道黑色素瘤;肿瘤大小及淋巴转移作为阴道黑色素瘤的预后相关因素,却未体现于国际妇产科联盟(FIGO)阴道癌的分期系统。大多数研究将FIGO阴道癌分期及AJCC 2种分期系统同时用于阴道黑色素瘤的描述中[5-6,8]。黑色素瘤临床预后分期见表2。病理预后分期见表3。
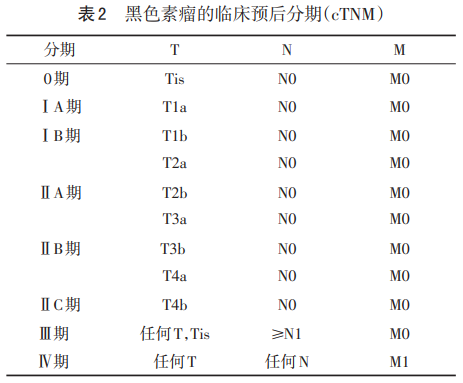

推荐意见:外阴黑色素瘤采用AJCC第8版的TNM黑色素瘤分期系统。阴道黑色素瘤尚无推荐的分期系统,可参考FIGO阴道癌及AJCC黑色素瘤2种分期系统。
5治疗
外阴、阴道黑色素瘤的方法治疗以手术为主。Ⅰ~Ⅱ期行肿瘤局部扩大切除术和前哨淋巴结活检术。Ⅲ期行肿瘤局部扩大切除术和区域淋巴结切除术。Ⅳ期治疗需个体化,若患者能耐受或可接受手术,建议肿瘤局部扩大切除术和区域淋巴结切除术及转移病灶切除术。不推荐Ⅰ期进行术后辅助治疗。Ⅱ期的术后辅助治疗尚有争议,尤其是具有高危因素的Ⅱ期,目前仍在临床试验中。手术切缘阳性者、Ⅲ~Ⅳ期及复发患者需进行全身辅助治疗[13-14,20-21]。
5.1 手术 既往无论外阴或阴道黑色素瘤的位置、大小或Breslow厚度等,均采用根治性切除手术(如单侧或全外阴切除术、全阴道切除术或联合盆腔廓清术)。但根治性切除手术范围大,术后并发症多,严重影响患者的生命质量。近年来多项回顾性研究表明,相比于切缘阴性的局部扩大切除术(wide local excision,WLE),根治性切除手术并未降低局部复发率或提高生存期[5,26]。WLE要求切缘距离肿瘤有一定距离,通常参考皮肤型黑色素瘤,但最佳的阴性切缘距离尚有争议。值得注意的是,切缘距离是指在手术时的测量值,并非病理组织学上的测量值。2019年欧洲多学科共识推荐:原位黑色素瘤(melanoma in situ,MIS),阴性切缘距离为0.5cm;Breslow厚度≤2mm,阴性切缘距离为1cm;Breslow厚度>2mm,阴性切缘距离为2cm[13]。2020年中国临床肿瘤学会(CSCO)仅提到生殖道黑色素瘤需保证阴性切缘,但未规定阴性切缘距离[3],推荐外阴黑色素瘤在Breslow厚度≤1mm时,阴性切缘距离为1cm;Breslow厚度为>1~4mm时,阴性切缘距离为2cm;Breslow厚度>4mm时,阴性切缘距离为>2cm。2021年NCCN在皮肤型黑色素瘤中推荐:MIS,阴性切缘距离为0.5~<1cm;Breslow厚度≤1mm,阴性切缘距离为1cm;Breslow厚度>1~2mm,阴性切缘距离为>1~2cm;Breslow厚度>2mm,阴性切缘距离为>2cm[14]。若完整切除活检(切缘0.1~0.3cm)证实为黑色素瘤,需二次手术保证安全切缘距离。切缘状态是局部复发的重要因素,但对总生存期意义不大[27]。尚无证据表明更多的阴性切缘距离对预后有益。
由于外阴、阴道黑色素瘤病灶位置的特殊性,有时很难满足阴性切缘距离。手术具有明显的生存受益,若肿瘤累及盆腔器官且无法局部扩大切除时,盆腔廓清术势在必行。但阴性切缘距离应根据病灶解剖位置及患者的功能需求而个体化实施[13-14]。若未受侵犯且能够保证阴性切缘,外阴黑色素瘤不推荐预防性切除子宫及双附件。阴道黑色素瘤若病变广泛、弥散需行全阴道切除时,若非同时行阴道成形术,手术时需同时切除子宫±双附件。
淋巴结状态是评估预后和分期依据的重要因素。查体或影像学检查(CT、超声等)提示有阳性淋巴结(即Ⅲ期或以上),推荐行区域淋巴结切除术(complete lymph node dissection,CLND)[13-14]。手术要求完整切除受累淋巴结及周围组织。腹股沟淋巴结切除术包括腹股沟浅淋巴结和腹股沟深淋巴结,要求切除的淋巴结数量不少于10个。≥3个腹股沟淋巴结阳性或Cloquet淋巴结阳性,应考虑行盆腔淋巴结切除术[14,28]。推荐经腹膜外或腹腔镜途径。不推荐Ⅰ/Ⅱ期外阴、阴道黑色素瘤常规进行CLND[29]。
前哨淋巴结活检(SLNB)逐渐被推荐为Ⅰ/Ⅱ期外阴、阴道黑色素瘤的常规术式[28,30-31]。参考皮肤型黑色素瘤的诊疗指南,Breslow厚度<0.8mm且无溃疡时,不推荐行SLNB;Breslow厚度<0.8mm但有危险因素(溃疡或有丝分裂率≥2/mm2或淋巴脉管浸润中任一项)以及Breslow厚度0.8~1.0mm者,可考虑行SLNB;Breslow厚度>1.0mm时推荐行SLNB[14]。若SLNB为阴性,无需进一步处理。若SLNB为阳性,是否进行CLND有待商榷。DeCOG和MSLT-Ⅱ试验表明,SLNB阳性后进行CLND对患者无生存获益,反而增加手术并发症风险[32-33]。目前不推荐Ⅰ/Ⅱ期黑色素瘤在SLNB阳性后进行CLND,而是按照Ⅲ期予以术后辅助治疗。值得注意的是,MSLT-Ⅱ试验在切除组发现11.5%患者存在非前哨淋巴结转移,是局部复发的独立因素[33]。淋巴结区域超声监测不适用于所有SLNB阳性的患者,所以存在非前哨淋巴结转移危险因素(如包膜外延伸、>2个转移淋巴结、淋巴血管侵犯、微卫星转移和免疫抑制等)或无密切随访条件的患者,需要慎重考虑是否进行CLND[28]。
推荐意见:WLE是外阴、阴道黑色素瘤的主要手术方式。依据Breslow厚度决定阴性切缘距离。推荐Breslow厚度≤1mm,阴性切缘距离为1.0cm;Breslow厚度>1mm,阴性切缘距离为2.0cm。病灶广泛、弥散的阴道黑色素瘤推荐行全阴道±全子宫(±双附件)切除术。Ⅰ/Ⅱ期患者推荐WLE +SLNB。尚无证据支持SLNB微转移后施行CLND。Ⅲ/Ⅳ期患者推荐WLE +CLND。
5.2 放疗 放疗仅适用于无法手术的晚期患者或手术后复发、转移的患者。放疗可以控制局部病灶,降低局部复发率,但不改善无复发生存期(RFS)或总生存期(OS)。放射剂量通常为40~60Gy,放疗不良反应包括:脱皮、溃疡、生殖道瘘、淋巴瘘、直肠狭窄、下肢水肿等。手术后辅助放疗不改善生存期,不推荐放疗作为术后的辅助治疗[9,20,34-35]。局部晚期的患者可考虑放疗联合化疗或免疫治疗[36]。
推荐意见:放疗用于无法手术切除的晚期患者的初始治疗或手术后复发、转移的患者。不推荐术后常规补充放疗和术前放疗。局部晚期的患者可考虑放疗联合化疗或免疫治疗。
5.3 细胞因子
5.3.1 干扰素(IFN) IFN是第一个用于黑色素瘤辅助治疗的药物。高剂量IFN-α2b曾用于ⅡB~Ⅳ期高危黑色素瘤患者的术后辅助治疗,推荐治疗1年,具体用药方案为:静脉注射1500万U/m2 ,每周1~5d,共4周;然后皮下注射 900万U/m2 ,每周3次,共48周[15,37]。
目前有诸多关于单一干扰素或者联合化疗的前瞻性随机对照性研究。其中有研究表明,IFN可延长无复发生存期(RFS)[38-39];部分研究表明,IFN可延长总生存期(OS)[39];也有研究表明,IFN对RFS和OS无意义[40]。荟萃分析表明,高剂量IFN-α2b和聚乙二醇化IFN(长效)能明显延长RFS,但对OS无意义[41]。
IFN在外阴、阴道黑色素瘤中应用的研究很少。一项关于Ⅱ/Ⅲ期黏膜黑色素瘤术后3种处理方式(观察、高剂量IFN-α2b、替莫唑胺+顺铂化疗)的Ⅱ期临床试验,其中纳入了21例外阴黑色素瘤和19例阴道黑色素瘤,试验结果显示,3组患者的中位RFS分别为5.4、9.4、20.8个月,中位OS分别为21.2、40.4、48.7个月。治疗组中约1/5患者出现3或4级副反应,均在减量或中断治疗后好转。替莫唑胺+顺铂化疗的RFS和OS明显优于高剂量IFN-α2b(P<0.001;P=0.009)[38]。随后发表的Ⅲ期临床试验,进一步明确了替莫唑胺+顺铂化疗优于高剂量IFN-α2b[42]。
大量研究证明,免疫检查点抑制剂和靶向治疗明显提高了皮肤型黑色素瘤患者的生存期。虽然没有IFN与免疫检查点抑制剂或靶向治疗的对照研究,但是IFN已不再推荐为黑色素瘤的辅助治疗[13-14,43-44]。免疫检查点抑制剂和靶向治疗用于黏膜型黑色素瘤术后辅助治疗的前瞻性临床试验尚在进行中。鉴于黏膜型黑色素瘤的某些基因变异类型与皮肤型黑色素相似,免疫检查点抑制剂和靶向治疗同样推荐用于黏膜型黑色素瘤。
5.3.2 白介素-2(IL-2) 大剂量IL-2曾广泛用于治疗晚期转移性黑色素瘤,不足10%的患者达到完全缓解,10%的患者OS超过5年,甚至超过21年。总体来说,IL-2的有效率不足20%,平均OS为11~12个月[45-46]。瘤内注射IL-2适用于无法手术切除的黑色素瘤,局部病灶的完全缓解率可高达70%[47],瘤内注射IL-2的毒副反应相对轻微。IL-2目前作为二线治疗,推荐用于免疫检查点抑制剂和靶向治疗无效的黑色素瘤。
推荐意见:不推荐IFN作为外阴、阴道黑色素瘤的术后辅助治疗。瘤内注射IL-2适用于无法手术切除的外阴、阴道黑色素瘤。免疫检查点抑制剂和靶向治疗无效的黑色素瘤可考虑IL-2治疗。
5.4 化疗 化疗曾经是惟一可用于复发或转移黑色素瘤的全身治疗方法。目前皮肤型黑色素瘤的一线治疗首选免疫检查点抑制剂和靶向治疗,耐药时再考虑化疗。鉴于缺乏免疫检查点抑制剂和靶向治疗在黏膜型黑色素瘤应用有效的证据,化疗在外阴、阴道黑色素瘤中仍具有一定的地位。常用的化疗药物是氨烯咪胺(达卡巴嗪,DTIC)、替莫唑胺、福莫司汀、长春酰胺、顺铂、紫杉醇类、卡铂等。达卡巴嗪单药或联合化疗的有效率仅10%~20%,完全缓解率仅5%~12%[48-50]。Janco等[51]报道了2例外阴、阴道黑色素瘤,先行紫杉醇及卡铂±贝伐珠单抗新辅助化疗,缩小病灶后手术切除,术后再行紫杉醇及卡铂+贝伐珠单抗治疗,最终RFS分别2年和5年。外阴、阴道黑色素瘤术后辅助化疗尚有争议,有研究表明其可能会延长PFS,但对OS无意义[26];也研究表明,其能够延长OS[37];还有些研究表明其对RFS及OS无意义[35,51]。
推荐意见:术前或术后化疗(±贝伐珠单抗)对外阴、阴道黑色素瘤有效率低。晚期转移性黑色素瘤在免疫检查点抑制剂和靶向治疗发生耐药时再考虑化疗。
5.5 免疫检查点抑制剂
5.5.1 伊匹木单抗(Ipilimumab) 伊匹木单抗能延长不可切除或转移性皮肤型黑色素无进展生存期(PFS)和OS,肿瘤的客观缓解率12%~19%。高剂量伊匹木单抗(10mg/kg)不良反应明显,小剂量伊匹木单抗(3mg/kg)不仅未降低生存获益,而且减少了毒副反应[52]。小剂量伊匹木单抗多联合PD-1抗体治疗。回顾性研究表明,伊匹木单抗单药治疗外阴、阴道黑色素瘤效果明显不及PD-1抗体或联合治疗(mPFS:3个月vs. 9个月)[53-54]。
5.5.2 PD-1抗体
5.5.2.1 纳武利尤单抗(Nivolumab) 纳武利尤单抗在Ⅲ/Ⅳ期皮肤型黑色素瘤的术后辅助治疗更具优势。用法:静脉注射3mg/kg,每2周1次,至1年[55]。在不可切除或转移性皮肤型黑色素瘤中,纳武利尤单抗与达卡巴嗪[56]或伊匹木单抗[57]相比,具有更高的PFS和OS,肿瘤客观缓解率40%~44%。纳武利尤单抗与小剂量伊匹木单抗联合治疗优于纳武利尤单抗单药治疗。纳武利尤单抗单药用法:(1)3mg/kg,每2周1次,直至肿瘤进展。(2)480mg,每4周1次,直至肿瘤进展。联合治疗:(1)纳武利尤单抗1mg/kg+伊匹木单抗3mg/kg,每3周1次,共4次,之后改为纳武利尤单抗3mg/kg,每2周1次,直至肿瘤进展。(2)纳武利尤单抗3mg/kg+伊匹木单抗1mg/kg,每3周1次,共4次,之后改为纳武利尤单抗480mg,每4周1次,直至肿瘤进展[57-60]。
5.5.2.2 帕姆利珠单抗(Pembrolizumab) 在皮肤型黑色素瘤的术后辅助治疗中,帕姆利珠单抗与纳武利尤单抗的效果相当[55,61]。用法:200mg,每3周1次,共18次。在不可切除或转移性皮肤黑色素瘤中,帕姆利珠单抗与伊匹木单抗相比,可明显延长PFS和OS[62]。用法:静脉注射2mg/kg,每3周1次,直至肿瘤进展。
推荐纳武利尤单抗或帕姆利珠单抗作为术后高危复发黑色素瘤的辅助治疗(2A类证据),并推荐纳武利尤单抗、帕姆利珠单抗、或纳武利尤单抗联合伊匹木单抗作为不可切除或转移性黑色素瘤的一线治疗用药(1类证据)[13-14,43-44], ASCO推荐该方案也适用于黏膜型黑色素瘤[43-44]。目前缺乏PD-1抗体在外阴、阴道黑色素瘤术后辅助治疗的研究。在晚期转移性外阴、阴道黑色素瘤中,PD-1或PD-1联合CTLA-4抑制剂的客观缓解率37.5%,临床有效率为62.5%[53]。伊匹木单抗或帕姆利珠单抗在黏膜型黑色素瘤与皮肤型黑色素瘤的治疗效果相当,但纳武利尤单抗在黏膜型黑色素瘤中的治疗效果略逊于皮肤型黑色素瘤[63-64]。特瑞普利单抗已批准为晚期黑色素瘤的二线治疗用药,在黏膜型黑色素瘤Ⅲ期应用的研究正在进行中。
推荐意见:推荐PD-1抗体作为Ⅲ~Ⅳ期外阴、阴道黑色素瘤术后辅助治疗的首选用药。推荐PD-1抗体或联合CTLA-4抑制剂作为不可切除或转移性外阴、阴道黑色素瘤的一线治疗用药。
5.6 靶向治疗
5.6.1 酪氨酸激酶抑制剂(KIT抑制剂) KIT突变/扩增常见于外阴、阴道黑色素瘤。KIT抑制剂推荐作为具有KIT突变的不可切除或晚期转移性黑色素瘤的二线治疗用药,代表药物为伊马替尼(imatinib),400mg每日2次或每日1次,直至肿瘤进展。KIT基因11号和13号外显子突变,对KIT抑制剂敏感(总缓解率34%~54%);KIT基因17号外显子突变及KIT基因扩增,对KIT抑制剂敏感度低或不敏感[65]。但是KIT抑制剂在肿瘤缓解后获益短暂,OS在KIT基因突变或扩增中并无差异[66]。
5.6.2 BRAF/MEK抑制剂 达拉非尼联合曲美替尼(dabrafenib/trametinib)推荐用于具有BRAF V600E/K突变的Ⅲ~Ⅳ期黑色素瘤的术后辅助治疗。用法:达拉非尼 150mg每日2次+曲美替尼2mg 每日1次,共1年。在晚期转移性皮肤型黑色素瘤中,达拉非尼联合曲美替尼、维罗非尼联合卡比替尼(vemurafenib/cobimetinib)、康奈非尼联合比美替尼(encorafenib/binimetinib)均属于BRAF V600E/K突变者的一线治疗用药[13-14,43-44]。
NRAS突变型黑色素瘤的预后差。MEK抑制剂(例如比美替尼)可能对一部分NRAS突变者有效,但获益短暂[67]。
5.6.3 抗血管生成药物 不可切除或晚期转移性黏膜型黑色素瘤对血管内皮生长因子(VEGF)抑制剂相对敏感,代表药物为恩度、贝伐珠单抗(Bevacizumab)和阿昔替尼(Bevacizumab)。回顾性研究表明,在不可切除的晚期转移性黑色素瘤(30%为黏膜型黑色素瘤)中,化疗±恩度或贝伐珠单抗的客观缓解率不足10%[68]。另一项单中心ⅠB期开放试验,在晚期转移性黏膜型黑色素瘤(20%为生殖道黑色素瘤)中,特瑞普利单抗联合阿昔替尼的客观缓解率达48.3%,临床有效率达86.2%,中位PFS达7.5个月,中位OS未成熟[69]。
推荐意见:KIT抑制剂(伊马替尼)可作为具有KIT突变的不可切除或晚期转移性黑色素瘤的二线治疗用药。达拉非尼联合曲美替尼、维罗非尼联合卡比替尼、康奈非尼联合比美替尼可考虑用于BRAF V600E/K突变的不可切除性或晚期外阴、阴道黑色素瘤的一线治疗。特瑞普利单抗联合阿昔替尼和(或)抗血管生成药物可考虑用于不可切除性或晚期转移性外阴、阴道黑色素瘤的一线治疗。见表4。

黑色素瘤的治疗进入了快速更迭的时代,IFN不再作为首选推荐,化疗仍有一定的价值,放疗仅适宜于无法手术切除的晚期或手术后复发、转移的患者。靶点治疗药物层出不穷,PD-1抗体和靶向治疗在外阴、阴道黑色素瘤中尚需要更多的数据考证,但是手术切除仍然是外阴、阴道黑色素瘤治疗的基石。本推荐意见不排除学术组织有关指南、共识或建议的合理性。
参考文献
[1] Nagarajan P,Curry JL,Ning J,et al.Tumor thickness and mitotic rate robustly predict melanoma-specific survival in patients with primary vulvar melanoma:a retrospective review of 100 cases[J].Clin Cancer Res,2017,23(8):2093-2104.
[2] Edwards L.Pigmented vulvar lesions[J].Dermatol Ther,2010,23(5):449-457.
[3] Piura B.Management of primary melanoma of the female urogenital tract[J].Lancet Oncol,2008,9(10):973-981.
[4] Ragnarsson-Olding BK,Kanter-Lewensohn LR,Lagerlöf B,et al.Malignant melanoma of the vulva in a nationwide, 25-year study of 219 Swedish females:clinical observations and histopathologic features[J].Cancer,1999,86(7):1273-1284.
[5] Wohlmuth C,Wieser IW,May T,et al.Malignant melanoma of the vulva and vagina:a US population-based study of 1863 patients[J].Am J Clin Dermatol,2020,21(2):285-295.
[6] Yu Y,Tse KY,Lee HHY,et al.Predictive biomarkers and tumor microenvironment in female genital melanomas:a multi-institutional study of 55 cases[J].Mod Pathol,2020,33(1):138-152.
[7] Garbe C,Amaral T,Peris K,et al. European consensus-based interdisciplinary guideline for melanoma.Part 1:diagnostics-update 2019[J]. Eur J Cancer,2020,126:141-158.
[8]中华人民共和国国家卫生健康委员会. 黑色素瘤诊疗规范(2018年版)[EB/OL].(2018-12-13)[2021-04-10].http://www.nhc.gov.cn/yzygj/s7659/201812/b21802b199814ab7b1219b87de0cae51.shtml.
[9] Frumovitz M,Etchepareborda M,Sun CC,et al. Primary malignant melanoma of the vagina[J].Obstet Gynecol,2010,116(6):1358-1365.
[10] Gupta D,Malpica A,Deavers MT,et al.Vaginal melanoma:a clinicopathologic and immunohistochemical study of 26 cases[J].Am J Surg Pathol,2002,26(11):1450-1457.
[11] Borazjani G,Prem KA,Okagaki T,et al.Primary malignant melanoma of the vagina:a clinicopathological analysis of 10 cases[J].Gynecol Oncol,1990,37(2):264-267.
[12] Kirschner AN,Kidd EA,Dewees T,et al.Treatment approach and outcomes of vaginal melanoma[J].Int J Gynecol Cancer,2013,23(8):1484-1489.
[13] Garbe C,Amaral T,Peris K,et al. European consensus-based interdisciplinary guideline for melanoma. Part 2:treatment - update 2019[J]. Eur J Cancer,2020,126:159-177.
[14] NCCN. NCCN clinical practice guidelines in oncology(NCCN Guidelines®):cutaneous melanoma Version 1. 2021[EB/OL]. [2021-04-10].https://www.nccn.org/professionals/physician_gls/PDF/cutaneous_melanoma-chinese.pdf.
[15] 中国临床肿瘤学会指南工作委员会.中国临床肿瘤学会(CSCO)黑色素瘤诊疗指南[M].北京:人民卫生出版社,2020.
[16] Lai G,Rockall AG.Lymph node imaging in gynecologic malignancy[J].Semin Ultrasound CT MR,2010,31(5):363-376.
[17] Leitao MM Jr. Management of vulvar and vaginal melanomas:current and future strategies[J].Am Soc Clin Oncol Educ Book,2014,14:e277-e281.
[18]Gershenwald JE,Scolyer RA,Hess KR,et al. Melanoma staging:evidence-based changes in the American Joint Committee on Cancer eighth edition cancer staging manual[J]. CA Cancer J Clin,2017,67(6):472-492.
[19] Karagiannis P,Fittall M,Karagiannis SN. Evaluating biomarkers in melanoma[J].Front Oncol,2014,4:383.
[20] Leitao MM Jr,Cheng X,Hamilton AL,et al.Gynecologic Cancer Inter Group(GCIG)consensus review for vulvovaginal melanomas[J].Int J Gynecol Cancer,2014,24(9 Suppl 3):S117-S122.
[21] Gadducci A,Carinelli S,Guerrieri ME,et al.Melanoma of the lower genital tract:prognostic factors and treatment modalities[J].Gynecol Oncol,2018,150(1):180-189.
[22] 《中国黑色素瘤规范化病理诊断专家共识(2017年版)》编写组.中国黑色素瘤规范化病理诊断专家共识(2017年版)[J].中华病理学杂志,2018,47(1):7-13.
[23] Bence C,Hofman V,Chamorey E,et al.Association of combined PD-L1 expression and tumour-infiltrating lymphocyte features with survival and treatment outcomes in patients with metastatic melanoma[J].J Eur Acad Dermatol Venereol,2020,34(5):984-994.
[24] Rouzbahman M,Reid SK,Habeeb AA,et al.Malignant melanoma of vulva and vagina:a histomorphological review and mutation analysis--a single-center study[J].J Low Genit Tract Dis,2015,19(4):350-353.
[25] Aulmann S,Sinn HP,Penzel R,et al.Comparison of molecular abnormalities in vulvar and vaginal melanomas[J].Mod Pathol,2014,27(10):1386-1393.
[26] Xia L,Han D,Yang W,et al.Primary malignant melanoma of the vagina:a retrospective clinicopathologic study of 44 cases[J].Int J Gynecol Cancer,2014,24(1):149-155.
[27] Pasquali S,Haydu LE,Scolyer RA,et al.The importance of adequate primary tumor excision margins and sentinel node biopsy in achieving optimal locoregional control for patients with thick primary melanomas[J].Ann Surg,2013,258(1):152-157.
[28] Wong SL,Faries MB,Kennedy EB,et al.Sentinel lymph node biopsy and management of regional lymph nodes in melanoma:American Society of Clinical Oncology and Society of Surgical Oncology clinical practice guideline update[J].J Clin Oncol,2018,36(4):399-413.
[29] Ditto A,Bogani G,Martinelli F,et al.Surgical management and prognostic factors of vulvovaginal melanoma[J].J Low Genit Tract Dis,2016,20(3):e24-e29.
[30] Lopez S,Guerrisi R,Brusadelli C,et al.The role of sentinel lymph node mapping in lower genital tract melanoma[J].Miner va Ginecol,2020,72(6):384-390.
[31] Trifirò G,Travaini LL,Sanvito F,et al.Sentinel node detection by lymphoscintigraphy and sentinel lymph node biopsy in vulvar melanoma[J].Eur J Nucl Med Mol Imaging,2010,37(4):736-741.
[32] Leiter U,Stadler R,Mauch C,et al.Final analysis of DeCOG-SLT trial:no survival benefit for complete lymph node dissection in patients with melanoma with positive sentinel node[J].J Clin Oncol,2019,37(32):3000-3008.
[33] Faries MB,Thompson JF,Cochran AJ,et al.Completion dissection or observation for sentinel-node metastasis in melanoma[J].N Engl J Med,2017,376(23):2211-2222.
[34] Iacoponi S,Rubio P,Garcia E,et al.Prognostic factors of recurrence and survival in vulvar melanoma:subgroup analysis of the vulvar cancer study[J].Int J Gynecol Cancer,2016,26(7):1307-1312.
[35] Tcheung WJ,Selim MA,Herndon JE,et al.Clinicopathologic study of 85 cases of melanoma of the female genitalia[J].J Am Acad Dermatol,2012,67(4):598-605.
[36] Parisi S,Lillo S,Cacciola A,et al.Vaginal mucosal melanoma:a complete remission after immunotherapy and '0-7-21' radiotherapy regimen(24 Gy/3 fractions/21 days)[J].Folia Med(Plovdiv),2020,62(3):605-609.
[37] Lian B,Si L,Cui C,et al.Phase Ⅱ randomized trial comparing high-dose IFN-α2b with temozolomide plus cisplatin as systemic adjuvant therapy for resected mucosal melanoma[J].Clin Cancer Res,2013,19(16):4488-4498.
[38] Eggermont AMM,Suciu S,Santinami M,et al. Adjuvant therapy with pegylated interferon alfa-2b versus observation alone in resected stage Ⅲ melanoma:final results of EORTC 18991, a randomised phase Ⅲ trial[J].Lancet,2008,372(9633):117-126.
[39] Kirkwood JM,Manola J,Ibrahim J,et al.A pooled analysis of Eastern Cooperative Oncology Group and Intergroup trials of adjuvant high-dose interferon for melanoma[J].Clin Cancer Res,2004,10(5):1670-1677.
[40] Eggermont AMM,Suciu S,Testori A,et al.Long-term results of the randomized phase Ⅲ trial EORTC 18991 of adjuvant therapy with pegylated interferon alfa-2b versus observation in resected stage Ⅲ melanoma[J].J Clin Oncol,2012,30(31):3810-3818.
[41] Larkin JMG,Fisher RA,Gore ME.Adjuvant interferon therapy for patients at high risk for recurrent melanoma:an updated systematic review[J].Clin Oncol(R Coll Radiol),2012,24(6):410-412.
[42] Lian B,Cui C,Song X. Phase Ⅲ randomized,multicenter trial comparing high-dose IFN-a2b with temozolomide plus cisplatin as adjuvant therapy for resected mucosal melanoma[J]. J Clin Oncol,2018,36(15_Suppl)9589.
[43] Petrella TM,Fletcher GG,Knight G,et al.Systemic adjuvant therapy for adult patients at high risk for recurrent cutaneous or mucosal melanoma:an Ontario Health(Cancer Care Ontario)clinical practice guideline[J].Curr Oncol,2020,27(1):e43-e52.
[44] Seth R,Messersmith H,Kaur V,et al.Systemic therapy for melanoma:ASCO guideline[J].J Clin Oncol,2020,38(33):3947-3970.
[45] Smith FO,Downey SG,Klapper JA,et al.Treatment of metastatic melanoma using interleukin-2 alone or in conjunction with vaccines[J].Clin Cancer Res,2008,14(17):5610-5618.
[46] Atkins MB,Kunkel L,Sznol M,et al.High-dose recombinant interleukin-2 therapy in patients with metastatic melanoma:long-term survival update[J].Cancer J Sci Am,2000,6(Suppl 1):S11-S14.
[47] Byers BA,Oberle CFT,Hurdle V,et al.Treatment of in-transit melanoma with intra-lesional interleukin-2:a systematic review[J].J Surg Oncol,2014,110(6):770-775.
[48] Patel PM,Suciu S,Mortier L,et al.Extended schedule, escalated dose temozolomide versus dacarbazine in stage IV melanoma:final results of a randomised phaseⅢ study(EORTC 18032)[J].Eur J Cancer,2011,47(10):1476-1483.
[49] Rao RD,Holtan SG,Ingle JN,et al.Combination of paclitaxel and carboplatin as second-line therapy for patients with metastatic melanoma[J].Cancer,2006,106(2):375-382.
[50] Young AM,Marsden J,Goodman A,et al.Prospective randomized comparison of dacarbazine(DTIC)versus DTIC plus interferon-alpha(IFN-alpha)in metastatic melanoma[J].Clin Oncol(R Coll Radiol),2001,13(6):458-465.
[51] Janco JMT,Markovic SN,Weaver AL,et al.Vulvar and vaginal melanoma:case series and review of current management options including neoadjuvant chemotherapy[J].Gynecol Oncol,2013,129(3):533-537.
[52] Bertrand A,Kostine M,Barnetche T,et al.Immune related adverse events associated with anti-CTLA-4 antibodies:systematic review and meta-analysis[J].BMC Med,2015,13:211.
[53] Wohlmuth C,Wieser IW,Laframboise S.Clinical characteristics and treatment response with checkpoint inhibitors in malignant melanoma of the vulva and vagina[J].J Low Genit Tract Dis,2021,25(2):146-151.
[54] Indini A,Guardo LD,Cimminiello C,et al. Investigating the role of immunotherapy in advanced/recurrent female genital tract melanoma:a preliminary experience[J].J Gynecol Oncol,2019,30(6):e94.
[55] Weber J,Mandala M,Vecchio MD,et al.Adjuvant nivolumab versus ipilimumab in resected stage Ⅲ or Ⅳ elanoma[J].N Engl J Med,2017,377(19):1824-1835.
[56] Robert C,Long GV,Brady B,et al.Nivolumab in previously untreated melanoma without BRAF mutation[J].N Engl J Med,2015,372(4):320-330.
[57] Hodi FS,Sileni VC,Gonzalez R,et al. Nivolumab plus ipilimumab or nivolumab alone versus ipilimumab alone in advanced melanoma(CheckMate 067):4-year outcomes of a multicentre,randomised,phase 3 trial[J].Lancet Oncol,2018,19(11):1480-1492.
[58] Larkin J,Sileni VC,Gonzalez R,et al.Five-year survival with combined nivolumab and ipilimumab in advanced melanoma[J].N Engl J Med,2019,381(16):1535-1546.
[59] Lebbé C,Meyer N,Mortier L,et al. Evaluation of two dosing regimens for nivolumab in combination with ipilimumab in patients with advanced melanoma:results from the phase Ⅲb/Ⅳ checkmate 511 trial[J].J Clin Oncol,2019,37(11):867-875.
[60] Long GV,Tykodi SS,Schneider JG,et al.Assessment of nivolumab exposure and clinical safety of 480 mg every 4 weeks flat-dosing schedule in patients with cancer[J].Ann Oncol,2018,29(11):2208-2213.
[61] Quéreux G,Wylomanski S,Bouquin R,et al.Are checkpoint inhibitors a valuable option for metastatic or unresectable vulvar and vaginal melanomas?[J].J Eur Acad Dermatol Venereol,2018,32(1):e39-e40.
[62] Robert C,Schachter J,Long GV,et al.Pembrolizumab versus ipilimumab in advanced melanoma[J].N Engl J Med,2015,372(26):2521-2532.
[63] D'Angelo SP,Larkin J,Sosman JA,et al.Efficacy and safety of nivolumab alone or in combination with ipilimumab in patients with mucosal melanoma:a pooled analysis[J].J Clin Oncol,2017,35(2):226-235.
[64] Plana AM,Gómez RGH,Rossoni C,et al.Evaluation of the efficacy of immunotherapy for non-resectable mucosal melanoma[J].Cancer Immunol Immunother,2019,68(7):1171-1178.
[65] Guo J,Si L,Kong Y,et al. Phase Ⅱ,open-label,single-arm trial of imatinib mesylate in patients with metastatic melanoma harboring c-Kit mutation or amplification[J].J Clin Oncol,2011,29(21):2904-2909.
[66] Hodi FS,Corless CL,Hurder AG,et al.Imatinib for melanomas harboring mutationally activated or amplified KIT arising on mucosal, acral, and chronically sun-damaged skin[J].J Clin Oncol,2013,31(26):3182-3190.
[67] Dummer R,Schadendorf D,Ascierto PA,et al.Binimetinib versus dacarbazine in patients with advanced NRAS-mutant melanoma(NEMO):a multicentre, open-label, randomised, phase 3 trial[J].Lancet Oncol,2017,18(4):435-445.
[68] Cui C,Yan X,Liu S,et al.1283PTreatment pattern and clinical outcomes of patients with locally advanced and metastatic melanoma in a real-world setting in China[J].Ann Oncol,2018,29.
[69] Sheng X,Yan X,Chi Z,et al.Axitinib in combination with toripalimab,a humanized immunoglobulin G 4 monoclonal antibody against programmed cell death-1,in patients with metastatic mucosal melanoma:an open-label phaseⅠB trial[J].J Clin Oncol,2019,37(32):2987-2999.
 妇产科在线APP下载
妇产科在线APP下载













