本文引用格式:
冯宗辉,俞钢,谌燕,等.产前诊断原发性右侧肺缺如且生后健康存活一例[J]. 中华围产医学杂志, 2021,24(1):61-64.DOI:10.3760/cma.j.cn113903-20200213-00097
冯宗辉1 俞钢2 谌燕1 易凤梅1 李敏1 姜淑敏1
1:湖南省怀化市妇幼保健院产前诊断中心 418000;2:广州医科大学附属第三医院小儿外科 510150
通信作者:俞钢,Email:yugang1959@126.com,电话:020-81295829
病例介绍
孕妇22岁,于2019年6月3日(孕23周+6)来怀化市妇幼保健院行常规大排畸超声检查。该孕妇为孕3产1,第1次妊娠足月阴道分娩一健康男婴,第2次妊娠于停经50 d人工流产。本次为第3次妊娠,自然受孕,末次月经2018年12月18日,预产期2019年9月25日。该孕妇于外院定期产前检查,孕12周+5外院B超显示胎儿颈项透明层(nuchal translucency, NT)厚度0.9 mm,血清学筛查低风险。孕妇孕期无不适,甲状腺、肝、肾功能未见异常,乙型肝炎、梅毒、人类免疫缺陷病毒、丙型肝炎等相关病原学检测均为阴性;否认发热及用药史、慢性疾病史,以及先天性缺陷或遗传性疾病家族史。
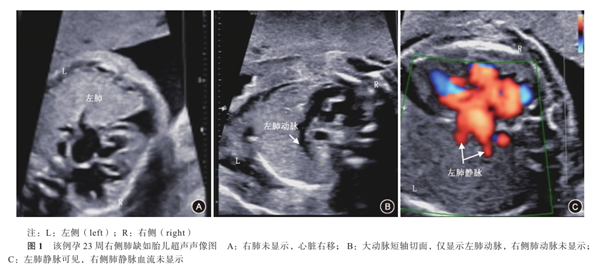
本次超声检查:胎儿双顶径60.3 mm,头围224.6 mm,腹围184.5 mm,股骨长40.4 mm,肱骨长38.5 mm,羊水指数115 mm,胎心率155次/min,胎盘厚度22 mm。胎儿左肺面积8.4 cm2;右肺显示不清,未见肺动脉分叉,未见肺静脉进入左心房;心脏右移,心尖部见深约3.8 mm液性暗区。考虑右肺缺如或发育不全,左肺增大,心脏右移;余未见明显异常(图1)。
检查后,产前诊断中心进一步提供咨询意见:
(1)行羊水染色体核型+染色体微阵列分析(chromosomal microarray analysis, CMA)检查,排除相关遗传性疾病;
(2)行胎儿MRI检查;
(3)新生儿外科专家咨询,了解相关风险及预后;
(4)超声监测胎儿生长发育情况(孕26~28周复诊),观察有无合并其他结构发育异常、左肺发育情况,以及有无胎儿水肿、胸腔积液,纵隔移位等。孕妇及家属选择行介入性产前诊断,遂于孕24周行羊膜腔穿刺术。羊水染色体核型示G显带320条带水平未见数目异常和明显结构异常;CMA为arr[hg19] (1-22)×2,(XN)×1,未见明显异常。新生儿外科专家会诊后建议尽早行胎儿MRI检查,进一步了解胎儿肺部发育情况,并告知一侧肺发育不全的相关风险。孕妇及家属选择继续妊娠,但未行MRI和胎儿超声心动图等检查。
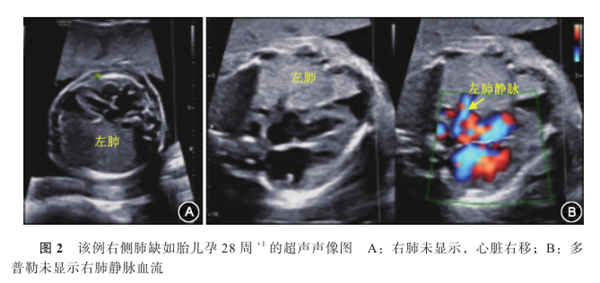
该孕妇于2019年7月2日(孕28周+1)在本院复查B超示:双顶径74.2 mm、头围265.1 mm、腹围224.5 mm、股骨长53.8 mm、肱骨长47.5 mm、羊水指数95 mm;胎心率142次/min,胎盘厚度27 mm;胎儿左肺面积8.8 cm2,心尖部见深约6 mm液性暗区(图2)。该孕妇于孕30周在外院行胎儿胸部MRI检查,再来本院就诊时自诉结果提示“与超声相符”,但未能提供相关资料和报告。之后孕妇定期在外院产前检查,未见其他明显异常。
2019年9月18日,该孕妇因“停经39周+1、腹胀2 h”入院。入院诊断:(1)孕3产1、宫内孕39周+1,右枕前位单活胎,先兆临产;(2)胎儿发育异常:右侧肺缺如或发育不良。考虑胎儿一侧肺缺如,产科、新生儿科、影像科和胎儿医学科等进行了多学科会诊,将该胎儿纳入以胎儿疾病为中心的多学科一体化管理中。
孕妇于入院次日自然临产,18:02经阴道分娩一女婴。该婴儿出生体重3 640 g,1 和5 min Apgar评分均为10分,无呼吸窘迫;羊水清亮,量约100 ml;脐带、胎盘未见异常。体格检查:皮肤红润,外观未见明显异常,前囟平软,胸廓无塌陷,右肺未闻及明显呼吸音;心率138次/min、律齐;肛门、外生殖器未见明显畸形;四肢肌张力好,活动自如。该新生儿于生后10 min因“右肺缺如或发育不全”转新生儿科进行监护及相关检查。
转入后体格检查:体温36.2℃、心率150次/min,呼吸48次/min,血压62/27 mmHg(1 mmHg=0.133 kPa),平均动脉压40 mmHg;足月儿貌,反应可,哭声响亮,全身皮肤无黄染;唇无发绀,颈软,未见三凹征,左肺可闻及散在湿啰音,右肺未闻及明显呼吸音。入院诊断:(1)新生儿肺炎;(2)先天性右肺缺如?;(3)心包积液?。
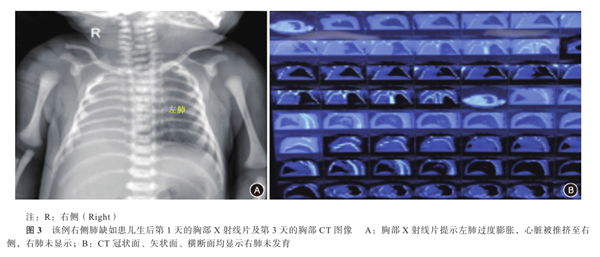
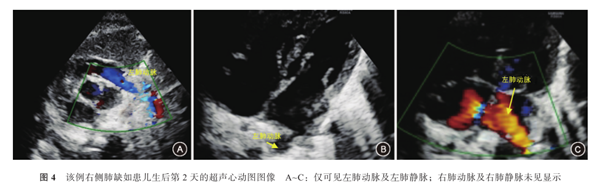
予以抗感染、预防出血鼻导管吸氧等处理。该患儿鼻导管给氧2 h,呼吸一直平稳,各项生命体征指标正常。生后2 d患儿胸部X射线片提示:右侧胸腔呈密度均匀致密影;左肺野透亮度增高,纵隔心影向右移位,右膈肌面显示不清,左膈肌面光滑,左肋膈角锐利。生后3 d行胸部CT扫描,在三个维度均显示右肺未发育(图3);诊断:先天性右肺缺如。超声心动图:心脏大部分位于右侧胸腔,心尖朝左;主动脉根部内径宽9 mm,左心房10 mm,左心室15 mm,室间隔厚3 mm,左心室后壁厚3 mm,右心房12 mm,右心室12 mm,肺动脉8 mm,左肺动脉内径3 mm;右肺动脉、静脉未显示,肺动脉峰值流速0.7 m/s;主动脉峰值流速1.1 m/s;二尖瓣:左心室舒张早期快速充盈的充盈峰(E峰)0.8 m/s,舒张晚期(心房收缩)充盈的充盈峰(A峰)0.7 m/s,E峰>A峰,左心室缩短分数40%,射血分数65%;心脏各房室内径大小正常,房间隔可见宽2.5 mm的连续中断,室间隔探及宽1.6 mm的穿隔血流信号,室间隔与左心室后壁运动正常;各瓣膜清晰,启闭正常,升主动脉、肺动脉位置和内径正常,降主动脉与肺动脉分叉处可见交通支,心包腔内未见明显异常回声(图4)。
患儿在新生儿科住院观察期间,呼吸平稳,电解质和各项生化指标正常。患儿于生后第8天与其母一同出院。出院后该患儿在本院随访5个月,生长发育与同龄儿童相当,一般情况良好。截至本文投稿时,该患儿仍在继续随访中。
讨论
肺缺如(pulmonary agenesis)又称肺不发育,是指一侧或双侧肺完全缺如,合并同侧或双侧气管、肺血管缺如,发病率约为1/15 000。肺缺如是临床比较罕见的肺发育异常疾病,由De Pozze于1673年首次在尸检时发现。Munchmeyer等1885年首次临床诊断了肺缺如。肺缺如的发病率性别差异不明显,病因亦不明确。
肺缺如的临床特征包括肺组织、支气管和肺血管完全缺如,可发生在双侧、一侧或一叶肺,常伴有其他畸形。双侧肺不发育是致死性的,而一侧或一叶肺缺如者多可存活。相对于左侧肺缺如,右侧肺缺如更常见。由于常合并其他畸形,特别是心血管畸形,且气道更容易受移位的心脏、大血管和纵隔等压迫,导致反复呼吸道感染,病死率较高。单侧肺缺如的患儿多在围产期或新生儿早期死亡,而产前预测更困难。原发性肺缺如的病例经产前诊断明确后,绝大多数选择终止妊娠。但随着胎儿医学水平的快速提高,对胎儿肺部疾病的认识不断深入,以及胎儿一体化管理的实施,有更多的孕妇选择保留胎儿。
肺缺如较罕见,产前明确诊断并妊娠至足月分娩的患儿更为少见。Kayemba-Kay's等报告了4例肺发育不全病例,其中2例是在产前诊断的。这4例中,除1例有胎儿生长受限外,其余3例生长发育指标正常,妊娠至足月分娩。这4例婴儿生后呼吸功能正常,生长发育良好,随访8年发现,他们的日常生活和学习均未受明显影响。Meller等统计了有关肺发育的文献报道共36例,其中5例为双侧肺缺如。该研究左侧肺不发育的6例患儿中有4例存活,预后良好;右侧肺不发育的25例中有13例存活,预后亦良好。该研究认为,患儿预后与是否合并其他畸形有关。
肺缺如的产前诊断比较困难。本例孕妇在孕23周+6超声检查时发现胎儿右侧胸腔内找不到肺的证据,表现为右侧胸腔内未见肺实质,亦未见右侧肺动脉分支切面及右肺静脉血流。之后在孕28周复查超声,仍未发现右侧肺组织、支气管和肺血管,考虑为肺缺如。产前超声所见与患儿生后行CT扫描结果相符。
由本例可以认为,产前可以通过超声诊断该类疾病。Meller等强调了输出道检查的重要性,即用二维彩色多普勒显示肺血管,当未见肺动脉分叉或未见肺静脉到达左心房时,尤其发现纵隔移位时,有助于诊断。疑有肺缺如的胎儿还应注意是否合并其他系统的畸形。这些畸形中,最常见的是弯刀综合征,其次是合并心血管、肋骨畸形和头面部等异常。另外,还应进行详细的超声和MRI检查。要特别重视骨骼发育不良、脊柱、泌尿生殖系统及消化道畸形。
Meller等分析的36例病例中,仅13例进行了染色体核型分析。这13例染色体核型分析均未见异常,而其余23例病例均未进行该检查。由于目前尚未检索到充分的文献资料,故根据“染色体微阵列分析技术在产前诊断中的应用专家共识”,对产前超声检查异常的胎儿,仍建议排除染色体及基因组相关疾病。本例孕妇选择了介入性产前诊断,排除了常见染色体和基因组相关疾病,孕期未发现其他系统畸形,未出现羊水过多或过少,未出现胎儿水肿或心包腔积液增多等异常。
对产前诊断发现的一侧肺缺如,尚无宫内干预措施。可通过超声或MRI密切监测胎儿肺发育情况,以评估预后。对于一侧肺缺如的胎儿,目前常用的评价指标包括健存肺的容积、肺的面积以及超声表现(如是否有胎儿水肿、胸腔积液、心脏、纵隔移位等)。
此外,围绕着胎儿展开的多学科、多专业一体化管理,可从宫内的筛查诊断、监测干预,到产时和产后的治疗处理等做好无缝连接,“一站式”解决问题。这种一体化管理模式不仅可以为孕妇及家庭提供比较专业精准的诊断、全面的风险分析和评估,还能为保留的患儿提供更为专业有效的治疗措施,为提高患儿的存活率及生存质量、改善预后提供保障。
对于单纯一侧肺缺如且未合并其他畸形的胎儿,孕期及产时不需要特殊干预。可根据产科指征决定分娩方式,尽量选择阴道分娩。因为经阴道分娩可挤压1/3~1/2肺液由口鼻排出,且阴道分娩可帮助肺液清除,促进肺部微循环和肺液吸收,降低吸入性肺炎和湿肺的风险。虽然一侧肺存在异常,但患儿可代偿,维持正常生存是可行的。随着时间的推移,患儿后期是否发生纵隔偏移并逐渐加重,甚至出现类似肺切除后综合征的表现,尚需要更长时间的随访、累积更多的病例。
本例胎儿孕期2次超声监测左侧肺发育良好,均超过实际孕周预测面积,无其他并发症,因此继续妊娠直至足月分娩,生后随访一般情况良好。随着干细胞生物学水平不断提高,对肺的胚胎发育理论研究的不断深入,以及相关新技术、新方法的不断出现,今后可能会产生新的、更有效的治疗方法,为这些患者带来更好的结局。因此,由本例可以认为,对于先天性一侧肺缺如的胎儿,临床医生应该在严格的咨询和评估风险下,持相对积极乐观的态度对待。
参考文献:
[1]Malcon MC, Malcon CM, Cavada MN, et al. Unilateral pulmonary agenesis[J]. J Bras Pneumol, 2012,38(4):526-529. DOI: 10.1590/s1806-37132012000400016.
[2]Glasberg T, Jackson P, Pavlova Z, et al. Infant with clinical evidence of pulmonary hypoplasia: a case report[J]. Cureus, 2017,9(5):e1298. DOI: 10.7759/cureus.1298.
[3]Tiwari VK, Kumar A, Khurana A. Pulmonary hypoplasia wrongly diagnosed and treated as pulmonary tuberculosis[J]. J Assoc Physicians India, 2015,63(7):61-63.
[4]俞钢.临床胎儿学[M].北京:人民卫生出版社,2016:212-215.
Yu G. Clinical Fetology[M]. Beijing: People's Medical Publishing House, 2016: 212-215.
[5]Kayemba-Kay's S, Couvrat-Carcauzon V, et al. Unilateral pulmonary agenesis: a report of four cases, two diagnosed antenatally and literature review[J]. Pediatr Pulmonol, 2014,49(3):E96-102. DOI: 10.1002/ppul.22920.
[6]Meller CH, Morris RK, Desai T, et al. Prenatal diagnosis of isolated right pulmonary agenesis using sonography alone: case study and systematic literature review[J]. J Ultrasound Med, 2012,31(12):2017-2023. DOI: 10.7863/jum.2012.31.12.2017.
[7]刘鸿圣.胎儿磁共振影像诊断学[M].北京:人民卫生出版社,2018:81-90.
Liu HS. Fetal magnetic resonance imaging[M]. Beijing: People's Medical Publishing House, 2018:81-90.
[8]Biswas S, Ray A. Dextrocardia with pulmonary hypoplasia: an unusual cause of unilateral lung white-out[J]. BMJ Case Rep, 2019,12(5): e229413. DOI: 10.1136/bcr-2019-229413.
[9]染色体微阵列分析技术在产前诊断中的应用协作组. 染色体微阵列分析技术在产前诊断中的应用专家共识[J].中华妇产科杂志,2014,49(8):570-572. DOI: 10.3760/cma.j.issn.0529-567X.2014.08.002.
Experts Collaboration Group. Expert Consensus on chromosome microarray analysis technology in prenatal diagnosis[J]. Chin J Obstet Gynecol, 2014,49(8):570-572. DOI: 10.3760/cma.j.issn.0529-567X.2014.08.002.
[10]Muthialu N, Bulstrode N, Elliott MJ. Intrathoracic saline-filled prosthesis to treat postpneumonectomy syndrome[J]. Asian Cardiovasc Thorac Ann, 2015,23(1):78-81. DOI: 10.1177/0218492313516115.
[11]Zhang Y, Fan M, Ren WD, et al. Prenatal diagnosis of fetal unilateral lung agenesis complicated with cardiac malposition[J]. BMC Pregnancy Childbirth, 2013,13:79. DOI: 10.1186/1471-2393-13-79.
[12]Triebwasser JE, Treadwell MC. Prenatal prediction of pulmonary hypoplasia[J]. Semin Fetal Neonatal Med, 2017,22(4):245-249. DOI: 10.1016/j.siny.2017.03.001.
[13]王卫平,孙锟,常立文,等.儿科学[M].9版.北京:人民卫生出版社,2019:89.
Wang WP, Sun K, Chang LW, et al. Pediatrics[M]. 9th ed. Beijing: People's Medical Publish House, 2019:89.
[14]Jung HS, Suh JW, Kim TH, et al. Surgical treatment of postpneumonectomy syndrome with tissue expanders in children[J]. Korean J Thorac Cardiovasc Surg, 2015,48(3):217-219. DOI: 10.5090/kjtcs.2015.48.3.217.
[15]Cotten CM. Pulmonary hypoplasia[J]. Semin Fetal Neonatal Med, 2017,22(4):250-255. DOI: 10.1016/j.siny.2017.06.004.
 妇产科在线APP下载
妇产科在线APP下载













