背景
心律失常是妊娠期最常见的心血管并发症。近些年来因妊娠期心律失常住院的人数增加明显,主要是因为房颤患病率增加。这一趋势可能是由于患有结构性心脏病的妇女妊娠增加导致。心律失常可以在妊娠期间新发,也可以在原有心律失常基础上,妊娠期已控心律失常再次加重。心律失常的识别和适当的处理对于优化母婴结局至关重要。
病理生理
妊娠期心输出量增加30%~50%,心率每分钟增加10~15次,外周血管阻力下降。这些生理性改变在多胎妊娠中更为明显,心输出量增加60%~70%。这些生理变化在中期妊娠达到高峰,在临产和分娩时,由于子宫收缩的“自动输血”,心脏输出量进一步增加。拟交感神经张力也由于多种因素而增加,包括妊娠期间的神经激素变化、产程和分娩期间的疼痛和焦虑。
心肌细胞存在雌激素和孕激素受体。雌激素和孕酮对心肌细胞的下游效应尚不清楚,但研究表明这些激素在复极过程中发挥作用。妊娠期间的暂时性心脏重构可能有助于心脏发展为心律失常。心房扩大和拉伸可能会导致房性心律失常。
早搏
妊娠期房性和室性早搏很常见,在一项研究中有59%的妊娠女性会发生。早搏通常为良性,不必过于担心。然而,在部分患者中,早搏可能与结构性心脏病有关,需要进一步的检查和谨慎评估。
室早(PVC)可能是心肌病的最初表现,也可能发展为心肌病。PVC负荷与左室功能相关。大多数PVC诱发性心肌病发生于PVC负荷在24小时内超过10%的患者中。
一项对43例PVC患者53次妊娠的前瞻性研究,纳入病例为PVC负荷大于1%、平均负荷为13.9%、无结构性心脏病的患者。结果表明,PVCs在早孕期更常见。在53例妊娠中,有25例由于症状和/或PVC高负荷而开始β受体阻滞剂治疗。不良心血管事件发生率为11%,包括心力衰竭、持续性和非持续性室速。发生心血管事件的孕妇PVC负荷均大于5%。不良胎儿事件为13%,包括SGA和早产。
有明显症状且收缩功能正常患者不必过于担心。PVC的药物治疗适用于有症状或左室射血分数下降患者。一线治疗建议使用非二氢吡啶钙通道阻滞剂或β受体阻滞剂(不包括阿替洛尔)。
对非妊娠患者的房早(PACs)研究较多。频繁PACs(24小时内超过100次)会增加健康者和并存疾病患者(包括结构性心脏病)的新发房颤、室上速、心脏病发作和死亡风险。
室上速
室上速(SVT)是妊娠期第二常见的心律失常,妊娠住院发生率为22/10 万。SVT可能出现在妊娠任何阶段,但通常出现在妊娠中期。SVT表现为心悸突然发作,可能伴有呼吸困难、胸部不适或晕厥前兆。
房室结折返性心动过速(AVNRT)和房室折返性心动过速(AVRT)是最常见的SVT亚型。AVNRT以双房室结生理性顺行和逆行为特征传导。AVRT可能通过房室结或旁路传导。在逆向AVRT中,心动过速沿房室旁路顺行传导,经房室结逆向传导,形成规则宽大的复杂心动过速。逆向AVRT占5%~10%。
在SVT患者中,窦性心律心电图被评估为预激,预激可能无症状,并在心电图上间歇性出现。预激表现为短PR间期(小于120 ms),QRS上抬模糊,QRS延长大于110 ms。预激房颤患者可能会恶化为室颤。对于有晕厥或猝死的SVT患者,应考虑预激。
房颤
房颤是妊娠期最常见的心律失常,占因心律失常住院妊娠患者的27/10 万。在7项研究共301638例妊娠患者的荟萃分析中,结构性心脏病患者的房颤发生率明显高于非结构性心脏病患者(2.2% vs. 0.3%)。
妊娠期房颤的危险因素与非妊娠期相似。肥胖和年龄超过40岁会显著增加房颤风险。妊娠心脏病登记(ROPAC)中确定的房颤其他风险因素包括先天性心脏病、房颤病史、孕前使用β受体阻滞剂和心脏瓣膜病。
妊娠期房颤与不良母胎结局有关。不良胎儿结局包括宫内生长受限、呼吸窘迫综合征、脑室出血和新生儿ICU入院率较高。此外,用于心率控制的药物可能导致母体低血压和胎盘灌注减少,早产风险增加。不良母体结局包括心力衰竭和血栓栓塞事件。
房颤的处理与非妊娠状态相似。在非妊娠人群中,试验没有显示心率和节律控制策略在心血管结局及总死亡率方面的差异。目前没有可用数据比较心率控制和节律控制对母胎结局影响的差异。根据2018年欧洲心脏病学会指南,节律控制更适用于妊娠期房颤治疗。节律控制允许低剂量的心率控制药物,如β受体阻滞剂,此类药物可能导致低血压、宫内生长受限和新生儿低血糖。节律控制可以通过心脏复律和/或抗心律失常治疗来实现。
如果房颤在发病后24小时内没有终止,则应考虑心脏复律,妊娠期心脏复律是安全的,房颤发作后48小时内的心脏复律仍需抗凝治疗。心脏复律导致心房顿抑和激活血栓前因子。血栓栓塞事件发生风险在心脏复律后的第一个月最高;因此,心脏复律后至少应持续抗凝4周。延长或长期抗凝治疗应根据患者发生血栓栓塞事件的危险因素而定。如果不能准确判断房颤发作时间,应在复律前行经食管超声心动图检查。
对于非孕期妇女,CHA2DS2-VASc评分(充血性心力衰竭、高血压、年龄≥75岁、糖尿病、卒中或短暂性脑缺血发作、血管疾病、年龄65~74岁、性别分类)指导房颤的抗凝治疗。不分性别CHA2DS2-VASc评分大于1的患者推荐使用抗凝治疗,此类评分也可用于妊娠期房颤,但尚未在妊娠妇女中得以证实。在妊娠合并持续性房颤和心脏结构正常患者中,也有左心耳发生栓子的病例报告。阿司匹林、治疗性抗凝和预防性依诺肝素以及未抗凝处理均有报道。妊娠期房颤抗栓治疗方法各不相同。如果使用阿司匹林,剂量不应超过162 mg。完全剂量阿司匹林有增加动脉导管早闭风险。
不适当窦速
不适当窦速(IST)可能在妊娠期间出现,并且很难与体位性直立性心动过速综合征以及妊娠期生理性心率增加相鉴别。妊娠期间,心率每分钟增加10~20次,但静息心率很少超过每分钟95次。IST的特点是静息心率升高,心率超过每分钟100次,或在缺少继发因素情况下,24小时内平均心率超过每分钟90次。IST的症状包括心悸、疲劳、胸部不适、头晕,以及由于心率过高而导致的运动耐力下降。在已发表的病例报告中,IST似乎耐受性良好,不会对母体或胎儿造成不良后果。
室性心动过速
室性心律失常(VA)对母胎的发病和死亡构成显著风险。VAs最常见于结构性心脏病、缺血、遗传性心律失常综合征、药物或电解质异常引起的QT间期延长。在ROPAC对2966例妊娠患者(56%为先天性心脏病,32%为瓣膜性心脏病)的研究中,VAs发生率为1.4%。VAs的预测因素包括妊娠前NYHA分级超过1级和中/重度左心室功能障碍。VAs妇女死亡率有上升趋势(2.4% vs. 0.3%,P=0.15)。VAs更可能发生在有VAs史的妇女。
心律失常性右室心肌病
心律失常性右室心肌病(ARVC)的特征是心肌纤维脂肪移位和心肌变薄,导致心室增大和功能障碍。ARVC主要影响右室,但也可能发生左室功能障碍。心室功能障碍的程度与预后相关。ARVC可能有症状或伴有PVCs、室性心动过速或心源性猝死。心室功能不全前通常出现VAs。在ARVC患者中,VAs通常由肾上腺素能活动增加(如运动)触发。在ARVC患者妊娠期间,不良心血管事件并不少见。
Wu等回顾了120例ARVC患者的224例妊娠。91例(76%)妇女在诊断ARVC前妊娠,12例妊娠女性发生不良事件,包括VAs和心衰。不良事件发生率高的女性症状和左心室功能不全发生较早。在确诊ARVC后妊娠妇女中,产后1年的心室重构或功能没有明显变化。Hodes等的一项研究中,26例ARVC患者39次妊娠,5%发生心力衰竭,13%发生VAs。
肥厚型心肌病(HCM)
HCM是由于编码肌节蛋白的基因突变,在没有继发原因的情况下导致左心室壁厚度和质量增加。常染色体显性遗传,可能伴有或不伴有左室流出道(LVOT)梗阻。心衰、心律失常、卒中和心脏猝死是HCM患者的主要心血管疾病和死亡原因。在ROPAC登记研究中,使用植入式心律转复除颤器的HCM患者有22%发生VAs。在无植入式心律转复除颤器的HCM妇女中,VAs没有显著增加。
在9项研究的集合队列中,207例HCM妇女和408次妊娠,母亲死亡率低于1%,30%的妊娠出现症状恶化或心律失常。不良胎儿结局包括自然流产、死产和早产。孕产妇死亡由心脏猝死引起。在对妊娠妇女心血管疾病不良后果咨询时,应考虑到HCM心脏猝死危险因素。
遗传性心律失常综合征
遗传性心律失常综合征(IAS)包括先天性长QT综合征(LQTS)、儿茶酚胺敏感性多形性室性心动过速(CPVT)、Brugada综合征、短QT综合征、特发性室颤和早期复极综合征。关于IAS和妊娠结局的数据有限,因为很少有研究明确说明IAS类型。IAS不是妊娠绝对禁忌证。
LQTS是最常见的离子通道疾病,发生率约为1/2000。QTc大于500 ms和严重基因型(LQT2或LQT3)与扭转型室速的高风险相关。一项对76例LQTS和平均QTc间期515 ms妇女的136例妊娠研究发现,10.3%出现VAs。VAs风险持续至产后9个月。β受体阻滞剂治疗对妊娠期及产后可能发生的VAs有保护作用。LQTS患者使用β受体阻滞剂有一级指征,应在妊娠期和产后继续使用。
儿茶酚胺敏感性多形性室性心动过速(CPVT)
CPVT是一种罕见的遗传性心律失常综合征,常表现为晕厥、VAs,或在没有结构性心脏病或QT间期延长的情况下,因运动或情绪紧张突然死亡。多形性室速、双向性室速和室颤是CPVT特征。CPVT类似LQT1,尽管QTc间期正常,但误诊为LQT1并不罕见。CVPT的药物治疗包括非选择性β受体阻滞剂和氟卡尼。纳多洛尔是CPVT首选的β受体阻滞剂。
缓慢性心律失常
在妊娠期不常见。如果存在,通常是由于变时功能不全或高度房室传导阻滞,通常在孕前已出现。先天性心脏病修复或心脏手术史的妇女发生缓慢性心律失常风险增加。一项对18例妇女的25次妊娠研究表明,未经治疗的房室传导阻滞患者更有可能在妊娠期间出现传导疾病进展。与孕前稳定型房室传导阻滞相比,新发房室传导阻滞患者更可能需要干预。
诊断和管理
临床评估应以逐步方式进行,从详细的临床病史、产科史、家族史和体检开始。危险信号包括劳累性晕厥、由情绪压力和/或听觉刺激引发的晕厥、与心绞痛、胸痛或晕厥相关的心悸,以及突发性心脏病死亡家族史。
所有患者均应进行心电图检查,特别注意预激征象、病理性q波、心室肥大、传导延迟和间隔。基于症状发生频率应考虑移动心电监护或动态心电图监测。已有报道妊娠期使用植入式线圈记录仪。在一项对40例孕妇的研究中,植入式线圈记录器增强了对心律失常的监测,使得管理出现改变。
心律失常或频发室早应评估排除结构性心脏病。结构性心脏病的诊断影响妊娠期心血管并发症风险和药物治疗。经胸超声心动图易于操作,可以在妊娠期间进行对比增强。应根据临床情况考虑运动负荷试验或进一步影像学检查(表1)。
表1. 妊娠期心律失常的诊断与处理

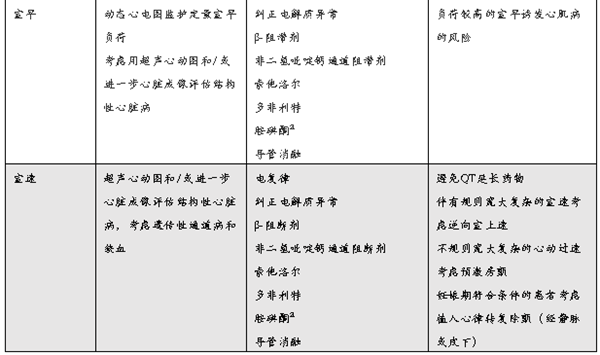
药物治疗
目前尚无关于妊娠期心血管疾病药物治疗的随机试验报道。大多数药物是FDA分类为C或D类药物。C类药物在人类妊娠中的数据有限,但在动物生殖实验中显示出对胎儿不利效应。D类药物在人类妊娠期间对胎儿有不良影响。鉴于妊娠期药物使用的有限数据,应权衡风险与获益。
在使用长期药物治疗前应考虑到触发心律失常因素。触发因素包括严重电解质紊乱、非法药物使用、添加剂以及某些产科用药,如特布他林和硫酸镁。严重的高镁血症可能导致心脏和呼吸停止。血浆浓度为5~10 mg/dL时,PR间期和QRS间期延长。当血浆水平大于10 mg/dL时,可能发生传导障碍和心脏骤停。重要的是,为了改善母胎结局,必须优先考虑产妇健康。
β受体阻滞剂(C类)
β受体阻滞剂增加宫内生长受限(IUGR)、早产和新生儿低血糖、心动过缓和低血压风险。一项对18477例妊娠高血压妇女的队列研究显示,在早孕期使用β受体阻滞剂与畸形或心脏畸形风险没有独立相关性。在早孕期使用β受体阻滞剂的剂量与先天畸形风险变化尚无报道。
因β1选择性β受体阻滞剂对IUGR影响较小、降低子宫活动性和扩张外周血管,在妊娠期应为首选。非选择性β受体阻滞剂与较高的IUGR发生率有关。由于先天畸形风险增加,阿替洛尔是唯一被列为FDA D级的β受体阻滞剂。妊娠期不建议使用阿替洛尔。
Grewal等最近的一项研究分析了出生体重的决定因素,以揭示β受体阻滞剂的相对影响。在1757例妊娠中,404例妇女使用β受体阻滞剂,最常见的是美托洛尔(72%)。β受体阻滞剂明显降低出生体重,体重降低小于200 g;然而,这不太可能是临床后果。美托洛尔组的出生体重降幅最小,为119 g。阿替洛尔组降幅最大,为466 g,因此不建议在妊娠期使用阿替洛尔。
钙通道阻滞剂(CCB,C类)
CCB与先天畸形风险增加无关。因其作用机制,CCBs可导致低血压和宫缩抑制。先前的研究表明,在妊娠晚期使用CCB会增加新生儿癫痫发作风险。然而,最近一项22908例妊娠的大型队列研究中没有显示该效应。地尔硫卓与动物致畸性有关,但在妊娠期没有研究。维拉帕米在妊娠与哺乳期被认为是安全的。
地高辛(C类)
地高辛主要影响静息心率,并常用作β受体阻滞剂或CCBs心率控制的辅助药物。地高辛也可用于射血分数降低的心衰。因为游离地高辛增加,肾清除率增加,因此妊娠期地高辛的血清水平不可靠。除了血清水平外,还应使用临床症状和体征来评估地高辛毒性。
腺苷(C类)
腺苷在妊娠期间使用是安全的,而且没有证据表明对胎儿有不良效应。腺苷的半衰期很短,向胎儿传递的可能性大大降低。如果刺激迷走神经无效,建议将其作为妊娠期紧急终止室上速的一线治疗。鉴于半衰期较短,应在肘窝或更近位置放置静脉输液管。给药方式为6 mg推注,然后用生理盐水快速滴注。随后可给予两次12 mg剂量。
氟卡尼(C类)
氟卡尼是一种钠通道阻滞剂,用于治疗室上速、房性心律失常和CPVT。氟卡尼能透过胎盘及出现于母乳中,用于治疗母胎心律失常。推荐与房室结阻断剂联合用药用于房颤和房扑患者。氟卡尼不应用于冠心病或结构性心脏病患者。
索他洛尔(B类)
索他洛尔具有β受体阻滞剂特性,有钾通道阻滞作用。由于其延长QT效应,存在尖端扭转型室速风险。QT延长效应在心率降低时最高。药物疗效在心率较高时被降低。
多非利特(C类)
多非利特是一种钾通道阻滞剂,与索他洛尔对照组相比,其延长QT效应更明显。多非利特必须在密切监测心电图的住院患者中使用。医务人员应密切注意药物相互作用,避免联合使用延长QT药物。
胺碘酮(D类)
对于难治性和/或危及生命的心律失常,胺碘酮应作为保留药物使用,因其具有不良胎儿效应,这种副作用与剂量和持续时间无关。胎儿不良影响包括先天性甲状腺肿、甲状腺功能减退、神经发育异常和早产。据报道,23%接触胺碘酮后的新生儿会出现暂时性甲状腺功能减退。哺乳期不建议使用胺碘酮。
直流电复律
目前心脏复律在妊娠期是安全有效的,对血流动力学不稳定患者应立即进行。操作过程中持续胎儿监护,对于有生机儿建议与母胎医学和儿科多学科协作。如需抗凝,应考虑胎龄和紧急分娩需要来选择合适的治疗方案。
电生理学治疗
导管消融在妊娠期可安全进行。对于难治性和/或危及生命的心律失常药物治疗无效者,可考虑导管消融术。如有可能,应在孕中期超声心动图指导下进行导管消融术,以尽量减少或消除辐射暴露。妊娠期植入心脏除颤器(ICD)和起搏器是安全的。ICD电击与胎儿的不良反应无关。
总结
心律失常,新发或原有心律失常加重,是妊娠期最常见的心血管并发症。应对心律失常患者进行详细评估,并在产前、产时和产后进行适当管理。心脏病科、母胎医学、儿科和麻醉科的多学科协作对优化母胎结局至关重要。
临床护理注意事项
心律失常是妊娠期最常见的心血管并发症,妊娠期发生率为68/10万。
有心律失常病史的妇女在妊娠期间再发风险很高(30%~50%)。
没有有效的风险模型来评估妊娠期非瓣膜性房颤血栓栓塞事件风险。CHA2DS2-VASc评分在妊娠期未做验证。高剂量阿司匹林增加动脉导管早闭风险。
室性心动过速应评估结构性心脏病、缺血(如妊娠相关心肌梗死、冠状动脉痉挛)、延长QT药物使用及遗传性离子通道病。
胺碘酮与不良胎儿效应有关,应作为保留用于难治性和危及生命的心律失常。
心脏复律、导管消融和植入心律转复除颤器在妊娠期是安全的。
来源:齐鲁母胎医学论坛
作者:张树泉
 妇产科在线APP下载
妇产科在线APP下载













