子宫肌瘤是女性生殖器最常见的良性肿瘤。子宫肉瘤属恶性变,发生率低(0.4%~0.8%),但恶性度高、预后差、误诊率高。临床上具有术前诊断难度大、术中冰冻要求高、术后处理争议多的特点。山西医科大学第二医院郝敏教授在本文中主要讲解了子宫肌瘤肉瘤变的发病特点、子宫肌瘤肉瘤变的临床特点、子宫肌瘤肉瘤变的诊断注意事项、子宫肌瘤肉瘤变的治疗现状四方面内容。

一、子宫肌瘤肉瘤变的发病特点
子宫肌瘤肉瘤变的发病特点主要有5个方面:(1)肌壁间肌瘤占2/3,少数为黏膜或浆膜下。(2)常由肌瘤中央开始恶变,周边区域为良性,因此,手术中应将完整肌瘤病灶切下进行病理诊断,以免发生漏诊。(3)多发性肌瘤中1~2个肉瘤变,其余为良性。(4)肉眼及镜下常可以见到假包膜。(5)镜下肉瘤和良性肌瘤的结构同时存在。
二、子宫肌瘤肉瘤变的临床特点
子宫肌瘤肉瘤变主要有3个临床特点:
(1)绝经前后异常阴道流血。绝经前阴道出血患者占43%,表现为月经量多、经期长、阴道不规则流血;绝经后阴道出血患者占52%,表现为阴道流血,量多或量少均有发生。
(2)子宫肿物快速增大及疼痛。子宫肌瘤迅速增大,临床上6个月内可增大1倍,绝经后肌瘤增大更应高度怀疑为子宫肉瘤。子宫肉瘤可因子宫过度膨胀或压迫临近器官而发生隐痛,亦可因瘤内出血、坏死或肉瘤破裂出血而发生急腹痛。
(3)异常阴道排液。排液稀薄,呈浆液性或血性,具有恶臭味的血性或脓性排液尤其要引起注意。
三、子宫肌瘤肉瘤变的诊断注意事项
(1)切忌过分依赖诊断性刮宫。子宫肌瘤肉瘤变病灶多位于肌壁间,诊断性刮宫易遗漏肉瘤组织,即便诊断性刮宫提示为阴性也不能排除肉瘤可能。
(2)掌握彩色多普勒超声的诊断特点。①回声:子宫肌瘤肉瘤变时子宫不规则增大,当病灶较小时,宫腔内呈高回声,有时呈“筛孔状”回声;病灶向肌层内浸润生长时,呈均质无“漩涡状”低回声,与肌层分界不清,内部回声杂乱。②血流:病变血管阻力指数(RI)均低于良性变肌瘤。以RI≤0.40为标准预测子宫肉瘤,其敏感度为90.91%,特异度为99.82%,此种情况手术时尽量不要使用旋切器,注重无瘤观念,正确认识微创理念。
2017年12月《中华妇产科杂志》发布的《子宫肌瘤诊治中国专家共识》中指出“电动旋切器粉碎肌瘤可能使隐匿的恶变组织播散,降低患者的生存时限。由于术前缺乏有效鉴别子宫肌瘤与肉瘤的方法,不建议继续使用肌瘤电动旋切器,医患双方应充分考虑其他治疗方案。”
(3)重视术前磁共振(MRI)检查的临床应用。超声检查可疑恶性变或已确诊为子宫肉瘤的患者可行MRI检查。MRI的优势:①具有较高的软组织分辨能力,T1、T2加权相可显示肉瘤病灶内部的结构特点和出血、坏死等特征性改变。②可准确判断病灶与内膜、肌层的关系和浸润程度。③对临床分期有很高的预测价值。诊断特点:①T1W1上可见斑片状高信号的出血灶,不规则、不均匀分布,增强扫描可见不规则强化,其间伴有低信号的坏死区,提示可能为子宫肉瘤。②T2W1上平滑肌肉瘤呈高信号,夹杂不规则的低信号,边界不清,提示可能为子宫肉瘤。
(4)培养术中仔细检查切除标本的良好习惯。手术治疗的标本在台上常规立即切开剖视;多发肌瘤逐个切开,仔细辨认;应注意切面是否呈鱼肉状、质地是否均匀一致,是否有出血、坏死,有无包膜,有无编织状结构等;应注意检查血管和淋巴管内有无蚯蚓状瘤栓。
(5)加强临床医师术中冰冻病检的意识。术中存在以下3种情况时高度怀疑子宫肉瘤,应进行冰冻病检:①肌瘤边界不清,失去漩涡状结构,呈红黄相间、质脆、鱼肉样、伴出血坏死,包膜不完整或者呈弥漫性生长者;②局限在子宫内膜,表现为息肉样赘生物,但伴有肌层浸润者;③宫旁组织和盆腔内有呈蚯蚓样扩张的淋巴管。
(6)提高病理学诊断水平。目前公认的组织学诊断标准:①细胞异型性中-重度,同时合并肿瘤细胞凝固性坏死;②细胞异型性中-重度,同时核分裂活跃(≥10/10HPFs),可无肿瘤细胞凝固性坏死;③细胞异型性轻度,但核分裂活跃(≥10/10HPFs),同时具有肿瘤细胞凝固性坏死。病理科医生应提高病理诊断水平,尤其是上皮样平滑肌肉瘤、黏液样平滑肌肉瘤。对于上皮样平滑肌肉瘤和黏液样平滑肌肉瘤这两种罕见的变异类型,其缺乏梭形细胞的镜下特征,核异型较轻微,有丝分裂相常<3/10HPF,包膜受侵是这两种肉瘤的主要诊断依据。上皮样平滑肌肉瘤可能无坏死灶,黏液样平滑肌肉瘤细胞数目减少。
(7)重视与各类子宫交界性平滑肌瘤鉴别。①富细胞性平滑肌瘤:肿瘤细胞丰富,但无细胞异型性,核分裂1~5/10HPF,缺乏肿瘤细胞坏死。②不典型平滑肌瘤:细胞丰富或不丰富,细胞轻度异型性,1~2/10HPF。③奇异型平滑肌瘤:瘤细胞核形奇异,可出现单核或多核瘤巨细胞,但无核分裂象。④核分裂活跃的平滑肌瘤:瘤细胞核分裂象增多至5~20/10HPF,但无细胞异型性。⑤上皮样平滑肌瘤:以上皮样瘤细胞为主,呈巢状分布,无细胞异型性,核分裂<5/10HPF。⑥不能确定恶性潜能的平滑肌瘤:瘤细胞轻度异型伴核分裂象3~5/10HPF,或中重度异型伴核1~2/10HPF。以上为常见的子宫交界性平滑肌瘤类型的病理特点,这种情况下可以安良性子宫肌瘤处理,但是术后有较高的复发率,约20%,术后要密切随访。
(8)免疫组织化学和分子标记物的使用。病理科也会用一些免疫组化和分子标记物检查,帮助进行诊断。可选用通常表达平滑肌组织的标志物,如连接蛋白、钙调解蛋白、平滑肌肌动蛋白和组蛋白去乙酰化酶8等;也可选用常表达CD10及上皮性标志物,如角质蛋白和组织上皮膜抗原等。约30%~40%的子宫肉瘤有雌激素、孕激素、雄激素受体表达,也可呈现Ki67和p16的高表达。
四、子宫肌瘤肉瘤变的治疗现状
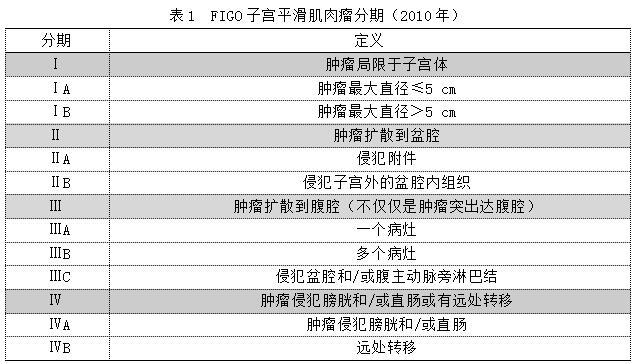
1.分期的变革和新分期应用注意事项
2009年以前,子宫肉瘤一直没有独立的分期标准,大部分采用1988年FIGO子宫内膜癌手术病理分期标准。由于子宫肉瘤组织学类型多样化,与预后相关对的危险因素难统一,故2009年FIGO对每一种不同的组织学类型采用不同的分期,以反映各自不同的生物学行为。2009年FIGO分期中将子宫肉瘤分为子宫平滑肌肉瘤(LMS)、子宫内膜间质肉瘤和腺肉瘤、子宫恶性中胚叶混合瘤3个分期。
2010年FIGO子宫平滑肌肉瘤分期(表1)应用注意事项:(1)仍为手术病理分期,未把术前影像学结果纳入分期。(2)腹水细胞学阳性仍不作为分期标准,但在处理时,应予以检查并作记录。(3)Ⅰ期摒弃肌层浸润对LMS预后的影响,主要考虑肿瘤大小(5 cm)的影响。(4)Ⅱ期采用肿瘤侵犯盆腔的标准,最主要的改变在于对待肿瘤侵犯宫颈及侵犯卵巢的不同。新FIGO分期把肿瘤侵及卵巢从ⅢA期降至ⅡA期。(5)肿瘤浸润其他盆腔组织从ⅢB期降至ⅡB期。(6)Ⅲ期不再强调转移的部位,而强调发生转移的数量。
2.目前手术治疗现状及相关问题
(1)术中诊断为子宫肌瘤肉瘤变的处理:2018年NCCN指南推荐:①局限于子宫者,可行全子宫±双附件切除;不能手术者,可选择盆腔放疗±阴道近距离放疗和/或化疗。②子宫外病灶者,可行全子宫±双附件切除+转移病变切除;不能手术者,可选择盆腔外照射放疗±阴道后装放疗和/或全身系统性治疗。某些特殊情况下,如宫颈肌瘤肉瘤变或肉瘤侵及子宫颈,则行广泛性全子宫切除术,同时行盆腔及腹主动脉旁淋巴结清扫术。
术中诊断为子宫肌瘤肉瘤变处理过程中的四大疑问:
①年轻未生育患者是否可保留生育功能?
Davids曾报告1150例肌瘤剔除术中,有5例肉瘤术中未能及时诊断,术后未做进一步处理。经随诊5年,均良好存活,其中3例术后受孕。Levenback认为,如肉瘤较小,低度恶性,除外来源于子宫肌瘤恶变,可考虑保留子宫,但应充分知情同意并密切随访。因此,子宫肉瘤组织类型繁杂,相比其他类型而言,子宫肌瘤肉瘤变具有恶性度相对较低的特点。临床上可根据患者的生育愿望,在充分之情的条件下处理个体化。
②绝经前患者是否可保留卵巢?
Leitao等观察108例LMS总的卵巢转移率为3.7%,其中71例Ⅰ、Ⅱ期患者的转移率为2.2%,均为镜下转移。37例Ⅲ、Ⅳ期患者的转移率为5.4%。一项包括1396例LMS的大样本研究认为,双侧附件切除不是影响LMS患者预后的独立因素。NCCN指南也推荐,在临床工作中根据患者实际情况考虑保留年轻早期患者的卵巢。因此,目前不推荐对于临床期别早、绝经前、ER/PR(-)的LMS患者行常规的双侧附件切除术,但应让患者充分知情。
③是否行淋巴清扫和大网膜切除?
NCCN指南并未对盆腔淋巴结切除作出明确说明。有研究发现是否行淋巴结切除术对患者5年生存率无影响,但循证医学证据不足。而LMS患者主要经血行播散,淋巴结转移率很低,为6.6%~11%,且淋巴结转移时往往有子宫外病灶,故如术中探查无淋巴结增大和子宫外病灶,一般不需行淋巴结清扫;术中探查如发现异常增大的淋巴结或存在子宫外转移病变,常规行淋巴结切除或活检,可以同时切除大网膜。
④腹腔镜分碎术是否可造成医源性种植?
Park等对56例病变局限在子宫的早期LMS进行分析,其中25例经腹腔镜手术进行分碎术,结果发现,对早期LMS术中进行分碎术者的盆腹腔与阴道肿瘤复发率明显高于未进行者。FDA也有统计分析,认为每350例行子宫肌瘤切除术的患者中即有1例是子宫肉瘤,而该患者一旦术中使用子宫粉碎器切除组织,造成肿瘤腹腔内播散,将显著降低其生存时限。据统计,我国子宫肌瘤患者中肉瘤发病率约0.64%,并不低于美国的1/350(0.29%)。但我国不同学者进行的统计略有差异。不过,以上这些数据都说明的确存术前无法发现的子宫肉瘤风险。
基于存在肿瘤播散的潜在风险,在一个医疗器械安全警告匮乏的时代,美国食品与药品监督管理局(FDA)于2014年4月17日建议医生在子宫切除术时停止使用子宫粉碎器。美国FDA提出的警示应引起大家的重视,但也不能就此因噎废食,彻底否定既往经验,从而损害大部分患者的利益。操作该类手术的关键在于:临床医师术前应充分考虑到肉瘤的可能性,做好术前鉴别诊断和医患沟通。一旦怀疑肌瘤肉瘤变,则尽可能避免分碎术,行开腹手术。术中应做好恰当的防护,包括防护袋的使用和充分的盆腹腔冲洗,尽可能仔细地清除分碎术时残留的肿瘤碎片。术后病理报告出现恶性后及时采取补救措施。
(2)子宫肌瘤剔除术后诊断为肉瘤的处理:①有生育要求者:愿意承担风险者,可用超声、盆腹腔MRI或CT等来重新评估,无可疑发现,应严格随访,建议完成生育后切除子宫。WHO指出其5年生存率低于卵巢癌,因此应该重视完成生育后切除子宫的建议。②无生育要求者:对于LMS诊断明确者,则应再次开腹手术,对于无子宫外病灶的LMS患者行全子宫+双附件切除;对于有子宫外转移的LMS患者,则应争取行全子宫+双附件切除及子宫外病灶的彻底切除,同时行盆腔及腹主动脉旁淋巴结清扫术。
3.术后辅助治疗及相关问题
NCCN(2018)指南推荐:Ⅰ期LMS患者,术后辅助治疗措施包括:①观察;②化疗(2B级证据);Ⅱ期和Ⅲ期患者可选择化疗和/或考虑外照射放疗;ⅣA期行化疗和/或外照射治疗;ⅣB期行化疗±姑息性外照射放疗。
术后化疗:目前国内外对LMS术后化疗存有争议。NCCN强烈推荐子宫肉瘤患者入组参与临床试验。首选单药多柔比星60 mg/m2,间隔3周,有效率为10%~25%。对晚期或复发患者,建议采用联合化疗。异环磷酰胺(5 g/m2)+多柔比星(50 mg/m2)是国内治疗LMS最常用的一线化疗方案,有效率为30%~40%。采用吉西他滨(900 mg/m2,第1,8天)+多西紫杉醇(100 mg/m2,第8天),每3周1次,据报道结果总反应率53%。目前国外作为晚期LMS的一线化疗方案。
术后放疗:关于术后放疗,美国检测流行病学(SEER)数据库中1396例LMS患者的资料认为,无论是LMS期别早晚,辅助放疗并未改善患者的5年生存率。美国国家肿瘤(NOD)数据库920例LMS患者的回顾性研究则表明,术后放疗提高了患者的5年局部无瘤生存率,但不能提高Ⅰ期无淋巴结转移者的5年生存率。目前国内资料也显示:术后辅助放疗可能有助于控制LMS患者的局部复发,可以降低远处转移的复发率,但无法提高其5年生存率。
因此,目前对LMS术后化疗和术后放疗尚存在争议。
五、小结
临床医师应注重子宫肌瘤患者绝经前后的异常阴道流血,术时仔细检查切除的肿物标本,重视手术中冰冻病检,避免漏诊或误诊的发生。治疗处理中既要考虑肿瘤的分期,又要考虑到患者的生理功能和生育功能的保留,避免治疗不足和过度治疗。
 妇产科在线APP下载
妇产科在线APP下载













