根据我国国家癌症中心的数据,2007-2016年期间,我国子宫内膜癌的年龄标准化发病率每年增加2.6%,死亡率则每年下降1.9%[1]。大多数子宫内膜癌患者在被诊断时处于早期,整体预后较为良好。我国子宫内膜癌的5年平均生存率为72.8%,早期子宫内膜癌患者5年生存率甚至可达90%以上[2]。正因为大多数内膜癌患者有较好的预后,对于早期患者治疗方式的选择更注重高生存质量的需求:如保留生育功能、保留生理功能、手术微创化,更强调治疗的精准性,避免治疗过度或不足。对于晚期内膜癌其治疗目标仍在于生存率的提高。
子宫内膜癌的国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期从1950年首次提出,经历了多次修订(1961年、1971年、1988年、2009年)。2009年版本的子宫内膜癌分期在临床实践中得到广泛应用。但随着分子遗传学的飞速发展,对子宫内膜癌的病理学和分子特征的认识不断深入,同时大量临床研究对子宫内膜癌相关高危因素进行了深入探究,单纯沿用2009年版本的分期已不足以全面反映患者的风险程度和指导预后。在这样的背景下,2023年的新版FIGO分期系统应运而生。
1、新版本分期的改变
相较于2009年版的FIGO分期,2023年版在制定分期标准时结合了更多预后影响因素,如组织学类型、分子分型、淋巴脉管浸润(lymph-vascular space invasion, LVSI)程度以及淋巴结转移状况等,从而更准确地反映了子宫内膜癌的风险程度和预后状况。其中最显著的变化出现在I、II期,也是子宫内膜癌最多见的期别。对比2009年版和2023年版的分期系统,见表1。
表1 2009年版和2023年版对比
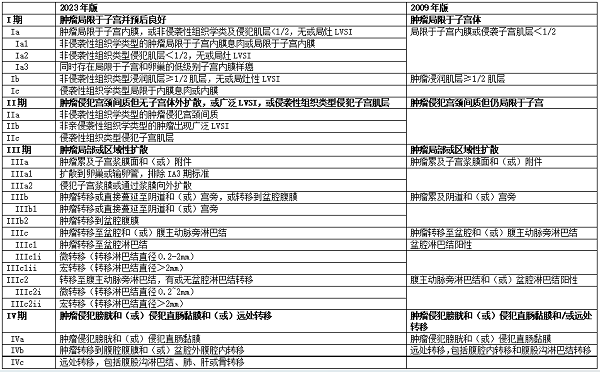
1.1 I期
2009年版和2023年版FIGO分期系统中对I期的描述均为“肿瘤局限于子宫体”,但在新版分期不再简单按照子宫肌层浸润深度分为Ia和Ib期,而是根据组织学类型、淋巴脉管浸润程度以及肌层浸润状况综合考虑。
新版分期中Ia1期为局限于子宫内膜息肉或子宫内膜,组织学类型为非侵袭性。Ia2期为非侵袭性组织学类型的肿瘤侵犯肌层<50%,无LVSI或局灶性LVSI。Ia3期是指同时存在局限于子宫和卵巢的低级别子宫内膜样癌,并且符合:肌层侵犯深度小于50%;无广泛LVSI;无转移、卵巢肿瘤仅限于单侧卵巢内且包膜完整无包膜侵犯。值得注意的是新版Ia3期患者在2009年版的分期系统中为IIIa期。在诊断Ia3期时需要注意与子宫内膜和卵巢的双原发癌进行区分。1998年Scully提出了区分双原发性癌以及转移性癌的标准并沿用至今,对于子宫内膜癌合并卵巢癌,若组织学类型不同则为双原发癌(按照内膜癌及卵巢癌进行各自分期),如果组织学类型相同则根据内膜是否存在非典型增生,肌层浸润、LVSI以及卵巢是否存在子宫内膜异位症、交界性等前驱病变来决定是双原发癌或转移性癌。
Ib期指非侵袭性组织学类型侵犯50%或以上的子宫肌层,伴有或不伴有局灶性LVSI。
新版Ic期指具有侵袭性组织学类型,局限于子宫内膜息肉或局限于子宫内膜,新版Ic期患者在2009年版为Ia期,2023年新版分期上升。值得注意的是对于局限于子宫内膜的侵袭性内膜癌患者虽然预后良好,但完整的分期手术仍然必要。研究证明约40%的高级别类型(尤其是浆液性癌)病灶局限于息肉或内膜,但手术分期发现已出现淋巴结或腹膜转移[3],因此实际上为III期。
1.2 II期
2009年版分期系统中II期为“肿瘤侵犯宫颈间质但仍局限于子宫”,在2023年新版分期里II期为“肿瘤侵犯宫颈间质但无子宫体外扩散,或广泛LVSI,或侵袭性组织类型侵犯子宫肌层”。这一变化增加了两个重要提升分期的重要因素(广泛LVSI和侵袭性组织学类型侵犯肌层),这使得既往2009年分期系统中的I期的患者会因为合并广泛LVSI或者为侵袭性组织学类型侵犯子宫肌层而变成2023年分期系统中的II期患者,也使得II期患者数量明显增加。这一变化也体现出广泛LVSI和侵袭性组织学类型对预后的重要影响。
1.3 III期
2009年版和2023年版FIGO分期系统中对III期的描述均为“肿瘤局部或区域扩散”,2023年新版分期对III期的改变主要在于细分亚分期,以更准确地反映肿瘤的生物学行为特征。
(1)IIIa期在2009版和2023版分期中均指子宫和/或附件受累,区别在于新分期进一步细分为IIIa1和IIIa2。IIIa1指的是附件受累,而IIIa2指的是子宫浆膜面受累。这样的区分更好地捕捉了肿瘤的行为差异,特别是在高级别子宫内膜样癌和非子宫内膜样腺癌的患者中更有意义。
(2)IIIb期的细分:IIIb1与以前的IIIb期类似,涉及到阴道和(或)宫旁。而盆腔腹膜受累现在被归类为IIIb2(2009分期中为IVb期)。
(3)IIIc期的细分:IIIc期进一步细分为淋巴结微转移(IIIc1i,IIIc2i)和淋巴结宏转移(IIIc1ii,IIIc2ii),这种细分基于那些存在淋巴结微转移患者的预后,同时反映了前哨淋巴结技术和超分期在临床实践中的不断发展。
1.4 IV期
2023年新版FIGO IV期中最要的改变是重新定义了IVb期,盆腔外腹膜转移的病例分类为IVb期,腹膜转移不超出盆腔的为IIIb2期。而在2009旧版分期中无论盆腔还是腹腔腹膜转移均为IVb期。新版分期IVa期无变化(见表1),而远处转移,包括腹股沟淋巴结或肺、肝、脑或骨的转移,被归为IVc期。
1.5 I/II期患者根据分子分型结果修正分期
2023年版新分期系统根据分子分型结果是否存在POLEmut和p53abn调整分期。具体原则如下:
(1)POLEmut,局限于子宫体或侵犯宫颈(I-II期),无论LVSI程度与组织学类型如何,统一降级为IA期并记录为IAm-POLEmut。
(2)P53突变局限于子宫体的子宫内膜癌,伴子宫肌层侵犯,伴或不伴有宫颈侵犯(I-II期),无论LVSI程度或组织学类型,统一升级为IIC期并记录为IICm-p53abn;若无肌层浸润,分期维持不变。这与欧洲肿瘤学会(European Society of Gynaecological Oncology,ESGO)分子分型风险分层中则根据肌层浸润与否将P53突变型归为中危组(无肌浸)和高危组(有肌浸)类似。III期和IV期患者的分期不受分子分型结果影响,但也应当记录分子分型的结果。
2、新分期系统中组织病理学的解读
2.1 侵袭性组织学类型
既往将子宫内膜癌按照雌激素依赖与否分为I型和II型子宫内膜癌。I型子宫内膜癌(低级别内膜腺癌)生长较缓慢,细胞有序,通常与雌激素异常分泌有关,预后相对较好,常见为G1/G2的子宫内膜样腺癌;而II型子宫内膜癌生长更快,细胞分化程度差,通常与雌激素无关,预后较差且有较高的转移风险,通常为高级别(G3)子宫内膜样腺癌及其他特殊组织学类型。
新版分期明确指出侵袭性组织学类型的定义:G3子宫内膜样腺癌、浆液性腺癌、透明细胞癌、未分化癌、混合性癌、癌肉瘤、其它少见的类型例如中肾管样腺癌、胃肠道黏液性腺癌。在2020 世界卫生组织(World Health Organization,WHO)分类中认为黏液性腺癌与子宫内膜样腺癌有相同的分子类型及疾病进程,并与侵袭性组织学类型里的胃肠道黏液性腺癌截然不同,因此将它作为低级别子宫内膜样腺癌的一个变异同属于非侵袭性组织学类型[4]。
新分期也明确了非侵袭性组织学类型的定义:包括G1/G2子宫内膜样腺癌以及黏液性腺癌。在2009年版本的FIGO分期中,未将组织学类型作为分期的考量之一,旧分期系统主要基于肿瘤浸润转移的深度和广度。而在2023版新FIGO分期中明确不同组织学类型对于预后具有重要影响,并将其纳入分期影响因素,更好地反映不同病理类型子宫内膜癌的生物学行为和临床特征。
2.2 LVSI
LVSI在子宫内膜癌中被认为是一个重要的生物学特征,具有重要临床意义。LVSI指的是肿瘤细胞侵犯了衬覆内皮的淋巴管或血管腔隙,被认为是肿瘤扩散和预后不良的一个指标[4]。在2023年版的FIGO子宫内膜癌分期系统中,采用了WHO和ESGO的定义(广泛LVSI定义为一张HE切片上≥5个血管被侵犯)。尽管在2009版FIGO分期系统中没有将LVSI纳入分期,但随着时间的推移,临床研究逐渐证实了其在预后评估和治疗决策中的重要性,故2023版FIGO新分期系统,将LVSI纳入分期影响因素,是对于LVSI在子宫内膜癌中重要意义的更进一步确认。
2.3 卵巢受累情况
既往将子宫内膜癌出现卵巢转移或播散的情况划分为III期,然而,随着临床研究不断深入,越来越多临床研究证实同时存在于子宫和卵巢的低级别子宫内膜样腺癌具有良好的预后,并且往往不需要后续的辅助治疗[5-6]。子宫内膜和卵巢肿瘤存在克隆关系,肿瘤发生在子宫内膜再“限制性转移”至卵巢,这部分患者预后良好[7-8]。2020年WHO和ESGO指南建议如果子宫内膜和卵巢同时为低级别癌可给予较为保守的治疗。在这一背景下,2023年新的分期系统将这类患者归为Ia3期。此分期调整的目的在于更精细地评估患者的预后,并将更加个体化的治疗策略融入临床实践,从而避免过度治疗,确保每位患者都能获得最适合自身情况的治疗方案。
2.4 淋巴结状态的评估
对于淋巴结状态的评估是子宫内膜癌手术分期评估的重要环节。如何准确评估淋巴结转移情况成为了临床所需解决的关键问题。对于临床分期为Ⅰ期的子宫内膜癌患者,盆腔和腹主动脉旁淋巴结转移的整体风险分别为9%和6%,而高分化子宫内膜癌的风险则分别为3%和2%。尤其是当肿瘤病灶局限于子宫内膜层时,淋巴结转移率更是低于1%[9]。此外,一些研究也指出,在早期子宫内膜癌患者中,进行系统性淋巴结切除并未显著改善生存率,反而可能增加淋巴囊肿、感染等并发症的风险[10]。在此背景下,对于无高危因素的子宫内膜癌患者,淋巴结切除范围有越来越小的趋势。目前低危子宫内膜癌患者行前哨淋巴结(sentinel lymph node,SLN)切除已达成共识,而高危子宫内膜癌患者行SLN切除是否安全尚存争议。
2023年新版子宫内膜癌FIGO分期的更新,更加精细地考虑了淋巴结转移状况的评估,同时推荐SLN切除来进一步提高淋巴结转移判断的准确性。借鉴乳腺癌的指南,采用了类似的分类标准,以更具临床可操作性的方式来定义淋巴结转移的状况。具体而言,根据肿瘤细胞的直径和数量来划分:
(1)微转移:肿瘤细胞直径在0.2~2 mm之间,或肿瘤细胞数量超过200个。
(2)宏转移:肿瘤细胞直径超过2 mm。有相关临床研究表明,接受前哨淋巴结切除后微转移的患者在接受辅助治疗后的生存率与淋巴结阴性的患者相当,且优于宏转移患者[11-12]。
3、分子分型首次进入子宫内膜癌分期系统
3.1 分子分型的种类
自子宫内膜癌分子分型的概念提出以来,其已受到广泛的重视和应用。2013年,癌症基因组图谱(The Cancer Genome Atlas,TCGA)通过对373例子宫内膜癌的多组学研究,将子宫内膜癌划分为了4个主要类型:POLE基因超突变型(POLEmut)、微卫星不稳定高突变型、低拷贝数型和高拷贝数型[13]。近十年来,借助二代测序技术以及免疫组化染色检测错配修复蛋白和p53蛋白,子宫内膜癌分子分型进一步细分为4类:POLE突变型、错配修复缺陷型(mismatch repair-deficient,dMMR)、无特殊分子改变型(no specific molecular profile,NSMP)和p53异常型(p53abn)[14]。自此以后,子宫内膜癌逐渐步入了分子分型的新时代。新分期的发布,也从“鼓励”分子分型变成“要求”子宫内膜癌患者进行分子分型。
3.2修正分期的意义
修正分期的重要意义在于对“POLEmut的侵袭性子宫内膜癌”和“p53abn的非侵袭性子宫内膜癌”患者重新分期。首先,POLEmut的子宫内膜癌患者表现出极佳的预后,复发率和死亡率均较低,占所有子宫内膜癌病例的6%~8%。在高级别子宫内膜样腺癌中更高达15%。而如前文所述,新版本分期对侵袭性组织学类型的定义包含了高级别宫内膜样腺癌[15],POLEmut型也存在于其他组织学类型中,如透明细胞癌、癌肉瘤以及去分化/未分化癌。这些具有组织学高侵袭性的POLE突变患者,以传统的组织病理学分类为依据则可能导致过度治疗,因此在临床实践中需要采用分子检测来准确辨识并制定相应治疗方案。
另外p53蛋白异常型(p53abn)可出现于多种子宫内膜癌组织学类型中,尤其是浆液性癌中的比例高达93%,在低级别子宫内膜样癌(EEC)中占5%。尽管在低级别ECC中阳性比例较低,但由于低级别EEC占据总EEC比例的85%,基数庞大,因此低级别EEC合并p53abn的患者绝对数量仍较多[16]。低级别EEC在组织学上形态良好,一旦出现p53abn并伴有超出子宫内膜或息肉的病灶,则预后较差,因此需要通过分子分型结果修正分期。
4、新分期系统对子宫内膜癌患者治疗决策的思考的诊断
2023年版的FIGO分期在制定分期标准时考虑了更多预后影响因素从而更准确地反映子宫内膜癌的风险程度和预后。同时也对子宫内膜癌患者治疗决策带来变革与挑战。
4.1对保留生育功能治疗决策的影响
多个指南(NCCN/ESGO/中国)对于子宫内膜癌保留生育治疗适应证已经达成基本共识,无肌层浸润的G1子宫内膜样腺癌患者可进行保留生育功能治疗,使用宫腔镜病灶切除联合孕激素为基础的药物治疗方案,完全缓解率约为71.3%~95.3%,妊娠率为37.5%~86.8%[17]。但部分适应证目前尚存争议。
按照新分期系统,部分Ia1和Ia2患者可以在充分告知的情况下尝试保留生育功能治疗。对于无肌层浸润的G2或浅肌层浸润的G1子宫内膜样腺癌患者,ESGO及部分中国专家共识认为,虽保育治疗风险较高,但未将其纳入绝对禁忌证。据报道,无肌层浸润的G2子宫内膜样腺癌患者保育治疗完全缓解率约73.9%~80%,妊娠率约40%,复发率约30%;浅肌层浸润的G1子宫内膜样腺癌患者保育治疗的完全缓解率为60%~73.9%,但复发率较高,约为47%[18-19]。
新分期系统对保育治疗影响最大的是Ia3期(同时存在局限于子宫和卵巢的低级别子宫内膜样癌,肌层浸润<50%,局限于单侧卵巢未突破浆膜面)。大量的临床研究证实此类患者预后良好,早在2013年有学者探究此类型患者保育治疗成功妊娠的个案[20]。但在既往手术病理分期为IIIa期的背景下,妇科肿瘤专家对此类患者保育治疗的探索保持审慎态度,这可能导致一些潜在适合接受保育治疗的患者错过了保育机会。新版本分期降低了此类患者的分期和风险等级,从而为此类患者保留生育功能治疗提供了更强的临床支持。
根据目前各大指南证据以及2023年新版本分期系统的变化,内膜癌保育治疗主要适用于Ia期患者。而以下情况能否保育尚需商榷和斟酌:
(1)新版本分期中特别强调了广泛LVSI致使分期上升为II期,因预后较差且存在转移风险而不适宜保育。但保育治疗的患者因为保留子宫仅进行宫腔镜或诊刮内膜活检,很难准确地评估LVSI状态。因此对于内膜癌保育患者如何精准确认广泛LVSI状态尤为重要。
(2)新版本分期系统掺杂了分子分型后修正分期。新版分期系统鉴于P53abn分子亚型对预后的不良影响,将病变超出子宫内膜及息肉的P53abn患者分期上升为IICm-p53abn,不宜进行保育治疗。2023 ESGO子宫内膜癌保育指南以及个别我国专家共识建议对于P53abn患者不予保留生育功能。但对于P53abn且病变局限于子宫内膜层的G1/G2内膜样癌患者,其在新版分期仍属于Ia1期,在ESGO风险分层也属于低危组,笔者认为这部分患者仍可尝试保育治疗,尚需积累经验为后续保育提供依据。
(3)因POLE突变而从Ib及II期降为IAm-POLEmut期的患者是否能像Ia期一样进行保育尚待探讨。由于此类患者存在宫颈侵犯、广泛LVSI、非侵袭性组织类型伴有深肌层浸润或侵袭性类型伴有肌层浸润,保育治疗可能存在巨大风险,应当审慎而为。但若是从Ic期(侵袭性组织学类型局限于子宫内膜或息肉),降为IAm-POLEmut期者,能否通过充分评估排除子宫外及淋巴结转移的情况下尝试保育值得进一步探索。
4.2 术后辅助治疗决策的影响
肿瘤的术后病理分期除了具有评估预后的意义,还有另一重要作用是对于术后辅助治疗进行指导。新版本分期涵盖了目前已知影响预后的重要高危因素(肌层浸润、组织学类型、LVSI程度、分子分型等),与ESGO/EMSO指南的风险分层不谋而合,也弥补了2009年版分期的不足。
目前NCCN指南暂未将分子分型纳入具体风险分层或依据分子分型制定术后辅助治疗方案。在没有与新版分期系统匹配的术后治疗指导意见发布之前,辅助治疗的选择建议参照2022年ESMO(European Society of Medical Oncology,欧洲内科肿瘤学会)子宫内膜癌风险分层指导意见进行管理[22]。将此分层与2023年FIGO新分期相结合,新分期中Ia期患者为低危组,不推荐接受辅助治疗。其中新定义的Ia3期患者,ESMO并未将此类患者进行分层,但大量临床研究证实此类患者预后良好,此类患者亦无需补充后续治疗。对于因POLEmut而降分期为IAm-POLEmut期的患者,若术后无残留病灶也不建议予以辅助治疗。Ib期患者<60岁为低危组可随访观察,大于60岁为中危组首选阴道近距离放疗。
总体来讲,结合ESMO风险分层及现有临床证据,2023年新分期能更好指导患者术后辅助治疗的选择,I期患者仅有少数(Ib,年龄>60岁)需要接受术后辅助治疗,II期及以上患者均需术后接受后续治疗。新分期发布以后,尚需在临床实践中进一步证实其合理性,也期待新指南或专家共识对术后辅助治疗提供详尽的临床可操作性强的指导意见。
参考文献:
1.国家癌症中心. 2019中国肿瘤登记年报[M]. 北京:人民卫生出版社. 2021:312
2.Zeng H, Chen W, Zheng R, et al. Changing cancer survival in China during 2003–15: a pooled analysis of 17 population-based cancer registries[J]. The Lancet Global Health, 2018, 6(5): e555-e567.
3.Ouyang C, Frimer M, Hou LY, et al. Malignant endometrial polyps in uterine serous carcinoma: the prognostic value of polyp size and lymphovascular invasion[J]. Int J Gynecol Cancer,2018,28(1):524-528.
4.Berek, JS, Matias-Guiu, X, Creutzberg, C, et al. FIGO staging of endometrial cancer: 2023[J]. Int J Gynecol Obstet,2023,162(2): 383-394.
5.Stålberg K, Bjurberg M, Borgfeldt C, et al. Lymphovascular space invasion as a predictive factor for lymph node metastases and survival in endometrioid endometrial cancer –a Swedish gynecologic cancer group (SweGCG) study[J]. Acta Oncol,2019,58(11):1628-1633.
6.Assem H, Rottmann D, Finkelstein A, et al. Minimal uterine serous carcinoma and endometrial polyp: a close clinicopathological relationship[J]. Hum Pathol,2021,118(1):1-8.
7.Hui P, Kelly M, O‘Malley DM, et al. Minimal uterine serous carcinoma: a clinicopathological study of 40 cases[J]. Mod Pathol,2005,18(1):75-82.
8.Rabban JT, Zaloudek CJ. Minimal uterine serous carcinoma: current concepts in diagnosis and prognosis. Pathology,2007,39(1):125-133.
9.Rungruang B, Olawaiye AB. Comprehensive surgical staging for endometrial cancer[J]. Reviews in Obstetrics and Gynecology, 2012, 5(1): 28.
10.Kitchener H, Swart A M, Qian Q, et al. Efficacy of systematic pelvic lymphadenectomy in endometrial cancer (MRC ASTEC trial): a randomised study[J]. Lancet (London, England), 2008, 373(9658): 125-136.
11.Mueller JJ, Pedra Nobre S, Braxton K, et al. Incidence of pelvic lymph node metastasis using modern FIGO staging and sentinel lymph node mapping with Ultrastaging in surgically staged patients with Endometrioid and serous endometrial carcinoma[J]. Gynecol Oncol,2020,157(3):619-623.
12.Bogani G, Mariani A, Paolini B, et al. Low-Volume disease in endometrial cancer: the role of micrometastasis and isolated tumor cells[J]. Gynecol Oncol,2019,153(3):670-675.
13.Talhouk A, McConechy MK, Leung S, et al. A clinically applicable molecular-based classification for endometrial cancers[J]. British journal of cancer, 2015, 113(2): 299-310.
14.Raffone A, Travaglino A, Mascolo M, et al. TCGA molecular groups of endometrial cancer: Pooled data about prognosis[J]. Gynecologic Oncology, 2019, 155(2): 374-383.
15.Vermij L, Smit V, Nout R, et al. Incorporation of molecular characteristics into endometrial cancer management[J]. Histopathology, 2020, 76(1): 52-63.
16.Leon-Castillo A, Horeweg N, Peters E E M, et al. Prognostic relevance of the molecular classification in high-grade endometrial cancer for patients staged by lymphadenectomy and without adjuvant treatment[J]. Gynecologic oncology, 2022, 164(3): 577-586.
17.Yang B, Xu Y, Zhu Q, et al. Treatment efficiency of comprehensive hysteroscopic evaluation and lesion resection combined with progestin therapy in young women with endometrial atypical hyperplasia and endometrial cancer[J]. Gynecologic oncology,2019,153(1):55-62.
18.Park JY, Seong SJ, Kim TJ, et al. Pregnancy outcomes after fertility-sparing management in young women with early endometrial cancer[J]. Obstetrics & Gynecology,2013,121(1):136-142.
19.Casadio P, Guasina F, Paradisi R, et al. Fertility‐sparing treatment of endometrial cancer with initial infiltration of myometrium by resectoscopic surgery: a pilot study[J]. The Oncologist,2018, 23(4):478-480.
20.Atallah D, Safi J, El Kassis N, et al. Simultaneous early ovarian and endometrial cancer treated conservatively with spontaneous pregnancy[J]. Journal of Ovarian Research,2013,6(1):1-4.
21.Mariani A, Dowdy SC, Keeney GL,et al. High-risk endometrial cancer subgroups: candidates for target-based adjuvant therapy[J]. Gynecologic oncology,2004,95(1):120-126.
22.彭诗意,郑 莹.基于分子分型的子宫内膜癌风险分层及辅助治疗选择—ESGO-ESTRO-ESP、ESMO/NCCN指南解读[J].实用妇产科杂志,2023,39(10):746-751.
来源:实用妇产科杂志2024年1月第40卷第1期 journal of practical obstetrics and Gynecology 2024 jan.Vol.40.No.1
专家简介

郑莹 教授
四川省学术和技术带头人、四川省卫生计生委学术技术带头人、国家卫健委“一带一路”高级妇科内镜培训专家委员会副主任委员、中国妇幼保健协会腹腔镜学组常任委员、四川省医师协会机器人外科医师分会常任委员、四川省健康教育协会常任委员、四川省国际医学交流促进会常任委员、世界华人妇产科医师协会NOTES微创医学专业委员会委员、中国医师协会微无创专业委员会单孔与阴道腔镜手术专业委员会委员、中国医师协会内镜医师分会委员、中华医学会计划生育分会肿瘤生殖学组委员、四川省医学会妇产科分会委员、四川省妇科内镜学组委员。现任《四川大学学报华西医学版》《实用妇产科杂志》《中国妇产科临床杂志》编委、《妇产与遗传(电子版)》常务编委。获得“成都首届优秀医师”称号。从事妇产科临床、科研和教学工作30余年,有丰富的临床工作经验,主要研究方向为妇科肿瘤和妇科微创治疗,专注妇科常见病、多发病以及妇科恶性肿瘤的微创诊治,精于妇科恶性肿瘤保留生育功能治疗,尤其是子宫内膜癌及癌前病变保留生育功能治疗的多学科诊治,擅长多孔、单孔腹腔镜,v-NOTES,机器人手术,执笔并参与多项相关专家共识的制定。率先在国际上首次报道单孔腹腔镜免举宫宫颈癌根治术和单孔腹腔镜肾静脉水平淋巴结清扫的早期巢癌分期手术,创新性探索单孔腹膜外入路淋巴结切除。主编国内外首部《妇科单孔腹腔镜手术视频集》并获得四川省重点出版规划项目,单孔妇科恶性肿瘤手术视频曾获2018年第27届欧洲腔镜年会“最佳视频优胜奖”提名。曾在《Cancer Research》、《Cochrane Database of Systematic Reviews 》《Journal of Minimally Invasive Gynecology》等国际知名期刊上发表论文,国内外刊物上发表论文90余篇,SCI 33篇。参编人民卫生出版社八年制规划教材《妇产科学》及专业著作8部。负责国家重大疾病多学科合作诊疗能力建设项目-妇科恶性肿瘤多学科诊疗平台建设项目、国家十四五重大课题负责人、国家自然科学基金面上项目、四川省科技重点研发项目、四川省科技支撑项目、市科技局及世界妇产科联盟合作项目等10余项课题研究。并获得包括发明、实用新型在内的专利30余项。
专家简介

彭鸿灵教授
彭鸿灵,女,博士学位,副主任医师,2014年毕业于四川大学华西临床医学院临床八年制,现就职于四川大学华西第二医院妇科。对处理妇科、妇科肿瘤专业常见疾病、疑难杂症具有丰富的临床经验。娴熟各种妇科及肿瘤开腹手术及妇科腔镜微创手术,并能实时跟踪国际发展动态,提高诊疗效果。主要科研方向为妇科肿瘤、循证医学。参与国家科技重大专项课题,四川省科技重点研发项目,四川省医学会课题,成都市医学会课题共5项,总经费达200万。以第一作者发表文章13篇,其中SCI论文10篇,最高影响因子38分,代表作发表在Signal Transduction and Targeted Therapy 、Frontiers in immunology、Acta Obstetricia et Gynecologica Scandinavic,BMC pregnancy and childbirth等杂志上。
 妇产科在线APP下载
妇产科在线APP下载













