【病例荟萃丨第③期】新辅助化疗后晚期卵巢癌患者,PARP抑制剂维持治疗真实世界应用证据
- 2023年10月30日
- 阅读 2486
- 点赞 3
- 评论 0

对于晚期卵巢癌患者,延缓复发、延长无化疗间期、降低死亡风险是目前治疗面临的极大挑战,也是治疗的目标。随着PARP抑制剂的问世,满意手术、规范化疗、精准维持,已经成为卵巢癌全程管理的“三部曲”,显著改善了患者的生存结局。然而,部分晚期卵巢癌患者常伴有广泛的盆腹腔转移,临近组织浸润严重,初始肿瘤细胞减灭术(PDS)有时难以彻底切除病灶。对于这类患者,应该怎么制定治疗方案?以下3例新辅助化疗(NACT)后的晚期卵巢癌患者,PARP抑制剂维持治疗真实世界应用的结果可能会给临床提供参考。
合并高血压BRCAwt/HRD未知的卵巢癌患者
基因检测:BRCAwt/HRD状态未知
疗效评估:至最近一次随访,PFS已达2年4个月,复查CA125、PET-CT未见异常不良反应:期间曾出现轻度胃肠道等不良反应,未予处理,未调整尼拉帕利剂量卵巢癌是一种严重威胁妇女健康的肿瘤,在我国女性恶性肿瘤发病率中位居第三,但其病死率却居首位。随着医学技术的发展,目前“手术+化疗+维持治疗”已经成为卵巢癌的标准治疗模式。但是鉴于每个患者的病情的差异,关于手术方式、手术时机、化疗及维持治疗的药物选择等方面,仍在进行大量的探索。具体到该病例,觉得有两方面需要值得参考,一方面是手术方式的选择,一方面是有基础疾病BRCAwt/HRD未知患者维持治疗时药物的选择。
诊疗启示一:手术方式的选择
目前对于晚期卵巢癌的手术方式主要有两种,一种是PDS,一种是NACT+IDS。由于术前高危因素多、手术难以达到满意减灭(R0,即肉眼无残留病灶)水平时,会在手术前使用化疗药物。近年来,NACT+IDS应用被认为是一种替代一线治疗的方法,是一种个体化诊疗的体现。该患者CT的Suidan评分>3分,评估手术达R0可能性小,决定行NACT+IDS。研究发现,NACT可促使肿瘤细胞进入“休眠”状态,降低肿瘤细胞的扩散、种植,降低术后复发率,减少术后并发症(包括出血、静脉血栓栓塞、感染、尿失禁等不良反应)的发生风险,从而提高患者术后生活质量,更容易被患者接受,尤其适用于晚期卵巢癌患者。目前新辅助化疗能否改善患者的总生存期和无进展生存期、以及新辅助化疗后的铂耐药问题仍存在很大的争议,但是,对于晚期卵巢癌患者,NACT显然是一种有用的治疗选择。希望未来能有更多的研究致力于有效解决化疗耐药等问题,从而更好地让新辅助化疗造福于卵巢癌患者。
诊疗启示二:维持治疗时药物的选择
基于大量临床试验以及真实世界研究数据,初治晚期卵巢癌患者化疗达缓解之后,进行规范化维持治疗的理念逐步得到医患双方的认同。而PARP抑制剂维持治疗成为卵巢癌治疗领域的一匹“黑马”,显著推迟了患者复发时间,延长患者PFS。《卵巢癌PARP抑制剂临床应用指南(2022版)》提出,对于Ⅲ~Ⅳ期卵巢癌、输卵管癌和原发性腹膜癌患者,推荐PARP抑制剂用于一线维持治疗(1类)。其中,不管初始化疗中是否使用贝伐珠单抗,无论BRCA与HRD状态如何,均适用尼拉帕利,基本覆盖了卵巢癌全人群。另外,从《2023中国卵巢癌诊疗现状白皮书》可以看到,尼拉帕利作为卵巢癌一线维持治疗及复发维持治疗(铂敏感,二线及以上)的全人群选择,其适应证均被纳入医保项目,极大地降低了患者的治疗成本。
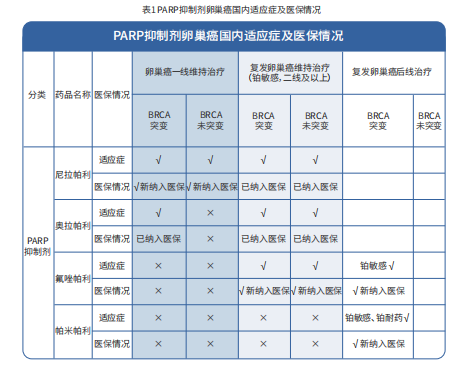
目前,PARP抑制剂已成为大部分卵巢癌患者维持治疗的不二选择。然而,对于合并基础病的患者,如高血压、高血脂、糖尿病等,在考虑PARP抑制剂不良反应的同时,还应该考虑长期服用的其他药物和PARP抑制剂之间的相互作用。在临床常用的PARP抑制剂中,奥拉帕利经CYP3A途径代谢,卢卡帕利经CYP2D6途径代谢,而尼拉帕利经羧酸酯酶途径代谢。羧酸酯酶途径参与内源性与外源性酯类的代谢,相较于CYP代谢途径,更多代谢的是机体内源性产物,药物代谢明显少于CYP途径,与其他药物合用时相互作用的风险小。
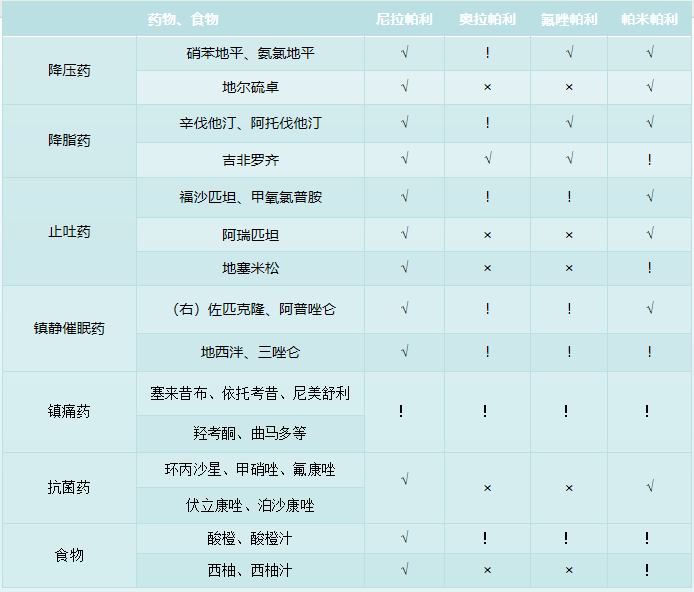
图片参考自《PARP抑制剂药物相互作用管理中国专家共识(2023版)》
本期我们分享的这例病例,经过NACT、手术、术后化疗达CR后,选择尼拉帕利200 mg qd维持治疗方案,至最近一次随访,PFS已达2年4个月,期间曾出现轻度不良反应,均未处理,未调整尼拉帕利剂量,维持治疗期间CA125在正常范围内波动,复查PET-CT未见确切肿瘤残留及复发征象,另外患者血压控制良好。这例患者的诊疗结果证实新辅助化疗后选择尼拉帕利维持治疗的有效性显著,为卵巢癌真实世界的研究再添有力数据,增加了患者接受治疗的信心。
BRCAwt/HRD阳性的卵巢癌
诊疗经过
疗效评估:PFS已达2年4个月,肿瘤标志物在正常范围内,影像学检查较前未见明显变化 对于初治卵巢癌患者选择PDS亦或NACT-IDS,主要出于3个方面的考量,即肿瘤对化疗的敏感性、患者对手术的耐受性以及肿瘤的可切除性。
目前国内外临床实践指南及专家共识多建议,国际妇产科联盟(FIGO)分期Ⅲ~Ⅳ期、体能状态差无法耐受手术者(如肿瘤消耗状态、合并大量胸腹水和合并多种慢性疾病等),PDS难以达到满意的肿瘤细胞减灭术,并且组织病理学类型为高级别浆液性癌或者子宫内膜样癌患者,特别是转移瘤直径>45 mm的ⅢC和Ⅳ期的卵巢癌患者可选择NACT+IDS方案。
分析病例发现,该患者病情分期较晚,新辅助化疗后有残留病灶,给予TP方案5周期后达PR,且基因检测为BRCAwt,均为高复发的危险因素,及时启动一线维持治疗是延长卵巢癌复发、延长患者生存的重要手段。PRIME、PRIMA等多项临床研究已证实,对于新诊断的Ⅱ~Ⅳ期卵巢癌患者,在手术和以铂类为基础的治疗后达到CR或PR,给予PARP抑制剂维持治疗可带来临床获益。
PRIMA研究是一项探讨尼拉帕利单药作为晚期卵巢癌患者一线维持治疗的III期临床试验。研究结果证实,在ITT人群中,尼拉帕利可降低34%的疾病进展或死亡风险;在HRD阳性亚组中,尼拉帕利组mPFS较安慰剂组延长13.3个月(24.5个月 vs. 11.2个月),降低疾病进展或死亡风险高达57%(HR=0.43),证实了尼拉帕利单药对HRD阳性人群的显著获益。
PRIME研究采用个体化起始剂量用药方案,2023年7月,PRIME研究原文荣登JAMA Oncology杂志。结果显示,在ITT人群中,尼拉帕利组的mPFS达24.8个月,约是安慰剂组的3倍(8.3个月);在gBRCAwt/HRD阳性人群中,尼拉帕利组的mPFS为24.8个月,较安慰剂组延长近一年(11.1个月)的PFS,助力患者长生存获益。
本期分享的病例是一位BRCAwt/HRD阳性患者,经过NACT、手术、化疗达PR后,选择尼拉帕利200 mg qd维持治疗方案,截止病例发布前PFS已达2年4个月,耐受性良好。该患者的诊疗结局,增加了卵巢癌患者的治疗信心。

基因检测:BRCA/HRD阴性
初始治疗
术后化疗:TC方案(多西他赛+卡铂)3周期,1周期后达CR,期间出现IV度骨髓抑制,改为PE方案(盐酸表柔比星+顺铂)5周期术后化疗:异环磷酰氨+奥沙利柏2周期化疗,出现IV度骨髓抑制维持治疗:初始服用尼拉帕利300 mg qd ,出现骨髓抑制,主要是血小板下降,7个月后减量至100 mg qd疗效评估:服药至今PFS达2年,期间CA125长期保持低水平状态,影像学未见异常不良反应:初始服用剂量为300 mg qd期间,出现血小板下降,多次输注血小板治疗,后减量至100 mg qd,无明显不良反应,耐受性良好术后化疗:予6周期白蛋白紫杉醇+卡铂+贝伐珠单抗化疗疗效评估:截止最近随访日期PFS已达12个月,CA125、HE4保持稳定不良反应:服药至今未出现3、4级血液毒性不良反应,无剂量减停,生活质量良好由吴小华教授领衔的针对中国人群开展的尼拉帕利维持治疗铂敏感复发卵巢癌的全国多中心Ⅲ期随机对照试验——NORA研究再次验证了尼拉帕利对于PSR卵巢癌全人群的获益。
NORA研究结果显示,ITT人群中,接受尼拉帕利的患者疾病复发或死亡风险下降68%(HR=0.32,95% CI为0.23~0.45),PFS较安慰剂组延长12.9个月(18.3个月v.s. 5.4个月);非gBRCA突变患者中,PFS较安慰剂组延长7.2个月(11.1个月v.s. 3.9个月),mOS为43.1个月,长于安慰剂组的38.41个月,HR值为0.855,校正后的总生存期(OS)分析显示尼拉帕利组mOS较安慰剂组延长10.5个月,HR值为0.624。
另外,尼拉帕利治疗期间最常见的不良事件是血小板减少、贫血和中性粒细胞减少。NORA研究结合中国患者特点,依据体重和血小板计数调整治疗初始剂量,针对性地将基线体重<77 kg或血小板计数<15万/μl患者的起始给药剂量调整为200 mg qd,不影响疗效,且增加了用药安全性和耐受性。本例患者初始诊断为右卵巢癌肉瘤合并高级别浆液性癌ⅢC期,基因检测示BRCA/HRD阴性,铂敏感复发两次。鉴于该患者首次铂敏感复发出现多处转移,给予新辅助化疗,提高R0切除率。同时,在两次复发化疗后均给予了PARP抑制剂尼拉帕利进行治疗。首次铂敏感复发维持治疗给予患者尼拉帕利300 mg qd,后续出现骨髓抑制,主要是血小板下降,并逐渐减量至100 mg qd维持治疗,治疗时间近2年;随后再次铂敏感复发,手术、化疗后给予尼拉帕利200 mg qd治疗,服药至今未出现3、4级血液毒性不良反应,无剂量减停,截止最近随访日期,治疗近1年,期间未见复发迹象。本病例也印证了这一个体化剂量方案的科学性和安全性。另外,本病例值得探讨的一个问题是,之前使用过尼拉帕利,复发后是否还可以继续使用?虽然有过类似的小样本试验的探索,但目前指南尚未就此方案进行明确。从本例来看,在患者第三次手术和术后化疗以及抗血管生成药物治疗后,仍然继续使用尼拉帕利且依旧有效,说明这是一个可以尝试的可行方案。究其原因,我想主要是因为初次使用尼拉帕利剂量较低为100 mg,第二次再用时采用200 mg也可以起到很好的效果。当然对于这些问题还需要后续更多大样本研究进行探索和证实。
免责声明:本网所发科普内容仅供参考,请遵医嘱。本网所发布的会议通知,如非特别注明,均来源于互联网,本网转载出于向广大妇产科医生及妇产科从业者传递更多信息、促进学术交流、学习之目的,并不意味着本网赞同其观点或证实其内容的真实性,请广大妇产科医生认真鉴别。如转载稿涉及版权等问题,请立即联系管理员,我们会予以更改或删除相关文章,保证您的权利。对使用本网站信息和服务所引起的后果,本网不负任何责任。

相关文章
 妇产科在线APP下载
妇产科在线APP下载













