摘要
多囊卵巢综合征(PCOS)是育龄女性常见的内分泌代谢疾病,其发病机制尚不清楚。越来越多的研究表明 PCOS患者常伴有肥胖、胰岛素抵抗和慢性、低级别炎症,这与子宫内膜功能障碍密切相关。来自北京大学第三医院妇产科李蓉教授团队近期发表在Gynecology and Obstetrics Clinical Medicine 2022年第3期的Effects of immune cells and cytokines on the endometrial immune microenvironment in polycystic ovary syndrome 总结了免疫细胞和炎性细胞因子对PCOS患者子宫内膜免疫微环境的作用,肥胖和胰岛素抵抗对子宫内膜炎症稳态的影响,以及可能的药物干预措施。
引言
多囊卵巢综合征(PCOS)是一种常见的内分泌代谢疾病,是育龄女性无排卵性不孕的主要原因。PCOS在中国汉族女性中的患病率为7.8%。根据鹿特丹诊断标准,满足以下三种特征中的两种时,即可诊断为PCOS,(1)高雄激素血症;(2)稀发排卵;(3)卵巢多囊形态。研究发现,PCOS患者需要辅助生殖技术(ART)助孕的可能性是无PCOS患者的8到10倍。
PCOS患者在控制性超促排卵后可获得更多卵母细胞,但卵母细胞质量往往较差,受精率、卵裂率和着床率较低,流产风险较高。即使有自发排卵的PCOS患者发生不良妊娠结局的风险也比非PCOS女性增加5倍。这提示除排卵障碍外,其他因素也对PCOS女性妊娠结局有一定影响。研究发现,在PCOS患者的着床窗口期,一些与子宫内膜容受性相关的标记分子表达明显改变,子宫内膜功能异常可能是PCOS患者生育能力低下和妊娠结局不良的另一个重要因素。
胚胎着床诱导子宫内膜免疫激活和稳态重建。在子宫内膜蜕膜化过程中,固有免疫细胞,特别是巨噬细胞、树突状细胞(DC)、和子宫自然杀伤细胞(uNK)通过调节免疫反应、生长因子水平和子宫血管的适应,促进滋养细胞入侵。炎性细胞因子如肿瘤坏死因子α(TNF-α)、 白细胞介素6(IL-6)、IL-1β和干扰素γ(IFN-γ)也参与了这一过程。
一项Meta分析显示,PCOS患者血浆C反应蛋白(CRP)、IL-18、IL-6、趋化因子配体3(CCL3)、单核细胞趋化蛋白1(MCP-1)、巨噬细胞迁移抑制因子(MIF)和白细胞(WBC)计数均升高。其中,MIF水平与黄体生成素和游离睾酮水平呈正相关。动物实验发现雄激素可以通过激活NF-κB和NLRP3信号通路诱导卵巢局部炎症反应。大鼠经DHT处理后,血清炎性细胞因子(TNF-α和IL-1β)水平增加,卵巢炎症细胞聚集。此外,雄激素是蜕膜化的重要调节剂,参与调节子宫内膜修复和增殖,子宫内膜间质细胞中表达大量雄激素受体。这些结果表明雄激素可能介导PCOS患者子宫内膜慢性低级别炎症的发展。
除生殖障碍外,PCOS女性常伴有代谢异常。孟德尔随机化分析反映了BMI/胰岛素抵抗(IR)与PCOS之间的因果关系。BMI和胰岛素抵抗较高的PCOS女性接受ART治疗后自然流产风险增加 。因此,肥胖和胰岛素抵抗可能影响PCOS患者的子宫内膜免疫微环境。这篇综述聚焦于PCOS患者子宫内膜免疫微环境的特点,为更深入地了解PCOS的发病机制提供思路。
PCOS患者子宫内膜免疫细胞成分的变化
研究表明,在早孕期间,30%~40%的脱落细胞是白细胞,在胚胎着床时,许多免疫细胞被招募到着床位点,以建立母体对半异体胎儿的特异性耐受。蜕膜免疫细胞由65%~70%的uNK细胞、10%~20%的巨噬细胞、2%~4%的DC细胞和少量T细胞组成。最近一项研究表明,体重正常的女性中,PCOS患者子宫内膜中免疫细胞的数量与正常对照组不同,表现为CD68+和CD163+ M2巨噬细胞、CD1a+未成熟树突状细胞、CD83+成熟树突状细胞(DC)和CD8+T细胞的百分比升高。PCOS患者的晚期分泌期子宫内膜中CD56+/CD16-和CD56bright/CD16-百分比较低,而CD3+细胞百分比较高。
此外,PCOS患者外周血中T调节细胞(Treg)数量减少。Treg细胞的数量在排卵期子宫内膜达到峰值,子宫蜕膜中的Treg细胞在孕中期升高,出生前下降。此外,Treg细胞可释放炎症因子,如转化生长因子-β(TGF-β)、IL-10和CTLA4,介导M2巨噬细胞和树突状细胞抗炎和耐药表型的激活,抑制uNK细胞在蜕膜化过程中的细胞活性。PCOS患者的上述变化将打破母胎界面微环境的动态免疫平衡。滋养层侵入障碍,蜕膜血管重构缺陷,母体耐受能力不足,这些因素对胚胎的着床和妊娠细胞的维持都有不利影响。免疫细胞对子宫内膜局部微环境的影响及其机制仍有待进一步研究。
PCOS患者子宫内膜细胞因子的变化
研究发现正常体重的PCOS女性存在病理性子宫内膜炎症,表现为子宫内膜NF-κB p65(Rel A)表达升高。NF-κB p65(Rel A)与PCOS患者血清总睾酮水平呈正相关。NF-κB信号通路的激活抑制巨噬细胞向M2亚群分化,促进炎性细胞因子释放和滋养细胞凋亡,从而影响胚胎着床。PCOS患者增殖期子宫内膜中促炎因子IL-18表达增加(表 1)。研究表明PCOS 增殖期子宫内膜炎症反应的激活可能是由toll样受体4 (TLR4) -干扰素-调节因子7(IRF-7)- NF-κ b信号通路引起的,并可被二甲双胍抑制。
此外,增殖期PCOS女性患者的子宫内膜蛋白质组学研究显示,PCOS患者子宫内膜中Haptoglobin(Hp)水平明显降低,载脂蛋白A1(ApoA1)水平升高。这一结果表明,抗炎因子的差异表达介导的慢性炎症激活可能参与了PCOS患者子宫内膜功能障碍。
PCOS女性分泌期子宫内膜中,循环TNF-α和IFN-γ水平显著升高,这与CD44和骨桥蛋白(OPN,为子宫内膜容受性标志物)的表达呈正相关。先前的研究表明趋化因子配体10(CXCL10)、IL-15和IL-18参与了蜕膜化过程中uNK细胞的激活。PCOS女性分泌期子宫内膜中 CXCL10、IL-15和IL-18 mRNA和蛋白表达水平均低于正常对照组(表1)。此外,PCOS女性子宫内膜蜕膜化受损可能是由子宫内膜基质成纤维细胞炎症细胞因子的分泌增强介导的,包括IL-6、IL-8、MCP1、CCL5和粒细胞-巨噬细胞集落刺激因子(GM-CSF)、基质金属蛋白酶2(MMP2)和MMP3。这些促炎因子的异常激活破坏了子宫内膜的免疫稳态,可能最终导致胚胎着床障碍。
表1 多囊卵巢综合征(PCOS)子宫内膜中炎症因子表达及主要功能综述
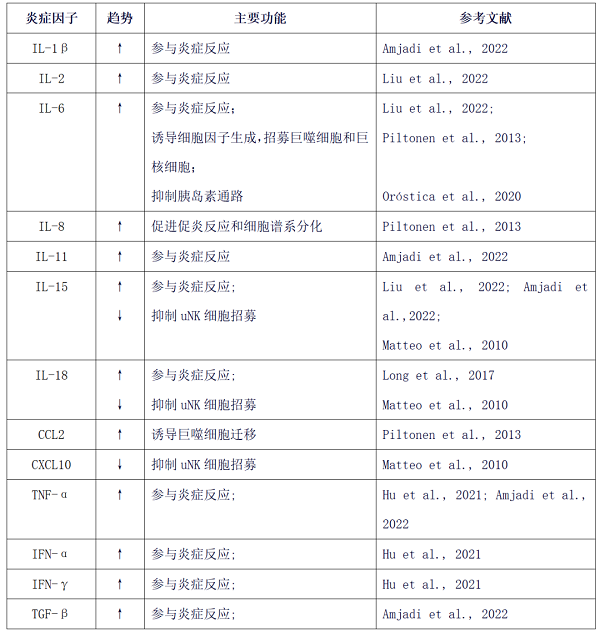
↑上调;↓下调。
IL:白介素;CCL2:C-C基序趋化因子配体2;CXCL10:趋化因子配体10;
TNF-α:肿瘤坏死因子α;IFNγ:干扰素γ;TGF-β:转化生长因子-β;uNK:子宫NK细胞
肥胖对PCOS患者子宫内膜的影响
一项包括不同地区和种族的meta分析显示,PCOS女性的肥胖率为49%。研究发现PCOS患者中WBC计数与睾酮水平和BMI呈正相关,MCP-1和CCL3水平与中央脂肪团呈正相关。此外,BMI和IR是PCOS中CRP水平升高的主要预测因素。一些研究也表明,肥胖和IR而非高雄激素血症是导致PCOS女性WBC计数升高的主要因素。因此,我们推测PCOS患者的子宫内膜炎症不仅由雄激素调节,还可能与肥胖和IR有关。
超重PCOS患者子宫内膜NF-κB p65(Rel A)表达增加,CD68+巨噬细胞比例和数量升高;增殖期子宫内膜IL-6水平升高,子宫内膜间质成纤维细胞多种炎症因子表达上调,包括补体成分4A和4B(C4A/B), C-C motif 趋化因子配体2(CCL2),细胞间粘附分子1(ICAM1),TNFAIP等,而子宫内膜间充质干细胞中只有IL-8和ICAM1的表达上调。超重PCOS患者增殖期子宫内膜IL-18表达升高,但与IR无关。肥胖PCOS患者分泌期子宫内膜TNF-α受体2(TNFR2)表达增加,这可能与子宫内膜NF-κB细胞核含量增加有关。因此,肥胖是导致PCOS中子宫内膜炎症反应激活的重要因素之一。
PCOS患者胰岛素抵抗对子宫内膜的影响
先前研究显示,大约50%~70%的PCOS患者有IR。与对照组相比,多囊卵巢患者发生妊娠期糖尿病的风险增加3倍,早产风险增加2倍。一方面,IR引起的高血糖状态可增强炎症反应和高雄激素血症。BMI的升高直接加重了PCOS患者的IR程度。肥胖女性 PCOS患者的IL-18水平较高,且与胰岛素敏感性呈负相关。此外,PCOS患者的CD56+NK、CD163+M2巨噬细胞百分比和子宫内膜NF-κB表达与IR显著正相关。胰岛素处理子宫内膜间质细胞系可激活NF-κB,导致体内TNF-α、IL-6等炎性因子表达增加。在伴有 IR的PCOS患者中,子宫内膜葡萄糖转运体4(GLUT4)表达明显降低,抑制葡萄糖摄取,诱导IR。
另一方面,炎症因子水平升高可能加剧PCOS中胰岛素信号的异常。体外实验证实,TNF-α处理子宫内膜细胞可增加胰岛素受体底物-1(IRS1)-s270磷酸化,而IL-6可降低IRS1-y61249磷酸化。此外,TNF-α还可降低子宫内膜细胞中GLUT4 的表达,从而引起子宫内膜局部IR。因此,IR可能加剧PCOS患者子宫内膜免疫稳态的破坏。
药物干预
许多研究发现,一些药物可以改善PCOS患者子宫内膜的免疫微环境。二甲双胍已被广泛用于改善PCOS女性的胰岛素敏感性。研究表明多囊卵巢患者在体外受精或ICSI之前和期间接受二甲双胍治疗将显著增加妊娠率和活产率。机制上,二甲双胍作用于子宫内膜基质细胞可降低IL-1β和IL-658表达,激活p38-MAPK 炎症信号通路,降低MMP-2、MMP-9和PGR的表达,从而抑制子宫内膜基质细胞的蜕膜化。但也有的研究认为二甲双胍不能改善妊娠结局。
短效GLP-1类似物艾塞那肽可通过降低糖尿病大鼠的子宫内膜氧化应激和TGF-β水平来减轻子宫内膜损伤,抑制纤维化。对小鼠模型的研究发现,高雄激素小鼠存在子宫内膜蜕膜化和血管生成障碍,以及uNK细胞异常。氟他胺(非甾体抗雄激素)治疗可有效改善以上问题。氟他胺可改善PCOS患者子宫动脉低搏动指数,恢复经睾丸激素处理后子宫内膜上皮细胞系HOXA10的表达,提高子宫内膜容受性。体外实验证实,氟他胺能显著抑制PCOS子宫内膜NF-κb的激活,下调IFN-α和IFN-ɣ的表达。因此,氟他胺除了改善代谢紊乱、降低雄激素水平和诱导排卵外,还可改善PCOS的子宫内膜功能。
维生素D治疗PCOS大鼠模型后,子宫内膜、上皮和间质厚度均增加,Caspase-3介导的细胞凋亡和增殖明显减少。维生素D能促进巨噬细胞和DC的分化和成熟,增强Treg细胞的功能,抑制NK细胞活化和细胞毒性。然而,没有充分的临床证据表明维生素D能改善PCOS子宫内膜容受性和妊娠结局。因此,需要更多研究来探索和阐明这些药物改善PCOS患者子宫内膜免疫微环境的机制。
局限性
目前的研究存在以下局限性。(1)PCOS患者子宫内膜炎症与子宫内膜功能障碍之间的因果关系不确定,相关分子机制有待阐明。(2)子宫内膜炎症细胞和细胞因子在不同时期表达谱的变化未揭示,这一研究需要对大量样本作进一步分析。(3)雄激素是否与肥胖和IR协同调节子宫内膜免疫反应,还需进一步研究。
结论
总之,子宫内膜炎症反应的异常激活可能是PCOS患者ART助孕不良妊娠结局的重要原因。PCOS患者子宫内膜免疫细胞数量和组成异常,各种细胞因子紊乱,导致子宫内膜局部慢性炎症的发生。慢性炎症反应的激活与肥胖、IR和雄激素水平升高密切相关。此外,药物干预有望通过降低炎症细胞因子的水平来改善子宫内膜功能,但这还需更多研究和临床数据来探索相应机制,进而为改善PCOS患者辅助生殖助孕后的妊娠结局提供新的思路。

原文链接:https://www.keaipublishing.com/en/journals/gynecology-and-obstetrics-clinical-medicine/本文内容来自Elsevier合作期刊Gynecology and Obstetrics Clinical Medicine(GOCM)第二卷第三期发表的“Effects of immune cells and cytokines on the endometrial immune microenvironment in polycystic ovary syndrome.”
DOI:10.1016/j.gocm.2022.10.001
引用格式:
Ye ZH,Zhao J,Li R. Effects of immune cells and cytokines on the endometrial immune microenvironment in polycystic ovary syndrome. Gynecol Obstet Clin Med.2022;2(3).in press.


 妇产科在线APP下载
妇产科在线APP下载













