
一、宫颈AIS的临床特点
宫颈AIS患者平均诊断年龄在35~40岁,其病变多数为单发病灶,邻近转化区,常深入宫颈管的深部;约有6.3%~17%的患者病灶呈跳跃性、多灶性。近60%的宫颈AIS患者合并有宫颈上皮内瘤变(CIN)。宫颈AIS常缺乏典型的临床表现,少数表现为异常阴道流血或排液。
二、宫颈AIS的诊断
(一)宫颈AIS诊断特点
①现有宫颈癌筛查方法对宫颈AIS不敏感;
②阴道镜下宫颈AIS病变的改变常无特异性;
③病灶多位于宫颈管内,不在阴道镜检查范围内;
④宫颈AIS病变部分呈跳跃性、多灶性,即使切除的标本切缘阴性,也不能完全排除病变残存的可能性。
(二)诊断方法
1、细胞学检查
典型的AIS细胞排列成群或带状,表现为花环状、羽毛状、拥挤状和/或细胞边界不清的分层状特征。由于病变位于宫颈管内,且病理科医生对于腺上皮异常的诊断往往经验不足,细胞学诊断宫颈AIS的准确率仅为50%左右,假阴性率高达3.8%~11.7%,容易造成临床的漏诊。
2、HPV检测
ECA及宫颈AIS的发生与HPV感染密切相关,95%~100%的宫颈AIS患者呈HPV阳性,其中HPV16、18、45为最常见的HPV亚型。薄层液基细胞学检查(TCT)和HPV联合检测是宫颈AIS的初始筛查方法。应用HR-HPV-DNA、HC2-HPV-DNA检测诊断宫颈AIS及以上病变的敏感度可达90%。
3、阴道镜检查
宫颈细胞学检查发现腺细胞异常,除明确提示腺细胞来源于子宫内膜以外,均需及时转诊阴道镜。2017年ASCCP阴道镜标准提出,当细胞学筛查结果是非典型腺上皮细胞、HPV16/18阳性,或阴道镜检查宫颈呈轻度或半透明的醋酸白改变(即在视觉上考虑为鳞状上皮化生或低度病变)时,即应在阴道镜下进行活检。
2021年版子宫颈原位腺癌诊断与管理的中国专家共识提出,由于宫颈AIS病变隐匿或位于宫颈管内,且在阴道镜下的表现缺少特征性,阴道镜下活检常难以准确取材。因此,建议HPV结合细胞学、阴道镜、宫颈多点活检及宫颈管取样的病理。TCT结果为非典型腺细胞(AGC)伴HPV16/18阳性、其他类型高危HPV阳性或无明确诊断意义的不典型鳞状细胞及更严重级别时,应进行充分阴道镜评估、活检和子宫颈管取样。
4、宫颈管取样
子宫颈管取样包括宫颈管搔刮(ECC)和宫颈细胞刷(ECB)这两种技术。ECB敏感性更高,推荐阴道镜下活检时以ECB取代ECC。由于目前ECB在国内尚未普及,临床评估采用ECC或ECB均可。
5、宫颈锥切
宫颈AIS与ECA在诊断上常混淆,宫颈AIS的最终诊断依赖于诊断性锥切结果。
Jordan等回顾性分析了105例宫颈AIS与宫颈早期腺癌病例,经活检提示的46例宫颈AIS行宫颈锥切术后病理确诊,仍有29%为浸润性腺癌。
Santipap等发现,经宫颈筛查后发现宫颈AIS的病例,多数伴有鳞状细胞异常(占比57.3%),其中以高级别鳞状上皮内病变(HSIL)最常见,腺细胞异常仅占37.3%。如果在宫颈活检标本中发现宫颈AIS病变,建议行诊断性宫颈锥切术,因为近40%的患者同时有浸润性病变。
2017年ASCCP指南建议:
①对细胞学提示AGC的患者,若阴道镜未见病变,建议6个月后复查细胞学或细胞学+HPV联合筛查;
②对细胞学提示非典型腺细胞,倾向于肿瘤型(AGC-FN)及AIS、反复腺细胞异常/HISL、有明显阴道排液或桶状宫颈的患者,即使阴道镜活检及ECC未发现浸润癌证据,也应建议行诊断性宫颈锥切术;
③年龄>35岁或临床症状提示有子宫内膜病变可能的患者,应考虑行子宫内膜活检。
2019年SICPCV指南建议:
①对细胞学提示AGC(包括各种亚型)及AIS的患者,除外不典型子宫内膜细胞,不论HPV结果如何,建议行阴道镜检查及宫颈管取样;
②对细胞学提示AIS,但阴道镜检查未见异常和/或ECC阴性的患者,建议在阴道镜下行诊断性切除术;
③所采用的诊断性切除术应能够提供完整的组织标本,并且切缘状态应能评价。
2020年SGO指南更新建议:
①AGC和HPV16/18阳性者应行阴道镜检查、宫颈管取样和子宫内膜活检。鉴于HPV18与宫颈AIS密切相关,无论阴道镜检查结果如何,对HPV18阳性者行宫颈管取样是可以接受的;
②宫颈活检诊断为AIS的患者,细胞学为AIS或AGC-FN,但宫颈活检和ECC阴性的患者,均建议行诊断性宫颈锥切。即使计划行子宫切除术,仍建议行诊断性宫颈锥切以排除浸润性腺癌。
2021年版子宫颈原位腺癌诊断与管理的中国专家共识建议:
疑诊为宫颈AIS而行诊断性锥切术的指征:
①子宫颈活检诊断为AIS;
②子宫颈活检取样阴性,但细胞学为AIS或者AGC-FN;
③多次细胞学检查为AGC,但活检结果阴性;
④ECC提示AGC但活检结果阴性。
三、宫颈AIS的治疗
宫颈AIS经常延伸至宫颈管内,且部分病变呈多中心性和不连续性,因此,子宫切除术一直以来是无生育要求的宫颈AIS患者治疗首选。
近年来,随着发病趋于年轻、有保留生育功能意愿患者的增多,宫颈锥切术逐渐成为有生育要求的宫颈AIS患者的替代治疗方法,其可行性和安全性已经得到高质量循证医学证据的支持和验证。
(一)宫颈锥切术
无论是否保留生育功能,宫颈锥切术是拟诊或已确诊宫颈AIS患者的首选诊断及治疗方法,包括冷刀锥切术(CKC)、环形电切术(LEEP)。
系统回顾及荟萃分析数据表明,虽然LEEP术后宫颈AIS患者的切缘阳性率为44%,显著高于冷刀锥切的29%(RR=1.55,95%CI 1.34~1.80,P<0.01),但两者术后的病变残留率(9.1% vs. 11.0%,RR=1.02,95%CI 0.60~1.72,P=0.95)与复发率(7.0% vs. 5.6%,RR=1.13,95%CI 0.46~2.79,P=0.79)比较均无显著性差异。随着手术技术的提高,有学者提出LEEP甚至可以达到与冷刀锥切相当的切缘阴性率,并且胎膜早破、早产等产科合并症的发生率更低,有生育要求的宫颈AIS患者可考虑首选LEEP。
1、行宫颈锥切术需注意以下几点:
(1)保证标本的完整性,忌顶帽式LEEP;
(2)标本深度至少为10 mm,无生育要求者18~20 mm,绝经期妇女20~25 mm;锥切标本大小与深度需综合病情及术中所见,制定个体化临床决策;
(3)推荐术中行ECC或ECB评估切缘;
(4)切缘阳性定义:切缘(+),切缘与病变的距离小于1 mm;
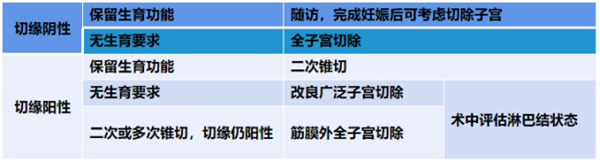
(5)初次锥切术后切缘阳性,有强烈保留生育功能意愿的患者,可进行二次锥切手术;
(6)二次或多次锥切,切缘仍为阳性时,推荐行改良广泛子宫切除术或筋膜外全子宫切除术,并依据术前影像学评估及术中探查,进行前哨淋巴结取样活检。
2、锥切切缘阳性或锥切术后宫颈管取样阳性的进一步处理
2006年版及2012年版ASCCP指南对此有相同论述。如果计划采用保守性治疗,而标本的切缘阳性,或锥切术后宫颈管取样为CIN或AIS,建议再次行切除术以增加完全切除的机会,或6个月后采用“细胞学检查+HPV检测+阴道镜检查+宫颈管取样”的联合方案进行重新评估。
2019年意大利指南指出,对于希望保留生育力的妇女,如果锥切切缘阳性,应再次锥切,不再保留追踪随访的策略。然而,根据2017年的一篇荟萃分析,治疗后高危型HPV阳性对治疗失败的预测比切缘状态更为准确。因此,“细胞学检查+HPV检测+阴道镜检查+宫颈管取样”可能会更合适。
3、锥切切缘阴性的意义
2019年意大利指南指出,切缘的阴性预测值不高,切缘阴性并不意味着AIS被完整切除。有研究发现,经过了12~120个月的追踪随访,切缘阴性者复发率为3%,切缘阳性者复发率为17%。
2017年一篇针对CIN2+、宫颈腺上皮内病变(CGIN)和宫颈AIS进行锥切治疗的荟萃分析文章,发现切缘阴性者CIN2+风险为3.7%,而高危型HPV阴性者(不管切缘状态如何)风险为1%。因此,宫颈锥切术后高危型HPV阴性比切缘阴性能更好地预测治疗的成功。
4、保守治疗的效果
对于行宫颈锥切术达到切缘阴性的保留生育功能的宫颈AIS患者,有文献及指南建议完成生育后切除子宫,但目前仍然存在争议。澳大利亚宫颈癌筛查指南明确指出,对于行保守治疗的宫颈AIS患者,如果已达切缘阴性,并不推荐行子宫全切术作为根治性的治疗方案。ASCCP及国内指南对于行保守治疗完成生育后的宫颈AIS患者也没有切除子宫的建议。
(二)子宫切除术
子宫切除术是无生育要求的宫颈AIS患者宫颈锥切术后的首选治疗方式。即使锥切切缘阴性,也不能保证病灶彻底清除,不能排除浸润性病变的可能。手术时机强调个体化选择,宫颈锥切术后4周以上,可减少手术期发热、组织水肿、感染等并发症的发生。
四、妊娠期宫颈AIS
(一)妊娠期宫颈AIS的诊断
第一次孕检时行HPV联合细胞学筛查,当细胞学检查提示AGC及以上者应转诊阴道镜,忌行ECC。阴道镜下结果轻度异常者,建议在孕后6周行HPV联合细胞学检测;阴道镜下结果异常,或阴道镜结果正常,但高危HPV感染的患者应在阴道镜下随机多点活检。
(二)妊娠期宫颈AIS的处理原则
无继续妊娠意愿者,终止妊娠后,治疗方式同非妊娠者。有继续妊娠意愿的患者,若无浸润性腺癌临床证据,应每3个月行阴道镜检查,忌行ECC;高度怀疑有浸润癌者,妊娠期间可行宫颈锥切手术,同时行宫颈环扎术,最佳时间为孕14~20周;确诊浸润性腺癌者,则应根据临床分期、肿瘤大小、继续妊娠意愿及孕周等实际情况进行个体化治疗。
五、术后随访
(一)宫颈AIS保守治疗
术后每6个月应随访细胞学联合HPV检测及影像学检查(包括盆腔超声、盆腔增强MRI等);如果发现异常,应行阴道镜下活检和ECC或ECB;如持续阴性3年,建议将随访时间调整为1年1次。
文献表明,对于保守治疗术后半年初次随访的患者,联合高危型HPV检测和细胞学检查诊断复发/持续性AIS的敏感度可达90%,1年后2次随访这一比例可达100%。宫颈锥切术后HPV阳性是疾病复发和进展的可靠预测指标。
(二)子宫切除术后
术后2年内每6个月复查1次细胞学联合HPV及影像学检查;如果发现异常,应行阴道镜下活检;若结果为阴性,建议调整为每年1次随访。随访时间建议至少持续20~25年以上。

李佩玲教授
哈尔滨医科大学附属第二医院
哈尔滨医科大学附属第二医院妇产科,主任医师,二级教授,博士生导师,“第九届中国医师奖”获得者、入选首批省级“龙江名医”、“黑龙江省卫计委专业技术高层次人才库成员”,黑龙江省妇产科领军人才梯队带头人。
中华医学会妇产科分会绝经学组委员,黑龙江省医学会妇产科分会主任委员,黑龙江省预防医学会妇女保健专业委员会主任委员,中国医师协会妇产科分会委员,中国科技创新与器官整复分会副理事长,中国医药教育协会生殖内分泌专委会副主任委员,中国妇幼保健协会妇幼微创专委会副主任委员,《中华妇产科杂志》等多部杂志编委。
参编多部国家级、省部级规范化教材及专著,科研课题获奖30余项,发表SCI 50余篇,培养博、硕士研究生130余名。第一完成人获黑龙江省科技进步二等奖、黑龙江省医药卫生科学技术一等奖等。
临床专长为妇科恶性肿瘤诊治、盆底器官脱垂、妇产科疑难重患诊治,以及妇产科急危重患抢救。
声明:本文由妇产科在线独家采编,经专家审阅后发布,如需转载请注明来源。
 妇产科在线APP下载
妇产科在线APP下载













