子宫内膜异位症(内异症)是指子宫内膜在子宫外生长的一种常见良性疾病,发病率约占育龄期女性的10%~15%,主要引起痛经、慢性盆腔痛和不孕等症状[1,2]。1925年Sampson首次报道了一例内异症疑似恶变的病例;目前已有大量的研究发现,卵巢内异症恶变可以引起某些特定组织类型的内异症相关性卵巢癌(endometriosis associated ovarian cancer,EAOC)。不同研究显示,内异症患者发生卵巢癌的几率约为0.3%~0.8%,该风险比正常人群高出2~3倍[3]。

作者:王雅卓
单位:河北省人民医院妇科
卵巢癌根据形态病理学和分子遗传学特征通常被分为I型和II型。I型多生长缓慢,诊断时多为早期,主要为低级别浆液性癌、低级别卵巢子宫内膜样癌以及卵巢透明细胞癌、卵巢黏液性癌。相比之下,II型通常一经诊断已处于临床晚期,生长迅速,侵袭性强,预后差,主要包括高级别卵巢浆液性癌、卵巢未分化癌、癌肉瘤等。在2016年的一篇研究中,Kurman和Shih又提出了一种修订和扩展的卵巢癌发生模型,进一步将I型卵巢癌分为三组:(1)内异症相关肿瘤(包括卵巢透明细胞癌、子宫内膜样癌和浆黏液性癌),(2)低级别浆液性癌,(3)黏液性癌和恶性Brenner肿瘤[4]。
卵巢子宫内膜样癌(ovarian endometrioid carcinoma,OEC)和卵巢透明细胞癌(ovarian clear cell carcinoma,OCCC)是两种最常见的EAOC,两者在组织学上与内异症关系密切,目前普遍认为其前体均是内异症[5-9]。除此之外,2014年World Health Organization(WHO)关于卵巢肿瘤分类引入了一种新的与内异症相关的实体肿瘤——卵巢浆黏液性肿瘤(ovarian seromucinous tumors),这些肿瘤在形态学上由浆液性和黏液性上皮组成,包括良性、交界性和恶性。然而,2020年WHO将卵巢浆黏液性癌从这个实体分类中删除,并将其重新归类为具有黏液分化的子宫内膜样癌。
迄今为止,已有大量研究阐述了内异症的发病机制,如经血逆行学说、体腔上皮化生理论和干细胞理论等,但良性内异症导致恶性转化的原因尚不清楚,并没有明确的机制。目前研究显示其可能存在的机制有以下几点。
1、基因突变
致癌基因KRAS和PI3K的激活以及抑癌基因ARID1A和PTEN的失活被认为是EAOC的主要发生机制。ARID1A基因作为编码SWI/SNF复合物的关键成分,在EAOC中最常发生突变。研究报道,46%~70%的OCCCs和19%~36%的OECs存在ARID1A基因突变。虽然ARID1A不是PI3K/AKT通路的直接组成部分,但ARID1A突变诱导了PI3K/AKT通路的异常激活。而PI3K/AKT/mTOR通路的激活在肿瘤的恶性转化及其生长、增殖和转移中起关键作用。另外,在40%~51%的OCCCs和27%~43%的OECs中发现了PIK3CA突变。PTEN在5%的OCCCs和29%的ECs中也发生了突变。除此之外,MAPK通路的基因,如KRAS等,也经常在OCCC和OECs中发生突变[10]。
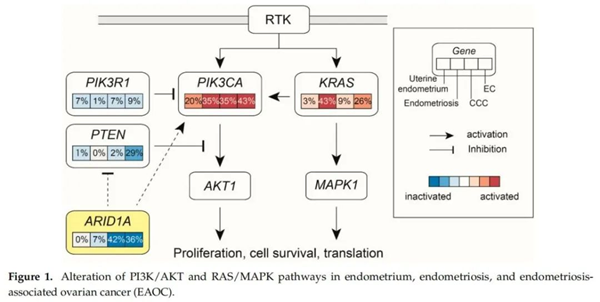
2、其他机制
内异症是一种慢性炎症性疾病,导致其发生恶变还有其他机制,例如,内异症患者本身存在较高水平的雌激素,从而引起细胞增殖,并向恶性转化;免疫微环境改变;炎症因子如基质金属蛋白酶3(MMP-3)、白细胞介素参与并促进EAOC的发生发展。此外,氧化应激很可能发生在内异症的微环境中,也是导致癌变的一个重要因素。
内异症育龄女性由于周期性月经出血和经血逆流,病变部位在出血和溶血后积累过多的铁相关物质,如血红蛋白、血红素和铁衍生物等,从而导致氧化应激,导致DNA损伤和产生活性氧。自由基氧化应激不仅会导致基因突变,还会导致表观遗传学的改变,如DNA甲基化,这也可能是EAOC发病的诱因。
1、病理诊断
从组织病理学角度来讲,Sampson和Scott先后提出了EAOC的组织学诊断标准:(1)同一卵巢中共同存在癌组织和异位子宫内膜;(2)二者组织学关系相似,有类似于子宫内膜间质的组织围绕于特征性内膜腺体,或陈旧性出血;(3)排除转移性恶性肿瘤;(4)显微镜下具有异位子宫内膜向恶性组织过渡的形态学证据[11]。
不过,由于内异症向恶性移行的形态学证据在临床病理中往往难以满足,许多关于EAOC的研究并未完全严格按照上述标准诊断,而是采取了Van Gorp分类标准。该分类标准如下,A类,卵巢癌与内异症发生在同侧卵巢,存在病理连续性;B类,卵巢癌与内异症发生在同侧卵巢,不存在病理连续性;C类,卵巢癌与内异症发生在对侧卵巢或子宫、输卵管、肠道等性腺外器官。
“卵巢浆黏液癌”这一诊断已经在2020年被WHO移除,因为认为它是一种可重复性差的诊断。Rambau等的一项研究重新检查了32例诊断为卵巢浆黏液性癌的病例,经过仔细的再次阅片,将所有32例病例重新分类为子宫内膜样癌(23例)、低级别浆液性癌(9例)和黏液性癌(1例)。目前已有多项免疫组化和分子研究表明,大多数诊断“浆黏液性癌”的病例实际上代表了子宫内膜样癌的不同形态学模式。有趣的是,最近一项关于子宫内膜样癌的大型研究中,在超过9%的病例中发现了浆黏液的成分,并进一步发现浆黏液成分的存在与较长的无进展生存期相关。但也有研究认为,晚期浆粘液性癌患者的预后普遍较差。
2、临床诊断
EAOC患者的临床症状并不典型,与内异症的临床表现类似。CA125是上皮性卵巢癌筛查和诊断的重要肿瘤标志物,然而,研究证实EAOC与非EAOC患者的CA125水平并无显著差异。也有部分研究发现,EAOC患者的血清CA125水平明显低于非EAOC患者。因此,CA125水平诊断内异症恶变缺乏特异性。
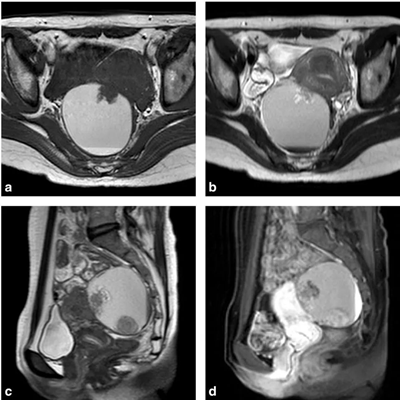
EAOC患者的诊断主要依靠影像学检查,如盆腔超声、MRI、CT等。盆腔超声常表现为卵巢囊肿内存在实性结节,血流丰富。MRI的形态学和信号特征可能有助于区分EAOC和非EAOC患者。典型的上皮性卵巢癌患者通常表现为多房的囊性实性肿块,而EAOC特别是卵巢透明细胞癌患者通常表现为单房囊性肿块,伴有壁结节。因此,如果MRI观察到附件区囊实性占位,囊肿较大,有壁结节,囊的信号不同一,以短T1、长或等T2为主,结合患者的临床特征,应该充分考虑EAOC的可能性[12]。
此外,虽然只有0.3%~0.8%的内异症患者会发生卵巢癌,但评估和系统随访可能导致患者内异症恶变的危险因素是很重要的。现有的研究表明,这些危险因素包括长期存在的内异症(病史长,超过10年)、年龄>45岁或绝经后、与不孕症相关的内异症、卵巢子宫内膜囊肿较大(直径>10 cm或短期迅速增大),以及影像学检查发现卵巢囊肿内有壁结节形成、血流丰富。
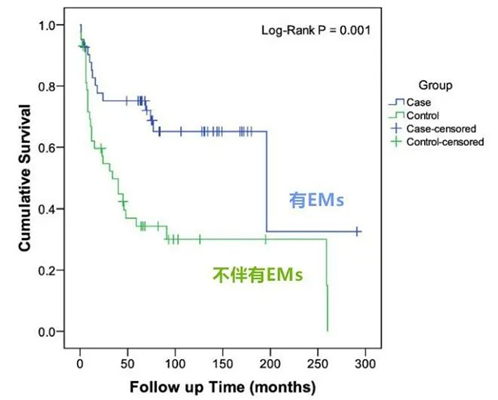
目前已有很多研究显示,EAOC患者比非EAOC患者更年轻(平均年龄45岁左右),在预后良好的患者中,有高达40%的患者表现在早期。相反,如果出现在晚期,其预后通常较非EAOC患者更差。一些回顾性研究对比了EAOC和非EAOC患者的预后结果,发现EAOC患者复发率更低(26.9% vs. 41%),5年生存率更高(75% vs. 55%)。
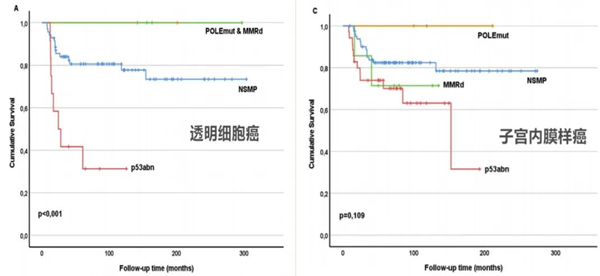
此外,近些年来在子宫内膜癌(endometrial camcer,EC)领域,2013年美国TCGA研究网络开创性地提出了EC分子分型,其将EC分为POLE超突变型(POLE ultramutated)、微卫星不稳定高突变型(microsatellite-instability high,MSI-H)、低拷贝数型(copy-number low,CNL)及高拷贝数型(copy number high,CNH)四种亚型,四种分子亚型患者的预后存在显著差异。事实上,由于OCCC和OEC与子宫内膜癌在组织学形态和分子特征上非常相似,因此,在这两种与内异症相关的卵巢癌组织中检测基于子宫内膜癌的TCGA分类模型具有相关性。
一项最新的研究共纳入了115例OCCC患者,158例OEC患者,结果显示TCGA分子分型在这两种组织类型患者中均与预后相关。在透明细胞癌患者中,POLE突变型和MMRd组的预后良好,而在子宫内膜样癌中MMRd组的预后较差,而p53异常型(p53abn)在两种肿瘤类型患者中预后均最差[13]。
EAOC患者的治疗主要遵循卵巢上皮性癌患者的治疗原则,早期患者实施全面分期手术,晚期患者实施肿瘤细胞减灭术(PDS),术后联合紫杉醇+铂类联合方案辅助化疗,PDS术后无残留病变(R0)是晚期上皮性卵巢癌患者生存的最重要预后因素,这些也同样适用于EAOC患者。然而,EAOC患者与非EAOC相比,普遍对含铂化疗反应较差。
此外,尽管早期AEOC患者的预后较好,但对于晚期的EAOC患者,其中位生存时间也明显低于高级别浆液性卵巢癌人群。在透明细胞癌患者中也观察到,IA期OCCC患者几乎不复发,但IC期患者复发率却很高。因此,对于EAOC这种特殊类型的患者,可能更需要个体化的治疗,治疗策略有待进一步研究。
从另一个角度讲,因EAOC具有早期患者预后好、晚期患者预后差的特点,对具有内异症恶变的高危患者采取更积极的处理和监测尤为重要。其处理策略包括:(1)对绝经后或大于45岁、有症状的内异症患者,因存在恶性可能性与潜在的恶性转化的风险,首选手术探查;(2)对于卵巢子宫内膜异位囊肿短期增长过快或影像学检查发现有结节等现象的患者,首选手术治疗;(3)手术应彻底切除内异症病灶以改善患者预后;(4)术后可给予激素抑制治疗,如口服孕激素和使用左炔诺孕酮宫内缓释系统来降低内异症恶变风险。这些策略的实施也将会有效降低相关卵巢癌的风险。
EAOC有着不同于其他上皮性卵巢癌的独特生物学行为、临床特征和分子特征,因此有必要对其进行前瞻性的研究,进一步探索治疗方案,建立新的治疗策略。从目前的临床实践来看,其治疗仍参照上皮性卵巢癌患者的治疗原则,但应做到相对个体化。此外,对于内异症恶变的高危人群实施管理也是必要的。分子和免疫治疗可能是未来发展的方向。
参考文献
1. Shafrir, A.L., Farland, L.V., Shah, D.K, et al. Risk for and consequences of endometriosis: A critical epidemiologic review. Best Pract. Res. Clin. Obstet. Gynaecol. 2018,51,1-15.
2. Aubry, G., Panel, P., Thiollier, G., Huchon, C., Fauconnier, A. Measuring health-related quality of life in women with endometriosis: Comparing the clinimetric properties of the Endometriosis Health Profile-5 (EHP-5) and the EuroQol-5D (EQ-5D). Hum. Reprod. 2017,32, 1258-1269.
3.Wei JJ, William J, Bulun S. Endometriosis and ovarian cancer: a review of clinical, pathologic, and molecular aspects. Int J Gynecol Pathol. 2011;30(6): 553-568.
4.Kurman RJ, Shih IM. The dualistic model of ovarian carcinogenesis: revisited,revised and expanded. Am J Pathol. 2016;186(4): 733-47.
5. Munksgaard, P.S., Blaakaer, J. The association between endometriosis and gynecological cancers and breast cancer: A review of epidemiological data. Gynecol. Oncol. 2011,123,157-163.
6. Pearce, C.L., Templeman, C., Rossing, M.A., et al. Association between endometriosis and risk of histological subtypes of ovarian cancer: A pooled analysis of case–control studies. Lancet Oncol. 2012,13,385-394.
7. Prowse, A.H., Manek, S., Varma, R., et al. Molecular genetic evidence that endometriosis is a precursor of ovarian cancer. Int. J. Cancer. 2006,119, 556-562.
8. Yamamoto, S., Tsuda, H., Takano, M., et al. PIK3CA mutation is an early event in the development of endometriosis-associated ovarian clear cell adenocarcinoma. J. Pathol. 2011,225,189-194.
9. Wiegand, K.C., Shah, S.P., Al-Agha, O.M., et al. ARID1A mutations in endometriosis-associated ovarian carcinomas. N. Engl. J. Med. 2010,363,1532-1543.
10. Yachida N, Yoshihara K, Yamaguchi M, et al. How Does Endometriosis Lead to Ovarian Cancer? The Molecular Mechanism of Endometriosis-Associated Ovarian Cancer Development. Cancers (Basel). 2021 Mar 22;13(6):1439.
11. 中华医学会妇产科学分会子宫内脱异位症协作组. 子宫内膜异位症的诊治指南[J].中华妇产科杂志, 2015.50(3):161-169.
12.Zhang X, Li M, Tang Z, Li X, Song T. Differentiation between endometriosis-associated ovarian cancers and non- endometriosis-associated ovarian cancers based on magnetic resonance imaging. Br J Radiol. 2021 Sep 1;94(1125):20201441. doi: 10.1259/bjr.20201441. Epub 2021 Apr 29.
13. Similä-Maarala J, Soovares P, Pasanen A,, et al. TCGA molecular classification in endometriosis-associated ovarian carcinomas: Novel data on clear cell carcinoma. Gynecol Oncol. 2022 Mar 31:S0090-8258(22)00198-6.

博士,主治医师,河北省人民医院妇科工作。
社会职务:河北省妇幼保健协会妇女健康管理专业委员会委员、河北省疼痛医学会妇科专业委员会委员、河北省优生优育协会阴道镜和宫颈病理学专业委员会委员。
专业特长:熟练掌握妇科常见病及多发病的诊治,擅长宫颈病变诊治和妇科良恶性肿瘤的治疗,主要从事妇科恶性肿瘤的基础与临床研究。
科研成果及获奖情况:参与省级科研课题3项,发表论文及著作十余篇;获得“思辨卓行”辩论赛全国二等奖、河北医科大学英文授课竞赛二等奖、河北省人民医院科普大赛二等奖、河北省人民医院授课竞赛二等奖。
声明:本文为作者原创投稿并授权发布,文章仅代表作者观点,不代表本平台立场。如需转载请留言获取授权,未经授权谢绝转载。
 妇产科在线APP下载
妇产科在线APP下载













