作者:李晶,吴妙芳,林仲秋
作者单位:中山大学孙逸仙纪念医院妇科肿瘤专科,广东 广州 510120
通讯作者:林仲秋,电子信箱:lin-zhongqiu@163.com
1 概述
卵巢恶性肿瘤可以发生于任何年龄。20岁以下女性中生殖细胞肿瘤最常见。交界性肿瘤常好发于30余岁到40余岁的女性,发病年龄较上皮性浸润癌患者早10岁以上。卵巢上皮性癌绝大多数发生于50岁以后。
卵巢上皮性肿瘤总发病率波动于(9~17)/10万,在高收入国家中发病率最高。发病率随年龄增加而成比例升高,多数卵巢癌发生在60~64岁的群体中。在低收入国家中,患者的中位年龄要小10岁。
卵巢上皮性癌较确定的致病危险因素为生育因素。未生育女性罹患卵巢上皮性癌的风险是已生育女性的2倍。生育年龄早、早绝经和使用口服避孕药可降低发生卵 巢癌的风险,但这些因素与输卵管癌之间的关系尚不明确。
以往认为输卵管癌罕见,但已有证据提示,不少高级别浆液性卵巢癌和腹膜癌源于输卵管伞端。输卵管受累可分为3种类型:第1种可见明显的输卵管管腔内肿物,肉眼可见输卵管包块,包括输卵管上皮内癌(原位癌),可能起源于输卵管;第2种是与输卵管上皮内癌相关的广泛播 散性浆液性癌,可能不存在肉眼可见的输卵管内膜肿物;第3种为预防性输卵管卵巢切除时发现的输卵管上皮内癌,这种情况应诊断为原发性输卵管癌,并对患者进行相 应的处理 。无论遗传风险高低,可发现多数早期浆液性癌存在于输卵管。
2 组织学分类
大多数卵巢癌为上皮来源。国际妇产科联盟(FIGO)采用世界卫生组织(WHO)卵巢上皮性癌组织学分类方法。分为:(1)浆液性肿瘤。(2)黏液性肿瘤。(3)内膜样肿瘤。(4)透明细胞肿瘤。(5)伯纳勒肿瘤。(6)未分化癌(属于恶性上皮结构肿瘤,但它们分化极差,无法分入任何一组)。(7)混合型上皮性肿瘤(肿瘤由5种常见上皮性肿瘤中的2种或以上组成,具体种类通常会明确说明)。(8)腹膜癌或原发部位不明确的浆液性癌:病理为高级别浆液性癌,外观上卵巢和输卵管被附带累及且它们并非原发部位。
浆液性癌是最常见的类型。90%以上输卵管癌是浆液性癌或高级别子宫内膜样腺癌。根据生物学行为采用2级分类将浆液性癌分为两类:高级别浆液性癌,包括具有典型外观和实性、内膜样和移行性(solid,endometrioid-like,and transitional,SET)特点的肿瘤,常有TP53基因突变。低级别浆液性癌常伴有交界性或不典型增生性浆液性肿瘤, 常具有BRAF和KRAS突变、TP53野生型。多数分化中等的浆液性癌也存在TP53突变,因此常将中分化和低分化的肿瘤一起归为“高级别”病变。非上皮性恶性肿瘤不常见,包括颗粒细胞瘤、生殖细胞瘤、肉瘤和淋巴瘤。卵巢转移性肿瘤,如起源于下生殖道(子宫颈或子宫体癌)和胃肠道 (印戒细胞癌、阑尾或胰胆管黏液性肿瘤和其他肿瘤),按照原发肿瘤的分期和分级方式进行分期、分级。
3 遗传学
约20%卵巢癌、输卵管癌和腹膜癌与遗传因素有关:(1)多数遗传性卵巢癌是 BRCA1或BRCA2发生有害突变导致的。在非黏液性高级别卵巢癌患者中,至少15%存在胚系BRCA1/2突变,这些患者中40%没有乳腺癌/卵巢癌家族史。推荐所有非黏液性高级别卵巢癌患者都应接受基因检测,即便她们没有乳腺癌/卵巢癌家族史。(2)BRCA1和BRCA2遗传性有害突变是最主要的遗传风险因素。BRCA1突变携带者癌变的发生率为20%~50%,而BRCA2突变携带者癌变发生率为10%~20%。与散发性肿瘤患者相比,这些患者发病年龄偏早,尤其是BRCA1突变携带者,诊断卵巢癌时中位年龄为45岁。(3)其他多种低度外显率和中度外显率的基因也会增加卵巢癌、输卵管癌和腹膜癌的发病风险。(4)与Ⅱ型Lynch综合征相关的错配修复基因遗传性突变。携带这些突变的女性发生结肠癌、子宫内膜 癌和卵巢癌等多种肿瘤的风险增加。若发生卵巢癌,病理 类型通常为子宫内膜样癌或透明细胞癌,常为Ⅰ期。
对于有明显卵巢上皮性癌、输卵管癌、腹膜癌家族史的女性,尤其是已确定有BRCA基因突变的女性,建议进行充分的遗传咨询,在完成生育后行降低卵巢癌风险的预防性双附件切除术。对于有家族史、年轻和发生高级别浆液性癌或高级别内膜样癌的患者,可疑携带BRCA基因胚系突变时,均建议其进行基因检测。无乳腺癌/卵巢癌家族史的女性也可存在BRCA突变。对于来自founder突变高发家族(如德系犹太人)的女性和70岁前即被诊断为高级别浆液性癌的女性,也应考虑进行基因检测。澳大利亚指南建议,所有年龄<70岁的非黏液性卵巢上皮性癌患者,无论有无家族史和肿瘤亚型,均应接受BRCA基因检测 。美国妇科肿瘤学会(SGO)和美国国立综合癌症网络(NCCN) 指南推荐,所有卵巢癌、输卵管癌和腹膜癌患者,无论年龄、家族史,都应接受遗传咨询和基因检测。对于家族史提示有Ⅱ型Lynch综合征的患者,都应接受必要的遗传咨询和监测。
4 筛查
迄今为止,尚无行之有效的筛查方法可降低卵巢癌、输卵管癌和腹膜癌的致死率。在一般人群和高危人群中 开展的临床研究均发现,CA125、盆腔超声和盆腔检查的敏感度和特异度不高,不推荐对无症状女性用这些方法进行卵巢癌筛查。因为卵巢癌的低发病率和缺少高质量的筛查方法,很容易产生假阳性结果,导致不必要的干预。
对于有发生卵巢癌和输卵管癌高风险的女性,预防性输卵管-卵巢切除术仍然是标准的预防卵巢癌方式。应鼓励遗传风险高的女性考虑接受降低风险的双侧输卵管切除术,这是降低这一人群病死率的最有效方法。美国妇产科医师学会(ACOG)一项公告中提出,对于没有遗传风险的女性,在因其他指征行子宫切除术保留卵巢时,切除双侧输卵管可降低其日后发生高级别浆液性癌的风险。
5 诊断
低级别浆液性卵巢癌或透明细胞癌或子宫内膜样腺癌患者就诊时常处于早期,高级别浆液性卵巢癌患者可发生早期播散,就诊时多已处于Ⅲ期。对于有盆腔包块或卵巢体积增大的年轻女性,应检测人绒毛膜促性腺激素(human gonadotropin,hCG) 和甲胎蛋白 (alpha-fetoprotein,AFP)等肿瘤标志物,以排除生殖细胞肿瘤。
卵巢癌患者无特征性表现,症状包括腹部隐痛或腹部不适、月经紊乱、消化不良以及其他轻微消化功能异常,这些症状可能仅出现数周。疾病进展时,出现腹胀或因腹水量增加而感到不适。腹腔内压力增加或液体渗入胸腔内, 患者可伴有呼吸系统症状。异常阴道流血并不常见。输卵管癌和腹膜癌的临床表现与卵巢癌相似。
应详细采集病史以确定患者有无危险因素、其他肿瘤病史以及肿瘤家族史。应进行全面的体格检查,包括全身体检、乳腺、盆腔及直肠检查。术前应行胸部影像学检查以排除胸腔积液,应行盆腹腔CT显示腹腔内病变的扩散范围。对于没有盆腹腔外病灶的患者,影像学检查不能替代开腹探查和手术分期。应检测肿瘤标志物,如CA125和癌胚抗原(carcinoembryonic antigen,CEA)。CA125高水平时,最常见的诊断可能是卵巢上皮性癌、输卵管癌或腹膜癌。原发性胃癌或结肠癌转移至卵巢时具有类似卵巢癌的表现,CEA 或CA19-9升高。如果CA125和CEA 的比值高于25∶1则支持卵巢癌原发。在乳腺癌高发年龄组,应该考虑行乳腺X线扫描。如果症状提示肠道肿瘤,可考虑行结肠镜检查。
临床上鉴别盆腔包块性质时,以下特点常提示恶性:(1)患者年龄(年轻女性以生殖细胞肿瘤常见,年老女性以上皮性恶性肿瘤多见)。(2)肿物为双侧性。(3)肿物固定。(4)腹水。(5)超声提示混合性包块,特别是有实性部分。(6)CT发现淋巴结转移。(7)肿瘤标志物升高。
6 分期
卵巢癌、输卵管癌和腹膜癌采用2014 FIGO分期系统, 见表1。

7 初治手术
影响卵巢上皮性癌、输卵管癌以及腹膜癌患者预后的独立因素包括:(1)诊断时肿瘤的期别。(2)肿瘤组织学类 型和分化程度。(3)肿瘤细胞减灭术后残留病灶最大直径 。
7.1 全面分期手术 全面分期手术是早期卵巢癌治疗的重要组成部分。如果术前怀疑肿瘤为恶性,应选择开腹手术。如果没有可见或可触及的转移证据,应进行以下步骤:(1)仔细检查所有腹膜面。局限于卵巢者,仔细检查包膜是否有破裂。(2)收集胸腔积液或腹水,若无腹水则取腹 腔冲洗液送细胞学检查。(3)横结肠下大网膜切除。(4)选择性盆腔和主动脉旁淋巴结切除术,单侧肿瘤至少切除同侧盆腔淋巴结。(5)活检或切除所有可疑病灶、肿物或粘连。(6)正常腹膜表面随机活检,活检部位包括:右侧横膈下侧面、膀胱腹膜反折、直肠子宫陷凹、双侧结肠旁沟和双侧骨盆侧壁。(7)大多数患者切除全子宫及双侧附件,所有肉眼可见肿瘤都应尽可能切除。(8)黏液性肿瘤阑尾外观 异常者切除阑尾。
选择手术途径非常重要。如果肿物高度怀疑为恶性,适合开腹手术。对于任何可疑病变都应进行活检,冰冻切片检查有助于及时确定手术方式 。如果肿物可能为良性,肿瘤标志物正常,选择腹腔镜手术更为合适。
年轻早期患者可考虑保留生育功能,在充分知情同意后行保守性手术,保留子宫和对侧卵巢。
7.2 晚期患者的肿瘤细胞减灭术
7.2.1 初次肿瘤细胞减灭术 晚期肿瘤影响患者的体力状态和接受手术的可能性。如果病情允许,都应先行手术治疗,包括切除全子宫、双侧输卵管及卵巢、大网膜,并尽最大努力实现满意减灭术 。术中可能需要切除肠管,有时还可能要完全或部分切除其他器官。根据近期LION试验结果,减灭术达R0患者切除临床阴性淋巴结并不增加患者的无进展生存期或总生存期(证据等级A )。
7.2.2 间歇性肿瘤细胞减灭术 EROTC和CHORUS两项前瞻性随机研究提示,新辅助化疗后行间歇性肿瘤细胞减灭术与初治肿瘤细胞减灭术相比,患者的预后相仿但并发症的发生率更低。对于体力状态差 、合并严重内科并发症、内脏转移和存在大量胸腔积液或腹水的患者,新辅助化疗联合间歇性肿瘤细胞减灭术尤其有用。对初次不满意肿瘤细胞减灭术,特别是初次手术不是由妇科肿瘤专科医生完成者,也可考虑在化疗2~3个疗程后再行间歇性肿瘤细胞减灭术。对新辅助化疗后残留肿瘤行病理学检查有助于评价残留肿瘤范围和肿瘤对化疗的反应。近期有数据提示病理学反应好的患者预后较好,化疗反应评分(chemotherapy response scores,CRS)分级为3分的患者(完全或接近完全病理学缓解)预后更好。
8 化疗
8.1 早期卵巢癌患者的化疗 经全面手术分期确定的ⅠA和ⅠB期G1~2级卵巢上皮性癌患者预后很好,辅助化疗并无益处,因此没有必要化疗。ⅠA期和ⅠB期的G3级患者,化疗是否可改善生存期尚有争议 。高级别浆液性癌、透明细胞癌和癌肉瘤的患者和ⅠC期患者,多数会接受以铂类药物为基础的辅助化疗。Ⅰ期患者接受化疗的最佳疗程数尚不确定,但通常为3~6个疗程 。妇科肿瘤组(Gynecologic Oncology Group,GOG)157研究发现,3个疗程卡铂+紫杉醇化疗的效果与6个疗程相同,但分层分析发现,对于高级别浆液性癌患者,6个疗程效果可能更佳。所有Ⅱ期患者都应接受辅助化疗6个疗程 。尚无证据支持对输卵管原位癌进行辅助治疗,故不推荐术后辅助化疗(证据等级A ) 。
8.2 晚期卵巢癌患者的化疗 接受初治肿瘤细胞减灭术的晚期患者,术后应接受化疗(表2)。标准化疗方案为6个疗程以铂类为基础的联合化疗,包括铂(卡铂或顺铂)和紫杉类(紫杉醇或多烯紫杉醇)。对紫杉醇过敏或用药后早期即出现神经毒性者可改用多烯紫杉醇,其神经毒性反应较少,但骨髓毒性较重。MITO-2试验显示,卡铂+脂质体多柔比星(PLD)或卡铂+紫杉醇两个方案缓解率相似,但毒性反应不同,卡铂+PLD方案的神经毒性和脱发较轻而血液学毒性更常见,可作为无法使用紫杉醇者的替代方案。

贝伐单抗7.5~15mg/kg、3周疗,可加入上述方案。GOG218和ICON7报告:使用贝伐单抗的患者其无进展生存期可获得具有统计学意义的轻度延长,但总生存期未得到改善。贝伐单抗的作用、最佳剂量(7.5mg/kg vs. 15mg/kg)、时机(原发 vs. 复发)和维持治疗时限仍有争议。
GOG172显示,在术后残留病灶直径<1cm的Ⅲ期卵巢癌和腹膜癌患者中,腹腔化疗可改善患者的无进展生存期和总生存期。但是,由于腹腔化疗的毒性反应和导管相关并发症,这一方法在美国以外的国家并未得到广泛应用 (证据等级A)。
尽管GOG252研究对腹腔化疗的作用提出了质疑,该研究结果显示,当静脉化疗联合贝伐单抗时,腹腔化疗并不改善患者预后。但卡铂和紫杉醇静脉TC方案和GOG172方案仍然是晚期患者的标准治疗方案,应将静脉和腹腔化疗这两种方式的利弊与患者进行充分沟通。腹腔化疗只适用于满意肿瘤细胞减灭术后残留病灶直径<1cm的晚期患者。只有拥有腹腔化疗经验的医疗中心才可实施腹腔化疗。使用卡铂(AUC 5~6)替代顺铂进行腹腔化疗因缺少证据而受到质疑。JGOG正在进行卡铂腹腔化疗的研究,结果将在近期公布。
有研究报道,Ⅲ期卵巢上皮性癌患者进行3个疗程新辅助化疗后接受了间歇性肿瘤细胞减灭术,之后再接受腹腔热灌注化疗(HIPEC),HIPEC可延长无复发生存时间(14.2个月 vs. 10.7个月)和总生存时间(45.7个月 vs. 33.9个月),且不增加不良反应的发生率。这一结果在使人振奋的同时,也引起了争论。证实HIPEC作用的验证性试验目前正在进行中。
因内科并发症、虚弱或高龄而不能耐受联合化疗的患者,可以卡铂静脉单药(AUC 5~6)。需要注意的是,该研究是一个小型试验,其结果还需要验证。
8.3 新辅助化疗 越来越多晚期卵巢癌患者接受3~4个疗程新辅助化疗(NACT)后行间歇性肿瘤细胞减灭术。这一做法基于4项研究(EORTC-NCIC、CHORUS、JGOG0602、SCORPION),这些研究均报道,接受新辅助化疗(NACT)的患者其无进展生存期和总生存期与接受初治肿瘤细胞减灭术(PDS)的患者相仿,但并发症发生率和病死率更低。然而,NACT的作用仍有待商榷。对于部分预后不良的患者,NACT似乎是可取的。NACT适用于疾病状态不适合接受PDS,或发生手术并发症和病死率风险高的患者,包括肝脏和肺实质转移的患者。行为状态好和预后良好的患者应接受PDS。
9 PARP 抑制剂维持治疗
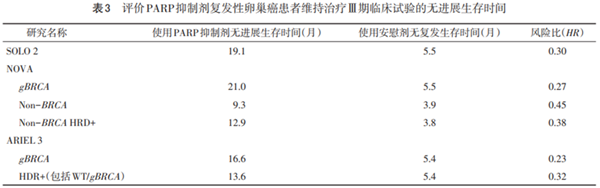
越来越多的证据支持,初始治疗和铂敏感复发治疗缓解后的患者使用PARP抑制剂维持治疗。SOLO1、PRIMA、PAOLA-1、VELIA均显示PARP抑制剂在一线维持治疗中的作用。已有高级别证据支持铂敏感复发性卵巢癌患者化疗缓解后可使用PARP抑制剂作为维持治疗,以及部分复发患者将PARP抑制剂用于治疗。携带 BRCA突变(体系和胚系)患者获益最大。一部分同源重组修复缺陷(HRD)患者也可从PARP抑制剂治疗中获益。目前的挑战是寻找甄别出这些患者的最佳方式。表3总结了复发性卵巢癌患者使用PARP抑制剂维持治疗的试验结果。
10 免疫检查点抑制剂
在一线治疗以及维持治疗中,免疫检查点抑制剂与化疗联合±PARP抑制剂或抗血管生成药物可能有潜在的作用。不幸的是,第一个报道结果的临床试验——JAVELIN100得出了阴性结论。需继续研究免疫检查点抑制剂在卵巢癌患者一线治疗中的作用,或者如何确定最有可能从中受益的患者亚群。
11 随访
尚无证据显示,密切随访及对无症状复发患者提前开始化疗可改善总生存率或生存质量。随访的目的包括:(1)早期发现并及时处理治疗相关并发症,包括进行心理支持治疗。(2)早期发现复发症状和体征。(3)在临床研究中收集任何与疗效相关的数据和与治疗相关并发症的数据。(4)促进健康生活方式,包括在早期患者中进行乳腺癌筛查、在接受保守性手术治疗的患者中进行子宫颈癌筛查。
目前缺乏依据循证医学证据的指南来指导随访。通常在治疗结束后1年内,患者可每3个月随访1次,然后可 逐渐延长随访间隔,2年后可每4~6个月随访1次,5年后可每年随访1次。每次随访时,都应再次记录患者的病史,包括任何家族肿瘤史的变化和所有提示复发的症状,并完成体格检查和盆腔检查。如果患者在诊断或因接受治疗期 间未进行基因检测,此时可完成检测 。定期检测CA125已成为常规 。复发患者的治疗时机取决于症状、临床发现和影像学表现。当临床或肿瘤标志物提示复发时,则需要做影像学检查,如盆腔超声、CT、MRI和(或)PET。
随访中发现患者仅有CA125升高但无症状、病灶较小或影像学未发现复发灶,推迟化疗是合适的;也可选择进入合适的临床试验或进入评价他莫昔芬的临床研究。
一项荟萃分析显示,复发性卵巢癌患者非选择性使用他莫昔芬后客观缓解率为10%、疾病稳定率为32%,研究包括了无症状但CA125水平上升和有症状但化疗耐药的患者,后者既往曾接受多线治疗且一般状态差。GOG198在一线化疗后复发的Ⅲ期或Ⅳ期卵巢上皮性癌、输卵管癌或腹膜癌患者中,比较了他莫昔芬和沙利度胺的疗效,接受沙利度胺的患者肿瘤进展风险增加31%(HR 1.31)。 沙利度胺组的中位无进展生存期为3.2个月,而他莫西芬组为4.5个月。这一结果提示他莫昔芬可能在部分CA125上升的患者中发挥作用,雌激素受体阳性与他莫昔芬获益之间 的关系正在评估中。Ⅱ期研究PARAGON试验在54例CA125水平升高且无症状患者中评估阿那曲唑的作用,3个月临床获益率为34.6%,临床获益的中位时间持续为6.5个月。多数患者在使用阿那曲唑6个月内出现进展,但12例患者(22%)持续治疗超过6个月。
12 复发的治疗
12.1 二次探查术 不再推荐患者在完成一线化疗后没有存在肿瘤的临床证据时行二次探查术(或腹腔镜检查)(证据等级C)。
12.2 二次肿瘤细胞减灭术 二次肿瘤细胞减灭术是指在完成一线化疗后的某些阶段进行的肿瘤细胞减灭术。回顾性研究显示,如果二次肿瘤细胞减灭术可切除所有肉眼可见病灶,患者可从中获益 。虽然DESKTOPⅢ和GOG213两项前瞻性试验结论不同,但对于慎重选择的患者,二次肿瘤细胞减灭术可作为一种安全的选择(证据等级B)。
12.3 复发化疗 晚期卵巢上皮性癌、输卵管癌和腹膜癌多数会复发,复发中位时间为16个月。在用来预测后续化疗敏感度和患者预后的指标中,最常用的是无进展生存间期或“无铂间期”,即初治含铂化疗停止时间到疾病复发或进展之间的时间间隔,这个定义有局限性。另一个定义是 “无治疗间期”:无治疗间期<6个月属铂耐药,复发时通常 使用无铂方案进行治疗;无治疗间期>6个月属铂敏感,复发时通常使用含铂方案进行治疗。治疗期间肿瘤进展和化疗停药4周内出现进展者属铂抵抗。第四届卵巢癌共识大会达成一致,应按照末次含铂方案化疗的时间到发现进展的时间来对患者进行分类。
ICON4发现,对于铂敏感复发患者,与单用卡铂相比,卡铂联合紫杉醇可改善患者的总生存率和无复发生存率(证据等级A)。
对于出现神经毒性的患者,可使用吉西他滨或脂质体多柔比星代替紫杉醇。CALYPSO研究显示,对于卡铂/多柔比星(CD方案)和卡铂/紫杉醇(CP方案),CD组的无进展生存时间为11.3个月,而CP组为9.4个月,差异有统计学意义;但两组患者的总生存时间差异无统计学意义,CD组患者的耐受性更好,严重毒性反应的发生率更低 。目前,这一方案得到了广泛应用(证据等级A)。
OCEAN研究显示,对于铂敏感复发患者,与卡铂+吉西他滨相比,卡铂+吉西他滨+贝伐单抗可改善无复发生存时间。该结果支持临床实践中使用试验组所用方案。
铂耐药患者可考虑参加临床试验或使用无铂方案进行化疗,可选择脂质体多柔比星、拓扑替康、依托泊苷和吉西他滨,但缓解率有限,约10%;中位进展时间为 3~4个月、中位生存时间为9~ 12个月 。已有多项针对铂耐药复发性卵巢癌患者开展的新药临床研究,包括埃博霉素、曲贝替定和培美曲塞,但肿瘤缓解率或无进展生存期均无明显增加。新药物或新组合研究正在进行中。抗血管生成药物 在铂耐药复发性卵巢癌的治疗中有一定作用。AURELIA 研究中,在拓扑替康周疗、紫杉醇周疗或脂质体多柔比星4 周疗等标准治疗方案的基础上联合贝伐单抗能获得更长的 PFS 和更高的缓解率。
12.4 免疫检查点抑制剂在复发性卵巢癌中的应用 免疫检查点抑制剂在复发性卵巢癌患者(包括铂耐药患者)中的研究结果都令人失望—— 肿瘤缓解率很低。KEYNOTE-100、抗PD-L1抗体阿韦鲁单抗(avelumab)、TOPACIO试验、伊匹单抗(ipilimumab)联合纳武单抗(nivolumab)、Leap-005(pembrolizumab联合仑伐替尼)等结果显示仅有一小部分患者受益,挑战在于如何甄选出这些获益患者。
12.5 PARP 抑制剂治疗复发性卵巢癌 美国食品和药品监督管理局(FDA )已批准奥拉帕利可用于有BRCA胚系突 变且既往已接受≥3线化疗的复发性卵巢癌患者的治疗。奥拉帕利对铂耐药复发的缓解率为34%、中位无复发生存时间为7.9个月。卢卡帕尼也被批准用于治疗具有BRCA突变且完成≥2线化疗的铂敏感或铂耐药晚期卵巢癌患者,研究者评价的客观缓解率为54%、中位缓解持续时间为9.2个月。
除极个别患者外,复发性卵巢癌是无法治愈的,治疗的目标是维持生存质量和缓解症状,做好症状控制和良好的姑息治疗是疾病管理中的重要组成部分。这对铂耐药 卵巢癌患者尤为重要。有多种潜在方案可供选择,包括化疗、抗血管生成药物、放疗、对部分患者行手术治疗以及加入临床试验。
13 低级别卵巢上皮性癌的处理
低级别浆液性卵巢癌(LGSOC)占卵巢浆液性腺癌的5~10%,在卵巢癌中占 8%。与高级别浆液性腺癌患者相比,低级别浆液性癌患者诊断时较年轻,诊断时的中位年龄为47~54岁,肿瘤生长缓慢,对化疗不敏感,没有TP53基因突变,但有KRAS或BRAF突变以及Ras-Raf-MEK-ERK通路激活。
多数LGSOC患者诊断时处于晚期,手术的目标是完全切除肿瘤。肿瘤局限于卵巢的年轻患者可接受保留生育功能的手术。晚期LGSOC患者含铂方案新辅助化疗的影像学缓解率为 4%,显著低于高级别浆液性卵巢癌(HGSOC)的80%。有研究报道,复发性LGSC患者的化疗缓解率仅有3.7%(铂敏感患者的缓解率为4.9%,铂耐药患者的缓解率为2.1%)。在一项回顾性探索性病例对照研究中,37例LGSOC患者接受了不满意肿瘤细胞减灭术和疗效评估,肿瘤缓解率为23.1%,高于其他研究。
已有研究报道,复发性和转移性低级别浆液性腺癌患者接受激素治疗可获得临床益处。一项回顾性研究报道激素治疗后的肿瘤缓解率为9%,减灭术后接受辅助激素治疗者中位无进展生存期为22个月、复发率为14.8%,接受手术后化疗和激素治疗的患者生存率差异无统计学意义。另一回顾性研究中,患者在接受初治肿瘤细胞减灭术和含铂方案化疗后接受激素维持/辅助治疗或观察,结果显示,接受激素维持治疗的患者中位无进展生存期明显延长(64.9个月 vs. 26.4个月),但总生存期未见改善(115.7个月vs. 102.7个月)。近期,NRG肿瘤学组开展了一项大规模临床研究,评估维持/辅助激素治疗在低级别浆液性腺癌患者中的作用。
低级别浆液性腺癌通常具有MAP激酶通路突变,尤其是 BRAF、KRAS 和 NRAS。因此,多项研究探索了使用MEK 抑制剂(MEKi)靶向治疗的效果。GOG0239 试验中,52 例复发性低级别浆液性腺癌患者接受 MEKi 司美替尼(selumetinib)进行治疗,总缓解为15%,其中1例完全缓解、7 例部分缓解、65%患者肿瘤稳定,中位无进展生存期为11.0个月。MILO试验显示,MEK162(比美替尼)与化疗疗效相近。MEK 抑制剂曲美替尼与化疗的随机试验(NRG⁃GOG0281)报告与标准化疗相比,使用曲美替尼可将复发性低级别浆液性腺癌的客观缓解率提高至26.2%,而化疗为6.2%。化疗和曲美替尼组的中位无进展生存期分别为7.2个月和13个月,曲美替尼虽然可改善总生存期,但无统计学意义。
对于无证据显示有肿瘤的低级别浆液性腺癌患者,可采用与恶性上皮性癌患者相同的随访方式,但可以降低随访频率(证据等级A)。
14 低度恶性潜能上皮肿瘤(交界性肿瘤)的处理
交界性肿瘤占卵巢上皮性肿瘤的15%。患者发病时较年轻,75%在诊断时处于Ⅰ期。该肿瘤有如下特点:(1)诊断以原发肿瘤的病理为准。(2)需多切片以排除浸润性肿瘤。(3)预后很好,10年生存率约为95%。(4)从交界性肿瘤发展为浸润性肿瘤的过程隐匿,对以铂类为基础的化疗反应欠佳,化疗的价值有争议。(5)腹膜种植可自行消退。(6)早期、浆液性和年轻患者预后更好。(7)初次手术后残留肉眼可见病灶者预后较差,但病死率仍较低。(8)有大网膜或其他远处部位浸润性种植者容易早期复发。
导致死亡的原因主要为肿瘤并发症(如肠梗阻)或治疗并发症,极少数患者死于肿瘤本身。治疗的主要手段是初治分期手术和肿瘤细胞减灭术。所有期别交界性肿瘤患者均应接受手术治疗。对于Ⅰ期且希望保留生育功能的患者,术中排除对侧卵巢受累后可行保守性手术,切除单侧输卵管卵巢。对于仅有一侧卵巢、或肿物为双侧性的患者,可考虑行部分卵巢切除或肿物剔除,以保留生育功能。对于其他患者,建议进行全子宫和双侧附件切除术。如果肿瘤有转移,则应行最大限度的肿瘤细胞减灭术。手术后少数有浸润性种植的患者对化疗有反应,但缓解率低。少部分患者可短期内复发并含有高级别浸润性癌,这些患者可从化疗中获益。晚期复发患者应考虑行二次减瘤术,发现浸润性病变者术后给予化疗。
交界性肿瘤的随访与上皮性癌相仿,随访间隔可适当延长。保留卵巢者至少每年进行1次阴道超声检查(证据等级C)。
15 卵巢颗粒细胞瘤的处理
卵巢颗粒细胞瘤占性索间质肿瘤的70%,占卵巢肿瘤的3%~5%。分为幼年型和成年型两种类型。由于肿瘤可分泌大量雌激素,幼年型患者的典型临床表现为性早熟,成年型患者则多表现为绝经后阴道流血。多数患者初诊时为Ⅰ期,好发年龄为绝经后的前10年内。
颗粒细胞瘤通常进展缓慢,倾向于晚期复发。诊断时的期别是最重要的预后因素。其他影响预后的因素包括患者的年龄、肿瘤大小和组织类型。发生转移时,减瘤术是主要的治疗方法。若患者年轻、病变局限于一侧卵巢,可考虑保留生育功能。
由于发病率低、进展缓慢,目前缺少相关的前瞻性研究。对于Ⅰ期患者,没有证据显示辅助化疗或放疗可改善手术患者的预后。对于更高危的Ⅰ期患者(肿瘤直径>10cm、包膜破裂、核分裂象常见)术后辅助化疗的疗效仍不明确。针对晚期或复发患者常使用以铂类为基础的化疗,总缓解率为63%~80%。
博来霉素/依托泊苷/顺铂(BEP)已被广泛用于转移性颗粒细胞瘤的治疗。但40岁以上的患者使用博来霉素的毒性明显增加,而且在GOG早期开展的临床研究中,不少 患者死亡与博来霉素有关。为了减少毒性,研究者将博来霉素的剂量减少至20U/m2、每3周静脉注射1次共4次。卡铂+紫杉醇似乎与BEP有相似的缓解率而毒性更低。最佳的化疗方案仍未确定。GOG-0264(NCT01042522)正在进行复发和转移性颗粒细胞瘤患者接受BEP或卡铂+紫杉醇化疗的随机对照试验。
有研究报道,贝伐单抗单药在36例具有可测量病灶的颗粒细胞瘤患者中缓解率为16%。ALIENOR/ENGOT-ov7在60例复发性颗粒细胞瘤患者中比较了紫杉醇周疗和紫杉醇周疗联合贝伐单抗的疗效。加入贝伐单抗后,总缓解率升高(紫杉醇周疗25%,联合使用44%),但主要研究终点个月无进展生存率差异无统计学意义。
激素也被广泛用于复发性颗粒细胞瘤的治疗。一项针对激素治疗的综述中共包括31例患者,总缓解率为71%。一项单中心回顾性研究纳入了15例接受来曲唑治疗的患者,部分缓解率为41%,中位无进展生存期超过20个月。一项纳入22例具有可测量病灶患者的回顾性研究,报道了使用芳香化酶抑制剂后肿瘤缓解率为18%、肿瘤稳定率为64%。PARAGON是惟一的前瞻性试验,结果显示,阿那曲唑用药后的部分缓解率为10.5%,相当一部分患者肿瘤稳定。目前还不明确肿瘤稳定的原因是激素治疗的效果还是因为颗粒细胞瘤本身进展缓慢的结果。
卵巢颗粒细胞瘤的随访方法主要为临床随访,对于治疗前即有血清抑制素B 和(或)抗米勒管激素(AMH)升高的患者,这两种标志物可以早期发现残留和复发病灶。
尚无证据提示抑制素B和AMH哪个更佳。对于绝经后女性,血清抑制素是有价值的肿瘤标志物(证据等级C)。
16 恶性生殖细胞肿瘤的处理
恶性生殖细胞肿瘤在卵巢肿瘤中所占比例较低,以前预后极差。含铂化疗方案的使用使恶性生殖细胞肿瘤成为了治愈率最高的肿瘤。
16.1 临床表现 恶性生殖细胞肿瘤常见于10~30岁的女性。患者常因腹痛就诊,就诊时触及腹部包块而得到诊断。症状按发生率高低排序如下:(1)急性腹痛。(2)慢性腹痛。(3)无症状性腹部包块。(4)异常阴道流血。(5)腹胀。
16.2 病理学分类 病理类型是决定患者预后和化疗方案的重要因素,分类如下:(1)无性细胞瘤。(2)胚胎癌。(3)多胚瘤。(4)畸胎瘤[未成熟型;成熟型;成熟型伴癌变(鳞状细胞、类癌、神经外胚窦瘤、恶性间质细胞瘤等)]。(5)胚外分化型肿瘤[绒癌;内胚窦瘤(卵黄囊瘤)]。
16.3 诊断、分期和手术治疗 卵巢生殖细胞肿瘤与卵巢 上皮性肿瘤使用相似的分期方式,但男性生殖细胞肿瘤的 分期方法可能更有用,按照睾丸转移性生殖细胞肿瘤(低危、中危、高危)采用不同的治疗方案 。无性细胞瘤等同于睾丸精原细胞瘤,对以铂类为基础的化疗和放疗均极为敏感,治愈率与肿瘤分期无关 。其余类型生殖细胞肿瘤等同于睾丸非精原细胞瘤 。它们的侵袭性与肿瘤的病理类型相关,其中以内胚窦瘤和绒癌的侵袭性最强。应用联合化疗后,内胚窦瘤和绒癌均为高度可治愈肿瘤。
多数患者即使已处于临床晚期,都可经化疗治愈,因此,所有期别生殖细胞肿瘤患者均可接受保守性手术。所谓保守性手术是指手术时仔细探查、对所有可疑病灶行活检、行有限度的减瘤术以避免大创伤。子宫和对侧正常卵巢可完整保留。不推荐对正常的对侧卵巢进行楔形活检,因可能导致不孕。晚期患者可从3~4个疗程的BEP方案(博来霉素、依托泊苷、顺铂)新辅助化疗中获益并保留生育功能。保守性手术后接受辅助化疗者仍有一定的妊娠率,未发现这些患者孕期不良事件的发生率会增高,也未发现其后代会出现远期不良结果。
尚无证据显示二次手术有益,但部分初次手术时肿瘤未全部切除的患者和原发肿瘤中含有畸胎瘤成分的患者可从二次手术中获益。手术切除残留病灶对于这些患者有益,原因在于可能存在成熟畸胎瘤结节,这些结节会持续增大(畸胎瘤增大综合征),极个别情况下这些结节会随时间而发生恶性转化形成无法治愈的恶性肿瘤,如鳞状细胞癌。
16.4 无性细胞瘤的术后治疗和随访 ⅠA期患者术后可观察。少数患者可能会复发,但复发时治愈率仍较高。存在卵巢外病灶的患者需要接受辅助化疗。虽然无性细胞瘤对放疗敏感,但基于放疗的远期不良反应和肿瘤对化疗高度敏感,放疗已不再推荐。
ⅠA期无性细胞瘤患者的随访方法可参照表4。该方案基于Patterson等和 Dark等对男性精原细胞瘤患者的随访研究结果。这一随访方案的作用尚未在随机试验中得 到验证。
无性细胞瘤对化疗极其敏感,多数患者甚至晚期患者通过化疗都可治愈。推荐的化疗方案为BEP方案3个疗程:(1)依托泊苷(E),每天100mg/m2,静脉滴注,连用5d,3周疗。(2)顺铂(P),每天20mg/m2,静脉滴注,连用5d,3周疗。(3)博莱霉素(B),30U,静脉滴注/肌注,第1、8、15天给药,共12周(可选,注意博莱霉素新的用药单位为国际单位)。 在BEP方案中去掉博莱霉素为EP方案,常用4个疗程。
由于BEP可导致急性不良反应和潜在的远期不良反应,包括继发性恶性肿瘤、心血管疾病、高血压、雷诺现象、肺毒性、肾毒性、神经毒性、耳聋、生育能力下降和社会心理问题等。因此,能否不用博来霉素或用卡铂替代顺铂备受关注。但试验结果结论不一。
如果术后残留病灶大,通常予3~4个疗程BEP方案化疗(证据等级B)。
卵巢生殖细胞肿瘤最佳随访方式尚未接受临床评估, 随访频率也存在争议。Ⅰ期患者和接受观察的患者需定期随访,可以选择表4中提到的随访方案 。接受化疗者会降低复发风险和CT扫描的频率,方式与睾丸生殖细胞肿瘤相似。每次随访均应行病史询问、体格检查和肿瘤标志物检测。肿瘤标志物固然重要,但影像学检查,特别对于诊断时肿瘤标志物阴性的患者,也很有价值。可根据临床需要选择CT或MRI。

未接受化疗的患者应密切随访。90%复发出现在2年内。除个别患者外,复发时多数患者都可被治愈(证据等级D)。
16.5 非无性细胞瘤的术后治疗和随访 非无性细胞瘤即使处于晚期,仍可通过化疗获得较高的治愈率。ⅠA期G1~2未成熟畸胎瘤预后良好,保守性手术后可仅进行观察,术后辅助化疗并不能改善生存率。虽然辅助化疗已常 规推荐给所有Ⅰ期非无性细胞瘤患者,但这一做法已受到了质疑,密切监测可能有用,而化疗应该用于复发患者,原因是这是男性Ⅰ期睾丸癌的标准治疗方法。其余非无性细胞瘤和更高期别、更高级别的未成熟畸胎瘤患者术后应接受化疗。推荐化疗方案为依托泊苷,每天100mg/m2,连用5d;顺铂,每天20mg/m2,连用5d;博莱霉素,30U,静脉滴注/肌注,第1、8、15天给药,共12周。低危患者推荐3个疗程,中危和高危患者4个疗程。
接受BEP方案化疗后复发的患者,使用二线方案如紫杉醇+异环磷酰胺+顺铂(paclitaxel-ifosfamide- cisplatin,TIP)仍可获得长期缓解。部分患者可考虑进行大剂量化疗,同时进行自体骨髓移植。这些患者应在专业医院接受治疗。
接受化疗后,有时转移性未成熟畸胎瘤仍然可有残留病灶,但组成成分可完全为成熟畸胎瘤。这些病灶可继续生长,化疗结束后应切除(证据等级B )。
所有患者均应检测 AFP和β-hCG以监测疗效 。所有化疗患者可参照无性细胞瘤的随访方法,需详细采集病史、进行体格检查并复查肿瘤标志物 。当临床需要时应该行CT或MRI检查 。复发常见于诊断后的2年内(证据等级D)。
17 卵巢肉瘤
卵巢肉瘤罕见,好发于绝经后女性 。由于预后极差,准确诊断该病以及与其他类型原发卵巢癌进行鉴别诊断 显得非常重要。
卵巢肉瘤分为恶性混合型米勒管瘤(Malignantmixed mulleriantumors,MMMTs)和同时含有癌及肉瘤两种成分的 癌肉瘤。多数学者认为,MMMTs为单克隆来源。肉瘤成分来源于肉瘤或发生异常分化的干细胞。因此,建议把卵巢癌肉瘤归为移行癌。早期MMMTs较晚期预后好,但总体预后差。该病由于少见,无法进行前瞻性随机对照试验,建议按照高级别浆液性癌处理。
卵巢MMMTs的手术处理原则与盆腔高级别浆液性癌相同。手术后,患者应接受含铂方案化疗。推荐按照上皮性恶性肿瘤的随访方式进行随访(证据等级C)。
单纯肉瘤极其少见,应该按照具体的病理学亚型进行治疗。这些少见的肉瘤包括:纤维肉瘤、平滑肌肉瘤、神经纤维肉瘤、横纹肌肉瘤、软骨肉瘤、血管肉瘤和脂肪肉瘤等。
18 讨论
本文对原文的某些条目进行了梳理,但内容不变。因篇幅所限,对于有些文中引用、大家已经很熟悉临床试验, 只列出研究名称及主要结果,有兴趣了解详细内容者可查阅具体参考文献。
《FIGO 2021 妇癌报告》(下简称《报告》)在近年来相关 临床研究取得新证据的基础上,对2018版妇癌报告进行了修订和完善。新版报告对新辅助化疗的临床应用和PARP抑制剂临床应用的相关证据进行了更为详细的总结。但是新辅助化疗的作用仍有争议,《报告》推荐新辅助化疗应限于因行为状态差而不适合接受初治肿瘤细胞减灭术的患者或发生手术并发症风险高包括诊断时已有肝实质和肺转移的患者。对生化复发的处理,《报告》介绍了推迟化疗、使用他莫昔芬和阿那曲唑等临床试验,也提出了颗粒细胞瘤的激素治疗。
PARP抑制剂是近年来卵巢癌治疗的最重要进展。《报告》对4项一线维持治疗的Ⅰ级证据——SOLO-1、PRIMA、PAOLA-1和VELIA进行了详尽总结,特别报道了SOLO-1的5年随访结果。PARP抑制剂已成为卵巢癌一线治疗中不可或缺的组成部分,对于BRCA基因存在体系或胚系致病性突变和HRD的晚期卵巢癌患者,一线使用PARP抑制剂进行维持治疗的意义已无争议。针对铂敏感复发治疗 后对铂反应的患者,使用奥拉帕利(SOLO2试验)、尼拉帕利(NOVA试验)和卢卡帕利(ARIEL-3试验)维持治疗均可显著延长患者的PFS。这些研究成果或许会改变目前的卵巢癌治疗模式,即在一线治疗缓解后和复发治疗缓解后加上PARP抑制剂维持治疗,以延长晚期卵巢癌患者的生存时间 。PARP抑制剂也可应用复发性卵巢癌患者的治疗,在BRCA体系或胚系致病性突变和HRD的晚期卵巢癌患者也获得了与化疗相当或略优于化疗的效果。也许在不久的将来,PARP抑制剂的应用使得把卵巢癌患者当成一个慢性病患者来管理将成为现实。
《报告》新增了有关肿瘤治疗的另一热门领域——免疫检查点抑制剂在卵巢癌的临床应用内容,但从现有证据来看,无论是初治还是复发,卵巢癌仍属于“冷肿瘤”,患者从免疫检查点抑制剂中获益极为有限。
《报告》根据GOG218、ICON7、OCEAN、AURELIA等临床试验结果推荐了抗血管生成药物贝伐单抗的应用,提出需要进一步研究明确贝伐单抗的作用、最佳剂量,使用时机和维持治疗时限。
《报告》以较大篇幅介绍了低级别浆液性癌的研究进展,特别是近年来激素治疗和针对Ras-Raf-MEK-ERK通路的靶向治疗的进展,突出了激素治疗在低级别浆液性腺癌患者中的作用。
在《报告》中,有几处提法值得商榷或可能是笔误或疏忽。 比如:(1)推荐Ⅰ期交界性肿瘤患者可保留生育功能, 应为“只要对侧卵巢和子宫正常,任何期别交界性肿瘤均可保留生育功能”。(2)对于无性细胞瘤的处理,《报告》推荐“ ⅠA 期患者术后可观察”,应为“Ⅰ期患者可观察”。(3) 性索间质肿瘤中漏掉了恶性卵泡膜细胞瘤的内容。(4 )对于生殖细胞肿瘤的处理,《报告》推荐所有期别患者均可接 受保守性手术,子宫和对侧正常卵巢可完整保留。《报告》中未明确该推荐的适用年龄和是否希望保留生育功能 。我们认为保守性手术限于年轻或希望保留生育功能的患者较为合适。(5)《报告》对全面分期手术的推荐略为保守, 推荐行“选择性”盆腔和主动脉旁淋巴结切除术,单侧肿瘤至少切除同侧盆腔淋巴结。实际上,腹主动脉左侧、肠系膜下动脉上方至左肾静脉这部分淋巴结转移发生率最高, 在全面分期手术中切除这部分淋巴结非常重要。熟练掌握肾静脉水平的主动脉旁淋巴结切除术是一个合格妇科肿瘤医生的基本要求,当务之急是加强妇瘤专科医生规范 化培训,而不是迁就手术水平低而降低手术要求。
 妇产科在线APP下载
妇产科在线APP下载













