【编者按】铂耐药复发卵巢癌患者对含铂化疗方案不再敏感,临床上一般推荐非铂化疗,但反应率不高,仅有10%~20%。2021 NCCN指南讲到,铂耐药/难治卵巢癌患者的治疗策略有限,推荐患者参加临床试验、和/或最佳支持治疗、和/或复发治疗。本例患者经过了9次治疗、7次复发/疾病进展,接受过手术+含铂方案化疗、抗血管生成药物靶向治疗、白蛋白紫杉醇单药化疗、PARP抑制剂(PARPi)维持治疗、化疗+抗血管生成药物靶向治疗+放疗联合治疗等方案,疾病持续进展,情况十分棘手。经过重重考量,患者最终接受了PARP抑制剂帕米帕利靶向治疗+抗血管生成药物阿帕替尼靶向治疗的联合治疗,效果显著,短期内疾病得到控制,达到部分缓解。用药初期患者出现乏力、恶心、呕吐、心慌等PARPi 常见不良反应,予帕米帕利减量,阿帕替尼原剂量服用,不良反应缓解,证实了这一方案的有效性和安全性。

黄雪 副主任医师
常州市肿瘤医院妇瘤科副主任医师,医学硕士,常州市医学会肿瘤分会青年委员。从事恶性肿瘤放射治疗十余年,尤其擅长妇科恶性肿瘤的精确放疗、化疗、靶向治疗等综合治疗。在国内外杂志发表论文数篇,其中SCI论文3篇。多次参与省级、市级、卫健委课题项目,目前主持常州市卫键委重大项目1项。
病例信息
性别:女
年龄:57岁
治疗经过
一线治疗
2013-07-24 行卵巢癌肿瘤减灭术,术后诊断为卵巢癌IIIC期。
2013-8-13至2014-06-06 行6程紫杉醇+顺铂(TP方案)化疗。末次化疗时间:2014-06-06。
基因检测:BRCA1/2未突变。
疗效评价:完全缓解(CR)。
二线治疗(铂敏感复发,PFI:12 m)
2015-06-08 行PET-CT检查:腹盆腔、腹膜广泛种植转移,最大病灶位于脾胃间隙。
2015-06-16 行二次肿瘤减灭术(脾切除+大网膜切除+乙状结肠旁沟病灶切除+乙状结肠系膜病灶切除+左肾包膜病灶切除)。
术后行6程紫杉醇+卡铂(TC方案)化疗。末次化疗时间:2015-10-30。
疗效评价:CR。
三线治疗(铂敏感复发,PFI:7 m)
2016-05-19 行PET-CT检查:新增肝脏尾状叶转移,右侧膈肌局限性略增厚。
2016-05-31 在外院行特殊肝段切除+肝尾状叶切除+肠粘连松解术。
术后行4程多西他赛+卡铂化疗。末次化疗时间:2016-09-10。
疗效评价:CR。
四线治疗(铂敏感复发,PFI:6 m)
2017-03-21 查CA125:70.40 U/ml,至上海中山医院行PET-CT检查,新增肝脏右叶包膜下肝脏尾状叶术区、胃壁、腹盆腔腹膜及网膜、肠系膜种植转移,右腹壁种植转移不除外。
2017-04-05 在外院行第4次卵巢肿瘤减灭术(特殊肝段切除+膈肌肿瘤切除膈肌修补+小肠部分切除+吻合术+胃网膜囊病灶切除+小网膜肿物切除+肝肾隐窝病灶切除+下腔静脉旁病灶切除+横结肠系膜病灶切除+降结肠系膜病灶+小肠系膜病灶切除+乙状结肠系膜病灶切除+盆腔腹膜病灶切除+回盲部病灶切除+脐孔病灶切除术+肠粘连松解术)。
术后行腹腔化疗3次(顺铂+依托泊苷)+静脉化疗三次(多西他赛+卡铂)。
疗效评价:CR。
五线治疗(铂耐药复发,PFI:5 m)
2018-01-06 复查CA125:58 U/ml,口服阿帕替尼靶向治疗,不定期复查CA125,无明显增高。
疗效评价:部分缓解(PR)。
六线治疗(复发间隔:12 m)
2019-04-23 复查CT:(1)结合临床,复发性卵巢癌术后化疗后,双侧髂血管旁新发肿大淋巴结,双侧膈前淋巴结较前增大;腹腔及腹膜后、双侧腹股沟小淋巴结,与前相仿;(2)脾区结节灶,考虑副脾;(3)脂肪肝、胆囊增大、胆囊结石;(4)隆突下淋巴结较前增大,另纵膈多发小淋巴结。CA125:198 U/ml,白蛋白紫杉醇化疗3程。CA125:22 U/ml。
疗效评价:CR。
七线治疗(复发间隔:4 m)
2019-12-18 查CT:(1)复发性卵巢癌术后化疗后,左侧腋窝、腹腔(幽门下区)及腹膜后小淋巴结较前增大;纵膈内、双侧膈前、髂血管旁及腹股沟区小淋巴结,与前相仿;(2)胃窦部壁可疑软组织灶,间质瘤?建议进一步检查;(3)脾区结节灶,考虑副脾;脂肪肝;肝左叶小囊肿,与前相仿;胆囊结石。CA125:133.9 U/ml。
2020-02-28至05-15 行白蛋白紫杉醇化疗4次;CA125:42.3 U/ml。复查CT:胃窦部壁软组织灶,较前增大,间质瘤?建议进一步检查。
2020-07-03 行胃部分切除+肠粘连松解+幽门成形术。术后病理:(胃窦)腺癌,结合免疫组化考虑为转移性卵巢浆液性癌,侵及粘膜、肌层、浆膜下。
2020-09-10 复查CA125:22.5.U/ml。
疗效评价:CR。
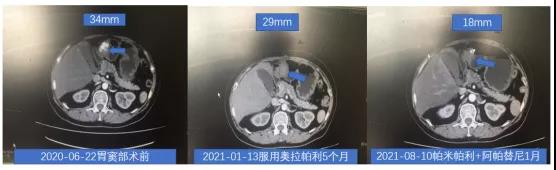
后口服奥拉帕利维持治疗5个月。
八线治疗(复发间隔:5 m)
2021-01-14 复查CA125持续上升;停服奥拉帕利。
2021-01-21 复查CT:(1)结合临床,复发性卵巢癌术后化疗后,左侧腹股沟淋巴结肿大,较前增大;腹腔(幽门下区)及腹膜后小淋巴结部分较前缩小,部分较前增大;左侧腋窝、纵膈内、双侧膈前、髂血管旁及腹股沟小淋巴结,与前相仿;中腹部皮下软组织灶,较前略增大;(2)胃窦部壁软组织灶2.9 cm。
2020-02-24 查CA125:58.1U/ml。
2021-02-24、03-17 行TC方案化疗+贝伐珠单抗联合治疗。
2021-04-08 复查CA125:39.5 U/ml。
疗效评价:SD。
九线治疗(疾病持续状态)
2021-04 至外院就诊,行3程化疗(5-FU介入化疗)和粒子植入放疗。
2021-07-09 复查CA125:82.8 U/ml。
2021-07-14 外院CT示胃窦部壁软组织灶3.5 cm。
疗效评价:PD。
帕米帕利治疗经过
2021-07-14 开始服用帕米帕利40 mg po bid和阿帕替尼125 mg po bid联合治疗,用药5天后因乏力、恶心、呕吐、心慌等PARPi常见不良反应,予帕米帕利减量至20 mg po bid,阿帕替尼原剂量服用,不良反应缓解。恢复帕米帕利40 mg po bid。
疗效评价:PR。
病理检查
2013-07-24 第一次术后病理:右卵巢浆液性乳头状囊腺癌,右侧输卵管泡状附件,大网膜见多灶浆液性乳头囊腺癌结节,肠表面见浆液性乳头状囊腺癌结节,淋巴结未见癌转移(左盆腔0/4,右盆腔0/5,左髂总0/2,右髂总0/1),左卵巢交界性浆液性乳头状囊腺瘤,局灶癌变。
2020-07-03 行胃部分切除+肠粘连松解+幽门成形术,术后病理:(胃窦)腺癌,结合免疫组化考虑为转移性卵巢浆液性癌,侵及粘膜、肌层、浆膜下。
基因检测:BRCA1/2未突变。
辅助检查
实验室检查结果,CA125变化如下。
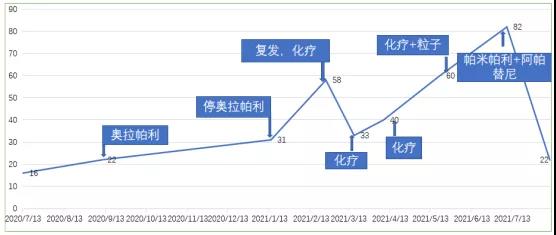
影像学检查
病例总结
本例患者2013年7月行卵巢癌肿瘤减灭术,术后诊断为卵巢癌IIIC期。接受6程TP方案化疗,末次化疗时间为2014年6月,达到补充疗效评价,基因检测BRCA1/2未突变。此后患者经历3次铂敏感复发,PFI逐渐缩短,首次复发间隔至第3次复发间隔分别为12个月、7个月、6个月,直至2018年1月,第4次复发时转变为铂耐药复发,复发间隔缩短至5个月。此时不再使用铂类药物,改用抗血管生成靶向药阿帕替尼治疗,复发间隔延长至12个月。第5次复发时发现多处转移,给予白蛋白紫杉醇化疗,达到CR。然而仅仅4个月后,患者便再次复发,癌灶转移,化疗+手术后口服PARP抑制剂奥拉帕利维持治疗5个月后,再度复发。自2021年1月起,CA125持续上升,CT发现胃窦部壁软组织灶2.9 cm。2021年4月起行TC方案化疗3程+贝伐珠单抗联合治疗,疾病持续,行化疗+粒子植入放疗,CA125仍然居高不下。胃窦部壁软组织灶3.5 cm,较前增大。
有小样本的回顾性分析显示,前线使用过PARPi的患者并不完全耐药,后线仍然可以尝试使用;对于复发性卵巢癌患者,PARPi联合抗血管生成似乎具有可耐受的抗肿瘤活性。2021年7月,患者开始接受帕米帕利+阿帕替尼联合治疗。用药5天后因出现乏力、恶心、呕吐、心慌等PARPi常见不良反应,予帕米帕利减量,阿帕替尼原剂量服用,不良反应缓解。经治疗现已达到PR。
本例多线复发患者的诊疗历程,证实了PARPi after PARPi的可行性,并且PARPi+抗血管生成药物联合治疗显示出良好疗效,对铂耐药复发/难治性卵巢癌患者,特别是对BRCA野生型患者的临床意义,值得进一步探索。
专家点评

杨宇星 主任医师
主任医师
常州市肿瘤医院妇瘤科副主任
宫颈癌诊疗中心主任
江苏省肿瘤预防与控制专业委员会委员
常州市抗癌协会理事
常州市医疗鉴定委员会专家
从事妇科肿瘤工作二十余年,擅长妇科恶性肿瘤手术、放疗、化疗相结合的综合治疗,尤其是妇科恶性肿瘤的精确放疗。
卵巢癌是病死率最高的妇科恶性肿瘤,70%的卵巢癌患者就诊时已是临床晚期。卵巢癌患者首选治疗模式为肿瘤细胞减灭术联合以铂类为基础的化疗。虽然大多数患者经过初始治疗可获得临床缓解,但仍有70%的患者在3年内复发。随着复发次数增多,复发间隔逐渐缩短,患者逐渐对铂耐药,非铂类单药化疗有效率仅有10%~20%。2021 NCCN指南讲到,铂耐药/难治卵巢癌患者的治疗策略有限,推荐患者参加临床试验、和/或最佳支持治疗、和/或复发治疗。
本例患者经过了9次治疗、7次复发/疾病进展,接受过手术+含铂方案化疗、抗血管生成药物靶向治疗、白蛋白紫杉醇单药化疗、PARP抑制剂维持治疗、化疗+抗血管生成药物靶向治疗+放疗联合治疗等方案,疾病持续进展,情况十分棘手。帕米帕利是我国企业百济神州自主研发的一款PARP抑制剂,在其II期临床研究BGB-290-102研究中,≥2线化疗后的铂敏感复发和铂耐药复发患者均获得了良好的客观缓解率(ORR)和中位缓解持续时间(DOR)数据。尤其是对铂耐药患者,ORR达31.6%,中位DOR为11.1个月,远胜于化疗。但本例患者此前已经使用过其他PARP抑制剂且由于疾病进展停药,PARPi after PARPi的问题仍无定论,需要慎重考虑。体外实验表明,帕米帕利是目前唯一非药物泵(P-gp)底物的PARP抑制剂,这意味着药物进入细胞后不易被泵出,因此可以保持细胞内的药物浓度处在相对稳定的状态,保证疗效。同时,这一特点还赋予帕米帕利抗耐药性,一定程度上可以降低耐药发生的可能,因此对化疗或其他PARP抑制剂耐药的患者,或许可以尝试使用帕米帕利。
另一项经伦理审查委员会(IRB)批准的多中心、回顾性分析显示,上皮性卵巢癌患者使用PARPi后再使用PARPi,前线使用的PARP抑制剂并不一定意味着未来PARP抑制剂的耐药,初始使用PARP抑制剂的毒性与第二次使用PARP抑制剂的毒性无显著相关性。重复使用PARP抑制剂和使用的顺序、方式等都可能对PARPi after PARPi的疗效和安全性产生影响。一项国内多中心、II期研究ANNIE 研究显示PARP抑制剂+小分子多靶点酪氨酸激酶抑制剂靶向治疗铂耐药复发卵巢癌患者的ORR达53.3%。经过重重考量,患者最终接受了PARP抑制剂帕米帕利靶向治疗+抗血管生成药物阿帕替尼靶向联合治疗,效果显著,短期内疾病得到控制,达到部分缓解。用药初期出现乏力、恶心、呕吐、心慌等PARPi常见不良反应,予帕米帕利减量,阿帕替尼原剂量服用,不良反应缓解。这证实了这一方案的有效性和安全性,也期待这一方案在之后带给患者更长久的获益,为铂耐药/疾病持续的复发卵巢癌患者提供新的解决办法。
专家点评

黄欣 教授
中山大学肿瘤防治中心、妇科
主诊教授、主任医师
从事妇科肿瘤的医教研工作30余年,擅长各种妇科肿瘤的诊治工作,在妇科恶性肿瘤的手术治疗方面积累了丰富经验,包括各种疑难复杂病例的手术治疗以及肿瘤复发后的大型手术,擅长手术、化疗和免疫靶向综合治疗妇科恶性肿瘤。
深入开展复发卵巢癌和宫颈癌的临床与基础研究,国内外率先提出并证明化疗加靶向“全口服”方案治疗铂耐药卵巢癌患者的临床价值;率先采用 “免疫联合抗血管生成”治疗复发宫颈癌患者获得成功。
主持VP-16联合Apatinib治疗复发难治铂耐药卵巢癌全国多中心前瞻III期临床研究,主持多个多中心免疫靶向、免疫化疗联合手段治疗复发难治宫颈癌和卵巢癌患者的临床研究。
以第一/通讯作者在Lancet Oncology、Journal of Clinical Oncology、Gynecologic Oncology等国际知名SCI 杂志发表论文10多篇,累计影响因子>90。
经规范治疗达到临床缓解的卵巢癌患者出现肿瘤标志物升高、胸腹水、查体或影像学检查发现包块、不明原因的肠梗阻,有其中一项阳性或几项阳性提示卵巢癌复发。无铂间期(PFI)是指从最后一次含铂治疗结束到疾病进展的时间间隔。PFI≥6个月为铂敏感复发,PFI<6个月为铂耐药复发,治疗后疾病未控制,疾病持续或进展者,也属于铂耐药/难治性患者。
对于铂敏感复发卵巢癌患者,治疗原则是继续选用以铂类为基础的联合化疗。对于身体状态良好、无腹水、病灶孤立或局限的患者,经影像学或腹腔镜评估可实现R0切除的患者可考虑进行二次细胞减灭术。近几年GOG0213研究、DESKTOPIII研究以及我国专家开展的SOC1研究等都强调了R0切除的重要性,同时医生的专业技能和医院的综合实力也是影响手术能否达到R0切除的重要因素。只有达到R0切除,患者才能真正获益,否则接受手术的患者预后比单纯化疗患者的预后还要差。
铂敏感复发卵巢癌患者经过标准化疗或手术+化疗缓解后,可考虑维持治疗,以推迟再次复发时间或降低复发风险。研究证实,不论BRCA是否突变,PARP抑制剂维持治疗可使卵巢癌患者显著获益,并且不良反应可耐受,已经成为铂敏感复发卵巢癌患者维持治疗的标准方案。但对于铂耐药复发卵巢癌患者,PARP抑制剂维持治疗并没有充分的证据。本例患者七线治疗时经非铂化疗+手术达CR,术后使用PARP抑制剂维持治疗5个月,其获益是化疗+手术抑或是PARP抑制剂带来的?谁产生的获益更多?之后复发是否是对PARP抑制剂耐药?这些问题都有待研究去探索。
目前对于铂耐药复发/难治性卵巢癌患者治疗首选非铂类单药化疗或联合抗血管生成靶向药物的联合治疗。对于一些存在特定生物标志物的复发性卵巢癌患者,也可以考虑包括NTRK抑制剂、免疫检查点抑制剂在内的治疗。尽管没有铂耐药复发卵巢癌患者PARP抑制剂维持治疗的证据,但PARP抑制剂用于铂耐药复发卵巢癌患者的治疗已经取得不错的成绩。
帕米帕利的BGB-290-102研究显示,帕米帕利在BRCA突变的三线及以上的铂敏感复发卵巢癌(PSOC)患者和铂耐药复发卵巢癌(PROC)患者的单药治疗中均显示出了优越的缓解数据,其治疗PSOC患者的ORR达到64.6%,中位无进展生存期(mPFS)达到15.2个月;治疗PROC患者的ORR达到31.6%,mPFS达到6.2个月。研究结果证实了帕米帕利在晚期复发卵巢癌患者后线治疗中的良好疗效,也基于这一研究,帕米帕利成功获批上市,为临床提供了新的武器和手段。
而抗血管生成药物作用机制独特,并不需要特定的基因突变等生物标志物,是非常适合与其他药物联合的一类药物。对于无BRCA突变的患者,PARP抑制剂联合抗血管生成药物,就机制而言,两者一种抑制合成修复,一种抗血管生成,理论上讲,两者联合可能会发挥协同作用,增加抗肿瘤的敏感性。并且帕米帕利具有如下特殊作用机制:①相比其他PARP抑制剂,对PARP1和PARP2酶具有强效高选择性;②不是P-gp的底物,具有抗耐药性;③有更强的血脑屏障穿透能力。帕米帕利联合抗血管生成药物治疗将是强强联手,疗效值得期待。而本例患者在尝试过多种治疗方案,经过多达9线治疗,疾病进展的情况下,接受上述联合治疗方案确实疗效显著,疾病很快得到控制,达到缓解,病灶也在持续缩小,拓展了铂耐药复发/难治性卵巢癌患者的治疗思路,具有重要临床意义。
 妇产科在线APP下载
妇产科在线APP下载













