原标题丨罕见部位的息肉:阴道、宫颈和输卵管
来源丨2021-Vol 7 Newsletter from Hysteroscopy - Issue 2 P. 24-26
作者丨Emma Marquez医学博士 Carugno Jose医学博士 迈阿密大学米勒医学院微创妇科 美国
译者丨张晓昱
审校丨夏恩兰
单位丨首都医科大学附属复兴医院 宫腔镜中心
子宫内膜息肉(Endometrial polyps)是绝经前和绝经后妇女异常子宫出血的常见原因。女性生殖道息肉通常位于宫腔内,并且通常为良性息肉。尽管输卵管和阴道内的息肉似乎很罕见,但有时在阴道、子宫颈和输卵管中也可能发现息肉。通常,这些部位的息肉可以通过宫腔镜检查进行诊断及治疗,并送病理检查。
女性生殖系统来源于中胚层、原始生殖细胞、体腔上皮和间充质(Moncada Madrazo,2020)。子宫由苗勒管发育形成,并伴随着阴道上1/3、子宫颈和两侧输卵管的发育。鉴于其胚胎起源,因此在子宫、宫颈和输卵管中形成的息肉,其结构应该是相似的。
一、输卵管息肉
子宫内膜组织有一小部分蔓延到输卵管粘膜层,输卵管息肉是子宫内膜组织的良性增生(Heatley,2001,Chung,1990)。在育龄期,输卵管息肉非常罕见,也很少有人知道其临床意义和影响。
输卵管息肉大多数是在对不孕症患者进行子宫输卵管造影评估或进行诊断性宫腔镜检查时被发现的(Wansaicheong,1998)。在上世纪90年代后期,两篇综述报道了输卵管息肉在不孕妇女子宫输卵管造影中的发生率为3.8%~11.3%(Wansaicheong,1998,Lee,1997)。通过宫腔镜可以很容易地切除这些息肉(Stangel,1981,Guo,2018)。
曾有一例行子宫输卵管造影时发现输卵管间质部息肉完全阻塞输卵管的病例被报道(Guo,2018)。随后通过宫腔镜切除息肉,一年后患者自然妊娠。此外,在一项关于生育力低下妇女的少数病例汇报中,发现在患有较大输卵管息肉(作者将其定义为直径>5 mm)的妇女中,稀发排卵和无排卵情况的发生更为普遍(Alasiri,2012)。
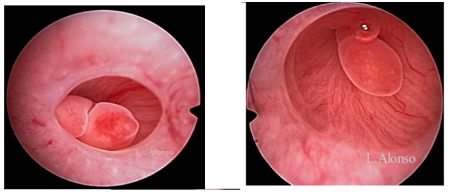
有趣的是,子宫内膜异位症与大于或小于5 mm的输卵管息肉均有关。Alasiri等假设,无排卵和子宫内膜异位症并存可能会导致宫角息肉的形成,因为这两种情况都与子宫内膜增生有关(Alasiri,2012)。考虑到其他作者已经发现输卵管息肉起源于子宫内膜,因此,这个理论是可信的(Chung,1990)。
虽然输卵管息肉很少见,但通过宫腔镜检查可以被发现,如果患者有生育意愿,切除息肉后可以提高生育能力。
二、宫颈息肉
宫颈息肉是纤维血管基质核心周围上皮组织的乳头状增生。纤维血管基质核心可能有腺上皮或鳞状上皮(Levy,2016)。它们通常有蒂,大小在2~30 mm之间,并且可能来自于宫颈管的任何部位(Stamatellos,2007)。宫颈息肉的病因尚不清楚。但有报道认为,宫颈息肉可能与慢性炎症相关的局灶性增生、对雌激素水平升高的异常局部反应或宫颈血管引起的局部充血有关(Berzolla,2007)。
宫颈息肉大多无症状,但也可能导致经间期、性交后或绝经后出血(通常表现为少量的点状出血)或阴道分泌物增多(Tilapur,2010年,Stamatellos,2007年)。
宫颈息肉可通过常规妇科检查、阴道镜、子宫输卵管造影中出现充盈缺损、超声或子宫内膜活检发现(Stamatellos,2007)。
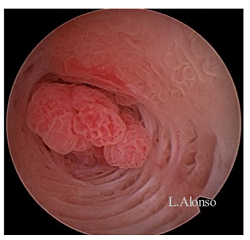
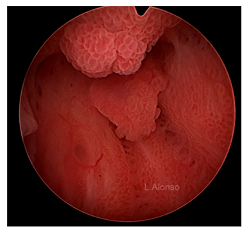
宫颈息肉是良性的组织增生,极不可能为恶性。一项评估了22246个宫颈息肉病例的研究发现,仅0.1%的息肉为恶性,0.5%的息肉为发育不良,仅有1.6%的患者为反应性非典型性增生(Berzolla,2007)。然而,良性的炎症改变见于27.7%的宫颈息肉,化生占13.6%,微腺体增生占6.8%(Berzolla,2007)。其他研究报道,宫颈息肉的异常增生率(2.2%)、非典型或恶性表现(1.6%)较高(Levy,2016年)。在无症状和有症状的息肉之中,恶性的几率也存在一定差异,有症状的息肉更可能为恶性(Golan,1994)。
此外,与子宫内膜息肉相反,多项研究发现,绝经前妇女的非典型性和异常增生的发生率高于绝经后妇女(Levy,2016,Schnatz,2009)。研究认为,年轻女性患阴道炎、宫颈炎、性传播疾病和人乳头瘤病毒(HPV)相关炎症变化的可能性更高,导致反应性非典型性增生和化生的发病率更高(Schnatz,2009年)。
宫腔镜是诊断宫颈息肉的位置、数量和大小最有效的方法(Stamatellos,2007)。有趣的是,一项宫腔镜下评估宫颈息肉的研究发现,接近17%初次诊断的宫颈息肉反而来自宫腔(Spiewankiewicz,2003)。对于由于子宫颈息肉的存在而导致绝经后出血的患者,宫腔镜检查是必要的。
由于许多子宫颈息肉的患者同时合并子宫内膜息肉,因此,有必要对子宫内膜进行宫腔镜评估(Coeman,1993)。这项包括3046例诊断性宫腔镜检查的研究发现,存在宫颈息肉的情况下,子宫内膜息肉的发生率随着年龄的增长而增加。总的来说,26.7%具有子宫颈息肉的妇女同时合并子宫内膜息肉。29岁以下的妇女只有10%患有子宫内膜息肉,而70岁以上的妇女近86%患有子宫内膜息肉。
宫颈息肉可在诊室通过扭转或撕扯根部去除(Stamatellos,2007)。然而,这些方法通常会在宫颈管内留下残余的息肉组织,并且这可能与息肉复发率较高有关,总的复发率为6.2%~12.6%(Berzolla,2007年,Tirlapur,2010年)。相反,宫腔镜检查不仅可以精确暴露息肉蒂部,并且可以帮助宫腔镜医师诊断和治疗并发的无症状宫内病变。
三、阴道息肉
阴道息肉像输卵管息肉一样罕见,并且在文献中很少报道。一篇综述仅发现75例阴道息肉病例(Song,2012)。
阴道息肉似乎是激素的反应,因为它们通常发生于孕妇或应用激素治疗(包括孕激素)的妇女(Song,2012)。在组织病理学上,它们通常表达雌激素或孕激素受体(Song,2012)。此外,一例患有较大阴道息肉孕妇的病例报道显示,产后阴道息肉会自发消退。因此作者得出结论,阴道息肉是激素介导的(Samal,2015)。
阴道息肉可能表现为增生状态,而不是肿瘤状态(Heller,2017)。阴道息肉通常表现为间质细胞增生、细胞异型性和有丝分裂增多,这可能导致阴道息肉被误诊为肉瘤(Song,2012)。
然而,作者强调这些息肉的良性本质。阴道息肉可以进行简单切除治疗,因为其复发很罕见(Heller,2017)。
结论和未来方向
宫腔镜在这些罕见部位息肉的治疗中必不可少。大多数发生在女性生殖道的息肉可以通过宫腔镜诊断和切除。此外,通常需要额外的治疗,例如对存在宫颈息肉的患者进行子宫内膜取样或切除输卵管息肉,以增加其生育的可能。
此外,虽然这些罕见部位的息肉不太可能为恶性,但是,宫腔镜检查可以早期诊断子宫内膜增生或输卵管恶性肿瘤。事实上,一些作者建议将输卵管取样作为卵巢癌早期检测的一种手段(Gizzo,2017),但仍需要更多的研究来确定宫腔镜在卵巢癌和输卵管癌早期诊断中的作用。
参考文献
1- Gizzo, S., et al. (2017). "A novel hysteroscopic approach for ovarian cancer screening/early diagnosis." Oncol Lett 13(2): 549-553.
2-Moncada-Madrazo M, Rodríguez Valero C. Embryology, uterus. StatPearls Web site.https://www.ncbi.nlm.nih.gov/books/NBK547748/. Updated 2020. Accessed February 25, 2021.
3- Samal, S. K., et al. (2015). "Fibroepithelial Polyps of the Vagina in Pregnancy." J Clin Diagn Res 9(10): QJ01-02.
4- Heller, A., et al. (2017). "Pseudosarcomatous Vaginal Polyp." Int J Surg Pathol 25(1): 54-55.
5- Song, J. S., et al. (2012). "Cellular pseudosarcomatous fibroepithelial stromal polyp of the vagina during pregnancy: a lesion that is overdiagnosed as a malignant tumor." Korean J Pathol 46(5): 494-498.
6- Tinelli, Andrea., Alonso Pacheco, Luis.,Haimovich, Sergio.,. Atlas of hysteroscopy.Updated 2020.
7- Schnatz, P. F., et al.(2009). "Cervical polyps in postmenopausal women: is there a difference in risk?" Menopause 16(3): 524-528.
8- Spiewankiewicz, B., et al. (2003). "Hysteroscopy in cases of cervical polyps." Eur J Gynaecol Oncol 24(1): 67-69.
9- Coeman, D., et al. (1993). "Hysteroscopic findings in patients with a cervical polyp." Am J Obstet Gynecol 169(6): 1563-1565.
10- Golan, A., et al. (1994)."Cervical polyp: evaluation of current treatment." Gynecol Obstet Invest 37(1): 56-58.
11- Berzolla, C. E., et al. (2007). "Dysplasia and malignancy in endocervical polyps." J Womens Health (Larchmt) 16(9): 1317-1321.
12- Tirlapur, S. A., et al. (2010). "Clinico-pathological study of cervical polyps." Arch Gynecol Obstet 282(5): 535-538.
13- Levy, R. A., et al. (2016). "Cervical polyps: Is histologic evaluation necessary?" Pathol Res Pract 212(9): 800-803.
14- Stangel, J. J., et al. (1981). "Microsurgical resection of bilateral fallopian tube polyps." Fertil Steril 35(5): 580-582.
15- Chung, C. J., et al. (1990). "Bilateral fallopian tubal polyps: radiologic and pathologic correlation." Urol Radiol 12(2): 120-122.
16- Kim, M. R., et al. (2003). "High frequency of endometrial polyps in endometriosis." J Am Assoc Gynecol Laparosc 10(1): 46-48.
17- Alasiri, S. A., et al. (2012)."Cornual polyps of the fallopian tube are associated with endometriosis and anovulation." Obstet Gynecol Int 2012: 561306.
18- Brubaker, L. M. and R. L. Clark (2005). "Effects of interstitial fallopian tube polyps on isthmic tubal diameter." Fertil Steril 83(5): 1500-1503.
19- Heatley, M. K. (2001)."Polyp of the fallopian tube." Pathology 33(4): 538-539.
20- Brubaker, L. M. and R. L. Clark (2005)."Effects of interstitial fallopian tube polyps on isthmic tubal diameter." Fertil Steril 83(5): 1500-1503.
21- Wansaicheong, G. K. and C. L. Ong (1998). "Intramural tubal polyps--a villain in the shadows?" Singapore Med J 39(3): 97-100.
22- Guo, X., et al. (2019). "Interstitial Fallopian Tube Polyp." J Minim Invasive Gynecol 26 (5): 794-795.
-完-


 妇产科在线APP下载
妇产科在线APP下载













