栏目第一期内容分析了一位体检发现双肺多发结节的39岁女性的诊疗经过。患者孕一产一,除剖宫产、因多发性子宫肌瘤行次全子宫切除术之外,并无其他异常病史。她的双肺多发结节性质如何,是什么原因导致的?让我们跟随吴玉梅教授团队来一探究竟。
作者:何玥 常虹(吴玉梅知名专家教授团队)
审校:吴玉梅
单位:首都医科大学附属北京妇产医院妇瘤科
诊治过程
患者,女性,39岁。
既往史:G1P1,2011年行剖宫产,否认慢性病、药敏史、传染病史、输血史及肿瘤家族史。
2014年3月
因“多发性子宫肌瘤”在外院进行了次全子宫切除术。
术后病理结果:子宫底、子宫体部肌壁间见肌瘤结节4枚,直径2~7 cm,另见不规则肌瘤结节一枚,大小14×11×4 cm。
我院病理会诊:子宫多发性平滑肌瘤,部分生长活跃,核分裂像5个/10 HP,局灶可疑静脉内生长。
此后患者进入观察期,未规律复查。
2019年9月
患者无咳嗽、咳痰及呼吸困难等不适,参加体检时发现“双肺多发结节”。
PET-CT检查:双肺内弥漫多发结节灶,以左肺下叶前内基底段的结节最大,边界清楚光滑,形态规则。
在外院进行了胸腔镜下右肺上叶、中叶楔形切除术。
术后病理结果:右肺上叶平滑肌瘤,结合免疫组化结果及临床病史,考虑为子宫平滑肌瘤转移。右肺梭形细胞构成之肿瘤,考虑为肺平滑肌瘤病。免疫组化染色(IHC):CD34(-),Desmin(+),Actin(+),Ki-67(约2%+),TTF-1(-),ER(+),PR(+)。
我院病理会诊:结合患者病史及免疫组化检查结果,符合肺良性转移性平滑肌瘤(PBML)。
该患者初步诊断为PBML。
2019年12月(部分肺切除术后3个月)
胸部增强CT复查:两肺内随机分布多发结节灶,大小不等,较大的位于左肺下叶,结合病史仍考虑为PBML。
盆腔增强MRI:子宫残端右前方多发占位性病变,最大径约28 mm,考虑子宫肌瘤复发。
患者距前次手术时间短,肺部功能尚未完全恢复,暂时给予保守治疗,GnRH-a剂量3.75 mg,每4周皮下注射一次,控制病情发展。
2020年4月(部分肺切除术后7+个月)
期间因疫情中断治疗,后继续给予GnRH-a剂量3.75 mg,每4周皮下注射一次,先后共使用4次。
胸部CT复查:双肺多发大小不等的结节,较前略缩小。
盆腔增强MRI:宫颈右前上方见不规则肿块,分叶状,大小约3.9×5.8×4.2 cm,增强扫描不均匀明显强化,与宫颈分界不清,已向右达右盆壁髂内外血管间,宫颈左上缘见直径1.2 cm结节;考虑子宫平滑肌瘤腹膜种植可能性大。
2020年7月(部分肺切除术后10个月)
复查肿瘤标志物:CA125、CA199、CEA及人附睾蛋白均未见异常;内分泌检查FSH:2.17 IU/L,LH:2.41 IU/L,eE2:448.69 pmol/L,PRGE:19.17 nmol/L,PRL:234.73 mIU/L,TSHII:0.79 nmol/L。
双下肢血管超声、超声心动图:未见明显异常。
胸部CT平扫+增强检查:较4月时变化不明显。
与患者充分沟通,了解各种治疗方法的利弊,其要求手术治疗,遂主因“多发子宫肌瘤术后6+年,肺部结节切除术后10个月,发现盆腔包块7个月”收入院,行经腹宫颈切除术+残端肌瘤切除术+双侧输卵管卵巢切除术。
术后病理结果:静脉内平滑肌瘤病,部分富含脂肪,累及左宫旁血管。
患者术后口服来曲唑治疗,至今复查,肺部病变无进展,无盆腔复发。
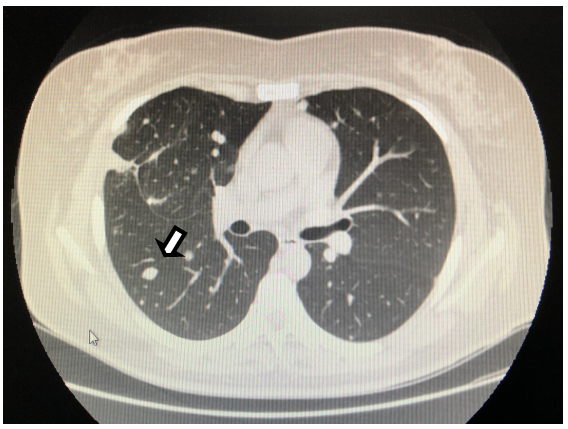
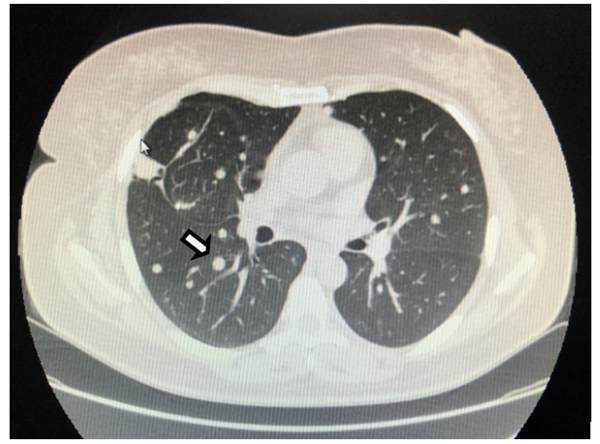
胸部增强CT扫描:2020.04(术前)GnRH-a第1次注射后,2020.07(术前)GnRH-a第4次注射后(→所指为病灶)。

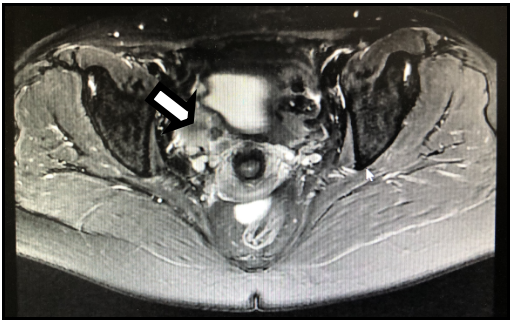
盆腔增强MRI 扫描:2020.04(术前)MRI 冠状面,2020.04(术前)MRI 横截面(→所指为病灶)。
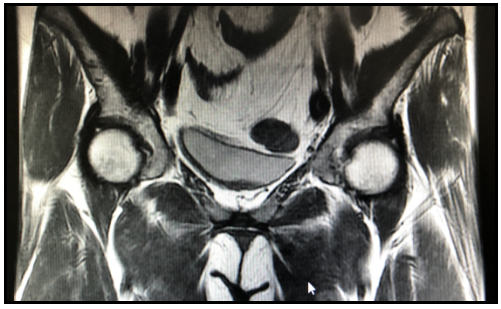
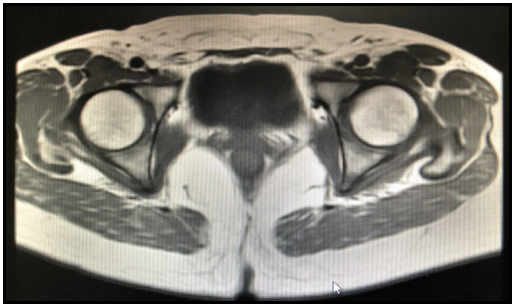
盆腔增强MRI:2021.02(术后)MRI 冠状面,2020.04(术后)MRI 横截面。
鉴别诊断
1. 肺部原发性平滑肌瘤
2. 肺原发性或转移性恶性肿瘤
3. 粟粒性肺结核
4. 盆腔炎性包块
5. 卵巢恶性肿瘤
术后诊断
1. 残端宫颈平滑肌瘤(静脉内平滑肌瘤)
2. 肺良性转移性平滑肌瘤(PBML)
3. 右肺部结节切除术后
4. 次全子宫切除术史
诊疗思考
子宫肌瘤是女性生殖器官中最常见的良性肿瘤,较少发生转移。良性转移性平滑肌瘤(Benign metastasizing leiomyoma,BML)首次由Steine在1939年报道,BML的生物学行为倾向于恶性疾病,但病理细胞形态学显示为良性。BML可能发生子宫外转移,最常发生转移的部位是肺部。从病理上看,BML的肺部病变具有良性平滑肌瘤的组织形态学及免疫组化特征,并且大多表达雌孕激素受体,具有与子宫平滑肌瘤一样的激素依赖性,因此多认为该病是一种良性病变。
子宫肌瘤的肺部转移多出现在子宫平滑肌瘤剔除或子宫全切术后3个月到20年不等的时间内,平均时间为14.9年[1],肺部CT影像学检查多表现为双肺多发性结节影,其次还可以转移至淋巴结、深度软组织、中枢神经系统、肠系膜、骨骼和心脏等处[2-3]。
肺良性转移性平滑肌瘤(PBML)的临床发病率并不高,至今为止全世界仅报道200例左右,多为个案报道,好发于曾有过子宫肌瘤病史,尤其是有子宫肌瘤剔除或子宫切除病史的未绝经女性,少数可发生于妊娠期或绝经后女性[4],但也有文献报道少数病例并无子宫肌瘤手术史[5]。
PBML患者的临床表现主要与肿瘤的位置、数目以及大小有关,大多数患者可无临床症状,仅在检查时发现,部分患者可出现咳嗽、胸痛、呼吸困难等呼吸系统症状。因大部分病例没有明显不适症状,PBML主要靠影像学检查发现,该病的最终确诊仍依赖于病理和免疫组化检查。
目前PBML的诊断标准尚未统一,查阅相关文献,总结归纳一般需满足以下几个条件:(1)有子宫肌瘤病史,特别是有因子宫肌瘤行子宫切除术或子宫肌瘤剔除术手术史;(2)肺部CT扫描等影像学资料提示肺内结节或弥漫性病变;(3)可无任何症状,有症状可表现为咳嗽、咳痰、气促、咯血、胸闷等;(4)肺部病灶与子宫肌瘤的病理结果相似;(5)无恶性肿瘤病灶,排除肺部病灶由其他恶性肿瘤转移形成。
迄今为止,关于PBML的发病机制尚未明确,主要有以下几方面观点:(1)肿瘤来源于转移的良性子宫平滑肌瘤,可能是在子宫手术(包括宫腔诊刮术、清宫术、子宫肌瘤剥除术、子宫切除术等)时子宫肌瘤通过血行转移到肺部,进行单克隆生长,可能是由于手术增加了良性平滑肌瘤的蔓延、转移能力,造成其后播散的可能性[6-8];(2)来源于低度恶性的平滑肌肉瘤转移[9];(3)与血管平滑肌瘤变有关[10];(4)多个独立病灶的平滑肌增生性病变[11]。
因PBML发病率低,目前临床并无标准的治疗方案,病例报道均为个体化治疗,主要以外科手术和内分泌治疗为主,但因PBML病程进展缓慢且预后较好,也可选择密切随访观察。大多数文献报道,对可切除的病灶首选手术切除,组织病理检查有助于明确诊断,术后密切随访有无新发病灶。
多项研究证实BML表达雌激素受体、孕激素受体,是激素依赖性肿瘤,故可考虑行降低性激素水平治疗,尤其是控制雌激素水平,从而稳定肺内病变[11-13]。常用的内分泌治疗药物有促性腺激素释放激素类似物(GnRH-a)、选择性雌激素受体调节剂、芳香化酶抑制剂、孕激素拮抗剂等,案例报道中常选用GnRH-a单药或联合芳香化酶抑制剂及孕激素拮抗剂治疗。
根据患者情况,还可以进行卵巢切除治疗。内分泌治疗的效果存在个体差异性,有些病例的雌激素受体、孕激素受体强阳性表达,但治疗并无明显效果[14],因此也有抗雌激素治疗失败的案例报道。还有文献提到,绝经或妊娠可导致PBML患者体内激素水平变化,这两种状态可减慢肿瘤生长甚至使其停止生长[15]。
小结
PBML在临床上比较罕见。也许有人会问,子宫肌瘤细胞怎么能跑到肺里了?令人费解。确实,如果用医学专业术语表达,就是目前发病机理尚不明确。这种病发展过程缓慢,预后并不可怕。这里提醒临床医生,在平时的工作中遇到有子宫肌瘤病史的患者,特别是进行了子宫切除、子宫肌瘤剔除手术后,肺内出现多发结节、弥漫性病变的育龄期女性,应关注有子宫PBML的可能性。
大家知道,影像学检查如肺CT扫描,仍是诊断肺部病变的主要方法。根据文献记载,PBML患者主要表现为双肺实性结节、手术活检或切除肺部结节,结合病史,术后的病理及其免疫组化检查是诊断本病的重要依据。其主要治疗方法是尽可能完全地切除原发病灶,酌情切除转移病灶。若无法手术,可予对抗性激素治疗,同时注意密切随访,监测雌孕激素水平和肺内病灶变化,以提高患者的生活质量。
参考文献
[1] Galvin SD, Wademan B, Chu J, et al. Benign metastasizing leiomyoma: a rare metastatic lesion in the right ventricle [J]. Ann Thorac Surg 2010, 89(1): 279-281.
[2] Fan D, Yi X. Pulmonary benign metastasizing leiomyoma: a case report [J]. Int. J Clin Exp Pathol 2014, 7(10): 7072-7075.
[3] Goto T, Maeshima A,Akanabe K, et al. Benign metastasizing leiomyoma of the lung [J]. Ann Thorac Cardiovasc Surg 2012, 18(2): 121-124.
[4] Efared B, Atsame-Ebang G, Sani R, et al. Unexpected pulmonary tumor: metastasis from a benign uterine leiomyoma in a post-menopausal woman: a case report [J]. BMC Res Notes 2017, 10: 662.
[5] Moon H, Park SJ, Lee HB, et al. Pulmonary benign metastasizing leiomyoma in a postmenopausal woman [J]. Am J Med Sci 2009, 338(1): 72-74.
[6] Patton KT, Cheng L, Papavero V, et al. Benign metastasizding leiomyoma: clonality, telomere length and clinicopathologic analysis [J]. Mod Pathol 2006, 19(1): 130-140.
[7] di Scioscio V, Feraco P, Miglio L, et al. Benign metastasizing leiomyoma of the lung: PET findings [J]. J Thorac Imaging 2009, 24(1): 41-44.
[8] Tori M, Akamatsu H, Mizutani S, et al. Multiple benign metastasizing leiomyomas in the pelvic lymph nodes and biceps muscle: report of a case [J]. Surg Today 2008, 38(5): 432-435.
[9] Esteban JM, Allen WM, Schaerf RH, et al. Benign metastasizing leiomyoma of the uterus: histologic and immunohistochemical characterization of primary and metastatic lesions [J]. Arch Pathol Lab Med 1999, 123(10): 960-962.
[10] Nuovo GJ, Schmittgen, Benign TD. Metastasizing leiomyoma of the lung: clinicopathologic, immunohistochemical, and micro-RNA analyse [J]. Diagn Mol Pathol 2008, 17: 145.
[11] Ahmad SZ, Anupama R, Vijaykumar DK. Benign metastasizing leiomyoma - case report and review of literature [J]. Eur J Obstet Gynecol Reprod Biol 2011, 159(4): 240-241.
[12] Lewis EI, Chason RJ, De Cherney AH, et al. Novel hormone treatment of benign metastasizing leiomyoma: an analysis of five cases and literature review [J]. Fertil Steril 2013, 99: 2017.
[13] Arai T, Yasuda, Takaya T, et al. Natural decrease of benign metastasizding leiomyoma [J]. Chest 2000, 117(3): 921-922.
[14] Taveira-DaSilva AM, Alford CE, Levens ED, et al. Favorable response to antigonadal therapy for a benign metastasizing leiomyoma [J]. Obstet Gynecol 2012, 119(2): 438-442.
[15] 张国栋, 刘波, 于法常, 等. 肺良性转移性平滑肌瘤诊治[J]. 中华肿瘤防治杂志2014, 21(19): 1571-1574.

吴玉梅,主任医师、二级教授、博士生导师,首都医科大学附属北京妇产医院妇瘤科主任。
学术兼职:中华医学会妇科肿瘤分会委员、北京医学会妇科肿瘤学分会副主任委员、北京妇产学会外阴阴道疾病分会副主委、北京医学会肿瘤学分会委员、中国老年医学学会妇科分会会长。
擅长领域:致力于妇科肿瘤临床、科研和教学工作。
主要研究方向:宫颈癌放射敏感及放射抵抗机制、妊娠合并宫颈病变的筛查策略、妇科恶性肿瘤的预防。
科研成果:发表妇科肿瘤相关SCI论文30余篇,中文核心期刊论文100余篇;主持国家基金、省科技重点研发项目等多项,获省部级科技奖3项,国家发明专利1项。
个人荣誉:全国医德标兵、北京市先进工作者、北京市三八红旗奖章等。

何玥,医学博士,首都医科大学附属北京妇产医院妇瘤科副主任医师,在各类妇科肿瘤领域尤其是宫颈癌综合治疗方面有较丰富的临床经验并有深入的研究,曾于德国进修妇产科学;兼任北京医学会妇科肿瘤学分会青年委员、中国老年医学学会妇科分会青年委员、北京医学会外阴阴道疾病学会秘书。
第一作者发表SCI 文章9篇,累计IF达20分,发表核心期刊文章10余篇,参与编写翻译书籍3部。《Archives of Gynecology and Obstetrics》、《World Journal of Surgical Oncology》等多家国内外杂志审稿人。
近5年主持北京市教委、首都卫生发展专项、北京市医管局“青苗计划”、北京市优秀人才等宫颈癌相关科研课题6项;获得华夏医学科学技术奖二等奖(2019年排名第3),全国妇幼健康科学技术奖二等奖(2017年排名第4)、三等奖(2015年排名第3)各一项。

常虹,现就读于首都医科大学附属北京妇产医院,从师吴玉梅教授,研究方向妇科肿瘤学。
吴玉梅教授妇科肿瘤知名专家团队简介
首都医科大学附属北京妇产医院妇瘤科是国家重点科室,每年诊治妇科恶性肿瘤患者上千例,拥有北京市唯一的妇科肿瘤临床及组织样本库。是全国少数可进行手术、放疗、化疗、靶向及免疫等综合性治疗的科室。目前拥有多项国际及国家临床试验进行中。
吴玉梅教授从事妇科肿瘤临床工作30余年,致力于妇科肿瘤如宫颈癌、卵巢癌及子宫内膜癌等疑难杂症相关研究,擅长宫颈癌及癌前病变、子宫恶性肿瘤、卵巢良恶性肿瘤以及妊娠期合并妇科肿瘤的诊断及治疗,包括手术、放疗、化疗、内分泌治疗、靶向治疗及免疫治疗等;现兼任中华医学会妇科肿瘤分会委员、北京医学会妇科肿瘤学分会副主任委员、北京妇产学会外阴阴道疾病分会副主委、北京医学会肿瘤学分会委员、中国老年医学学会妇科分会会长等职务,国务院特贴专家;主持国家级、省部级等多项课题;出版专著2部,发表学术论文100余篇发表SCI 文章30余篇,多次获得妇幼健康科技成果奖和华夏医学科学技术奖;获得的个人荣誉包括全国医德标兵、北京市先进工作者、北京市三八红旗奖章等。
吴玉梅教授领衔的妇科肿瘤知名专家团队,成员有主任医师、副主任医师、主治医师、住院医师10余名,以及博士、硕士研究生20余名,致力于各种妇科肿瘤及疑难病例的临床、教学及科研工作。
 妇产科在线APP下载
妇产科在线APP下载













