50多年前,抗Rh(D)免疫球蛋白的临床应用,使全球范围内的Rh疾病下降了50%,但对于该病的预防仍有很大的提升空间,原因是人们对这种预防方法的重视程度较低。国际妇产科联盟(FIGO)、国际助产士联合会(ICM)和全球根除Rh疾病倡议回顾了目前关于抗Rh(D)免疫球蛋白的循证证据。考虑到抗Rh(D)的有效性,新的指南建议调整不同适应症的剂量,并按适应症区分用药。
一、背景
1968年,抗Rh(D)免疫球蛋白被批准用于Rh阴性妇女,以防止分娩后对Rh(D)血型抗原致敏。随后,这一方法被扩展到妊娠期间进行抗Rh(D)预防,以防止妊娠晚期致敏,以及在流产、宫外孕、羊膜穿刺术、妊娠期出血或腹部创伤和/或外倒转情况下进行抗-D预防。最近几年在一些国家,妊娠早期通过鉴定母体血中胎儿Rh基因型,如果胎儿可能为Rh(D)阴性时,不需要进行免疫球蛋白管理。
抗D预防效果非常有效,在大多数高收入国家,Rh疾病已经或多或少地被消灭。然而,最新数据表明,在全世界约50%符合条件的病例中,没有使用抗Rh(D)免疫球蛋白。原因各不相同,包括供应不足、成本考虑、忽视(如忘记使用抗Rh-D)、缺乏获取途径等。据估计,每年仍有超过16万例因Rh疾病导致围产期死亡和10万例残疾,与临床批准使用免疫球蛋白前相比,仅减少了50%。此类可预防疾病仍然带来如此高的负担是非常遗憾和不可接受的。
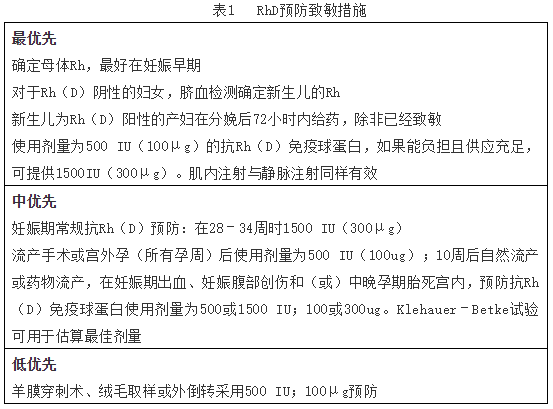
本文目的是通过总结免疫预防Rh疾病数据,提供考虑不同剂量方案成本效益的指南,根据不同指征采用不同的抗Rh(D)管理。(表1)
二、血型和RH(D)血型
确定母体RhD状态是预防RH(D)致敏的先决条件。尽管这一点得到了广泛的认同,但在许多资源匮乏地区仍然未能完全做到。Rh(D)可通过在当地医疗机构采集静脉或毛细血管血样,并使用经典血清学测定。Rh(D)最好在早孕期确定,因为抗D指征也可能会在早孕期出现,如,流产或宫外孕。
三、产后抗-RH(D)免疫球蛋白管理
RH(D)阴性女性中约有16%发生致敏。产后使用抗Rh(D)免疫球蛋白可将该风险降低至约1.5%,这是对于再次妊娠可能出现Rh疾病最有效的干预措施。当Rh(D)阴性产妇分娩Rh(D)阳性新生儿后,在分娩后72小时内肌注抗Rh(D)1500IU(相当于300μg)。能中和30毫升Rh(D)阳性胎儿全血。根据一项研究,分娩时胎母输血量中位数约为0.7毫升,只有大约1%的病例超过10毫升。因此,有人建议抗Rh(D)剂量为500IU(100μg)就足够了。尽管最近的一项荟萃分析表明1500 IU方案的疗效稍好,但尚不确定更高剂量的有效性如何。
在一些国家,要求剖宫产分娩后给予双倍剂量的抗Rh(D),然而,这似乎没有必要,因为来自捷克的一项大型研究的数据显示,剖宫产术后的胎母输血量并没有增加。在不确定的情况下,可进行Kleihauer-Betke试验来估计胎母实际输血量。在其他不确定胎母输血(如宫内胎儿死亡)的情况下,采用1500IU预防也是合理的。Kleihauer–Betke试验中,通过计算母体血液涂片中胎儿红细胞的数量来计算母体循环中胎儿红细胞的百分比:胎儿红细胞/母体红细胞%×50=母体循环中的胎儿全血量(mL)。
四、抗RH(D)免疫球蛋白在妊娠期的应用
大多数RH(D)致敏发生在分娩过程中。对两项抗D预防妊娠期胎母输血致敏的随机对照试验荟萃分析发现可降低42%的致敏事件发生,另外一项对10项研究数据进行的“偏倚校正”荟萃分析估计致敏降低69%。因此,产前给药似乎可以进一步降低致敏,从产后抗Rh(D)免疫球蛋白获得的大约1.5%致敏率进一步下降至大约0.5%。
产前抗Rh(D)免疫球蛋白可以肌肉注射或静脉注射,效果没有明显差别。可在28-34周(1500 IU)时给予一次,或在28周和32-34周时使用两次(625 IU或1500 IU)。最近的两项荟萃分析和另一项随机对照试验显示,单次使用1500 IU在分娩时可检测到的血液循环中抗Rh(D)比例最低,提示该剂量为妊娠期间预防致敏的最佳剂量。
五、流产
10周前自然流产致敏可能性极低;然而,数据很少。根据NICE指导委员会的临床研究,建议仅对10 0/7孕周后的自然或药物流产进行预防。此外,对于流产手术的,即使10周前也需要考虑预防。鉴于妊娠早期胎儿血容量较低,尽管没有数据支持,也可使用500IU剂量的抗Rh(D)免疫球蛋白。
对于完全性葡萄胎,器官分化未出现,因此,不应发生针对Rh(D)的致敏。然而,对于部分性葡萄胎,器官分化可能出现,一般建议使用抗Rh(D)免疫球蛋白。
六、宫外孕
在Rh(D)阴性妇女中,输卵管妊娠破裂Rh(D)出现同种免疫的发生率为24%。因此,对于宫外孕患者应严格建议使用抗Rh(D)免疫球蛋白。由于妊娠早期胎儿血容量低,抗Rh(D)所需剂量可能较低。
七、绒毛取样或羊膜穿刺术
多数国家提倡对Rh(D)阴性孕妇在绒毛取样或羊膜穿刺术后给予抗Rh(D)免疫球蛋白,尽管这项建议是基于有限的科学证据。相比之下,在丹麦,这种情况下不提供免疫预防,因为接受侵入性检查和无侵入性检查的孕妇之间,在29周时的发生同种免疫的几率没有差异(需要900例来防止一例)。
八、妊娠期出血和腹部创伤
腹部创伤可能会导致胎母输血,进而可导致Rh(D)同种免疫。虽然确切风险尚不清楚,但建议使用抗Rh(D)免疫球蛋白作为预防措施。中晚孕期发生的产前出血也是如此。抗Rh(D)免疫球蛋白的最佳剂量尚不清楚(最常用的是1500 IU)。
九、胎死宫内
由于胎死宫内可能由胎母大量出血导致,因此进行Kleihauer-Betke试验可能是有用的,这既是对胎儿死亡查找原因的一部分,也是对Rh(D)阴性女性管理的一部分,确定胎儿-母体出血量,计算抗Rh(D)免疫球蛋白剂量。
十、臀位外翻转
术中胎母输血的风险在2%到6%之间;因此,建议使用抗Rh(D)免疫球蛋白,但出血量通常较低。根据加拿大的一项大型研究得出的结论,在约32周产前常规应用抗Rh(D)免疫球蛋白应足以防止随后的外倒转术中致敏。
十一、孕早期无创胎儿Rh(D)分型
孕早期采用NIPT可以确定胎儿的Rh(D)状态。最近,丹麦、荷兰和英国等已将这一措施引入临床实践。最近一项对60000名参与者进行的荟萃分析表明,与直接检测新生儿相比,该措施具有非常高的敏感性(99.9%;95%CI,99.5%–100%)和特异性(99.2%;95%CI,89.5%–99.5%)。因此,妊娠早期非侵入性Rh(D)分型可用于减少在妊娠过程中不必要的抗Rh(D)免疫球蛋白的使用。尽管基于风险人群NIPT筛查Rh状态的方法,目前可能并不具有成本效益,卫生政策制定者应将这种无创性检查作为未来防治Rh疾病的一种选择。
十二、抗Rh(D)免疫球蛋白的剂量
对于抗Rh(D)的最佳剂量尚不确定。产后,1500IU可能略好于500IU,但财政限制可能会促使使用较低剂量。在妊娠早期,胎儿-母体出血量必然较低;因此,500 IU通常应足够。妊娠晚期预防,最好在28周至34周之间给予1500 IU。目前还不确定母体阴道出血、腹部创伤或胎死宫内的免疫球蛋白最佳剂量。但是,Kleihauer–Betke试验非常有用,为腹部创伤或胎儿死亡提供剂量指导。
十三、预防RH(D)致敏措施
表1总结了预防RH(D)致敏的措施,考虑到不同剂量方案的成本效益,并按适应症优先使用抗RH(D)。当研究抗Rh(D)的每年使用剂量与所需剂量之间的差距时,可以得出结论,优先考虑预防的多为高收入国家,其他国家,如巴西、捷克、克罗地亚、希腊、匈牙利、伊朗、立陶宛、马来西亚、沙特阿拉伯、斯里兰卡、韩国、泰国、土耳其和乌拉圭等,还有很长的路要走。
 妇产科在线APP下载
妇产科在线APP下载













