子宫内膜息肉属于妇科发生率较高的疾病,为子宫内膜局部过度增生而引发的疾病,突出于子宫腔内(单个/多个)光滑肿物,蒂长短不同[1]。育龄期~绝经后女性均可发生子宫内膜息肉,主要症状:不规则阴道流血、腹痛、白带异常、不孕等。发病原因和较多因素存在联系,如内分泌、炎症、肥胖、高血压等[2]。选择2015年1月至2018年1月本院收治的200例子宫内膜息肉患者作为研究对象,评价分别经宫腔镜下子宫内膜息肉切除术联合孕激素治疗、宫腔镜下单纯息肉电切术治疗的临床价值。
1资料与方法
1.1 临床资料 根据子宫内膜息肉患者入院尾号奇偶数,将本院2015年1月至2018年1月收治的200例患者,分为A组与B组,各100例。A组年龄23~46岁,平均年龄(34.5±3.3)岁。B组年龄22~46岁,平均年龄(34.3±3.1)岁。两组临床资料比较差异无统计学意义,具有可比性。
纳入标准:接受宫腔镜检查确诊者[3];符合医院伦理委员会审核批准者[4];签署知情同意书者。排除标准:凝血功能障碍者;急性生殖道感染者;盆腔粘连者。
1.2 方法 术前两组均接受常规检查,并做好肠道清洁工作,手术前1晚实行阴道准备。手术前一晚给予400μg米索前列醇(浙江仙琚制药股份有限公司,国药准字H20084598;规格:0.2mg)阴道后穹窿上药,旨在软化宫颈、扩张宫颈。手术当日清晨禁食,导尿。
1.2.1 B组通过宫腔镜下子宫内膜息肉电切术治疗,然后,在静脉复吸全麻下取患者的截石位,宫颈扩张到10mm,采用浓度为5%的葡萄糖液膨宫,膨宫设备设置为80mmHg。这时可放置电切镜,和电视录像转播系统保持连接的状态,在电视屏幕的监视下进行手术操作,重点对患者宫腔、子宫内膜息肉根蒂部位实行观察,予以单级电极电切、电凝处理。切割电极功率、凝固电极功率分别为:80W、50W,电切割的速度为1cm/s。推动扳机后,电切环渗出镜鞘,于宫壁施加压力,切割的深度为5mm,同时实行脚踏电切开关、放松扳机处理作。息肉切除后嵌顿于电切环、镜鞘间,可与电切镜一起取出。手术后进行常规的抗感染治疗,术后3个月叮嘱患者接受宫腔镜复查。
1.2.2 A组通过宫腔镜下子宫内膜息肉切除术联合孕激素方案治疗,取患者膀胱截石位,消毒铺巾、导尿处理,在超声设备直视下实行手术治疗。借助宫腔钳的作用钳夹宫颈前唇,再放置宫腔电切镜检查患者的宫颈情况。视野清楚的状态下,对患者子宫内膜息肉、底部加以观察,以此明确息肉的具体数目、大小,以及形态和部位等状况。经环形电极切除息肉基底部,深入蒂根下3cm浅肌层,切割的功率为80W,电凝功率为50W。这时需结合患者内膜息肉具体情况,将该位置四周内膜组织切除,手术后采用孕激素辅助治疗(黄体酮或者地屈孕酮片口服)术后3个月叮嘱患者接受宫腔镜复查,监测子宫内膜息肉复发率。
1.3 观察指标 观察两组治疗后经量、子宫内膜厚度、 复发率。
1.4 统计学方法 采用SPSS24.0统计学软件进行数据分析,计量资料采用“x±s”表示,行t检验,计数资料采用率(%)表示,c²检验,以P<0.05为差异有统计学意义。
2 结果
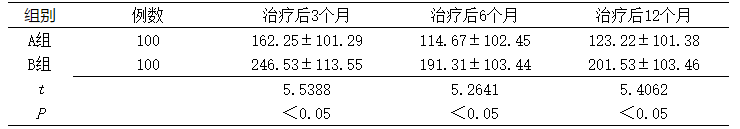
2.1 两组治疗后经量比较 治疗后不同时间两组经量比较,差异均具有统计学的意义(P<0.05),见表1。
表1 两组治疗后经量比较(±s,L)
Table 1 Comparison of menstrual volume between the two groups after treatment
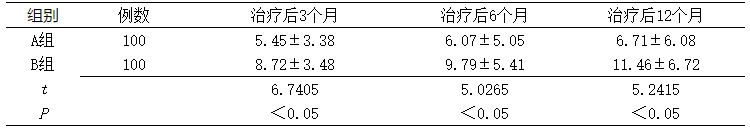
2.2 两组治疗后子宫内膜厚度比较 治疗后不同时间两组子宫内膜厚度比较,差异具有统计学意义(P<0.05),见表2。
表 两组治疗后子宫内膜厚度比较(±s)
Table 2 Comparison of endometrial thickness between two groups after treatment
2.3 两组复发率比较 随访12个月,A组复发率为9%(9/100),B组复发率为25%(25/100),比较差异有统计学意义(c²=9.0716,P<0.05)。
3 讨论
子宫内膜息肉为临床中发生率较高的疾病,为子宫内膜基底层产生局限性增生,经致密纤维结缔组织构成间质、厚壁血管,以及子宫内膜纤体等组成。通过宫腔镜下子宫内膜息肉电切术联合孕激素补充治疗,可在宫腔镜下进行宫腔内手术,实现不开腹、无切口效果,而且对患者机体的创伤较小[5]。而在宫腔镜下进行子宫内膜息肉切除术,可在宫腔镜引导下操作将肌肉组织切除,不需进行开腹且能清楚的观察到病灶情况,准确定位病灶具体位置,对于子宫内膜、卵巢功能的影响较小,而且能保留患者的生育功能,满足患者实际生育的需求[6-8]。同时应用宫腔镜利于临床医师明确患者子宫内膜息肉的具体位置、数量、大小等状况,刮取适量子宫内膜送检,从而能客观评判子宫内膜息肉的性质。在宫腔镜下进行手术治疗时,对于正常子宫内膜不会构成伤害,可保证操作的安全性,防止发生恶性病变漏误诊的现象[9]。注意事项:手术后采用孕激素类药物治疗非常必要,可在手术后使用抑制雌激素分泌药物,主要目的:预防子宫内膜息肉复发。本研究结果显示,A组治疗后3、6、12个月的经量,均明显低于B组,差异具有统计学意义(P<0.05)。A组在上述治疗后不同时间子宫内膜厚度方面,均显著小于B组,复发率少于B组,组间比较差异有统计学意义(P<0.05)。可见,在子宫内膜息肉患者的治疗中,应用宫腔镜子宫内膜切除术联合孕激素方案的效果较好,尤其是术后孕激素的补充治疗,明显可以降低患者治疗后不同时间的经量,减小患者治疗后不同时间子宫内膜厚度。
综上所述,采取宫腔镜下子宫内膜息肉切除术联合孕激素方案对子宫内膜息肉患者治疗,在改善患者经量、子宫内膜厚度,以及降低复发率方面,均有积极的影响。
参考文献
[1] 李立丽,蒋维,韩炜.左炔诺孕酮宫内缓释系统联合子宫内膜息肉切除术治疗子宫内膜息肉的效果评价[J].中国性科学,2017,26(5):46-49.
[2] 杨新慧,张蓓.腔镜电切除子宫内膜息肉术后孕激素补充治疗的效果评价[J].实用妇科内分泌杂志,2017,4(20):38-39.
[3] 申静.宫腔镜手术联合孕激素治疗子宫内膜息肉患者的临床效果[J].医疗装备,2017,30(19):20-21.
[4] 李玉梅,刘琼,史锦燕,等.左炔诺孕酮宫内缓释系统联合宫腔镜子宫内膜息肉切除术对子宫内膜息肉患者术后血管内皮生长因子、γ-干扰素水平的影响[J].中国临床实用医学,2017,8(6):80-82.
[5] 韩正枝.孕激素辅助宫腔镜子宫内膜息肉切除术治疗子宫内膜息肉的临床疗效及对子宫内膜血管内皮生长因子表达的影响[J].贵州医药,2017,41(3):294-296.
[6] 蒋婴,钱旭武,张宜群.化瘀散结法对子宫内膜息肉患者雌孕激素及其受体表达的影响[J].中华全科医学,2017,15(7):1188-1191.
[7] 周愦珍.宫腔镜子宫内膜息肉切除术联合内美通治疗子宫内膜息肉的效果评价[J].国际医药卫生导报,2017,23(10):1554-1556.
[8] 段金提,李萍.宫腔镜子宫内膜息肉切除术治疗子宫内膜息肉的效果分析[J].实用妇科内分泌杂志,2017,4(12):30-30.
[9] 张蓉,马如霞,冯洁.宫腔镜下子宫内膜息肉切除术联合孕激素治疗子宫内膜息肉效果分析[J].临床和实验医学杂志,2018,17(10):1083-1085.
 妇产科在线APP下载
妇产科在线APP下载












