
一、PTS与RSA患者不良结局的相关性
1.PTS的定义及分类
定义:血栓前状态(PTS)是指多种因素引起的凝血、抗凝和纤溶系统功能失调或障碍的一种病理过程,有易导致血栓形成的多种血液学改变。
分类:根据发病原因,PTS可分为遗传性和获得性两类。
(1)遗传性PTS指所有先天性抗凝血因子或纤溶活性缺陷而导致易于血栓形成的一类疾病。包括抗凝蛋白(蛋白C、蛋白S、抗凝血酶Ⅲ)缺陷症、凝血因子V Leiden突变、遗传性高同型半胱氨酸血症(HHCY)、凝血酶原基因突变等。
(2)获得性PTS和复发性流产(RSA)关系更为密切,有抗磷脂综合征(APS)、获得性高同型半胱氨酸血症以及机体存在各种引起血液高凝状态的疾病等。但其中最常见的是由抗磷脂抗体(APL)引起的抗磷脂综合征(APS)。
2.PTS导致RSA的发病机制
PTS严重者可发生全身血管血栓形成,导致器官功能障碍,如发生在妊娠期则导致子宫螺旋动脉或绒毛血管微血栓形成,甚至形成多发性胎盘梗死灶,导致子宫-胎盘循环血流灌注不良,增加RSA和胎死宫内的危险。PTS导致RSA的证据等级为Ⅰ级。
PTS引起自然流产的发病机制可能是血栓前高凝状态引起子宫胎盘部位血流状态改变,进而造成局部微血栓,甚至胎盘梗死使胎盘血供下降,胚胎或胎儿缺血缺氧,最终结局就是胚胎或胎儿发育不良而流产。
(1)PTS显著增加RSA风险
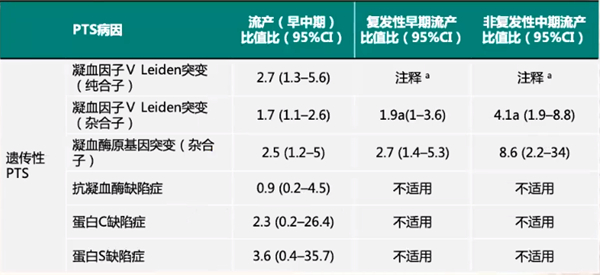
遗传性PTS主要有凝血因子V Leiden突变、凝血酶原基因突变等类型。首先,凝血因子V Leiden无论是纯合子突变还是杂合子突变,与流产风险均有高相关性,尤其纯合子突变;其次,凝血酶原基因突变与早中期以及复发性早期流产,尤其与非复发性中期流产具有高相关性。而抗凝血酶缺陷症和早中期以及复发性流产等相关性不高。蛋白C和蛋白S缺陷症主要和早中期流产相关性高,但和复发性流产无较大相关性,如表1所示。
(2)PTS与流产及其他妊娠期并发症/不良妊娠结局的关系
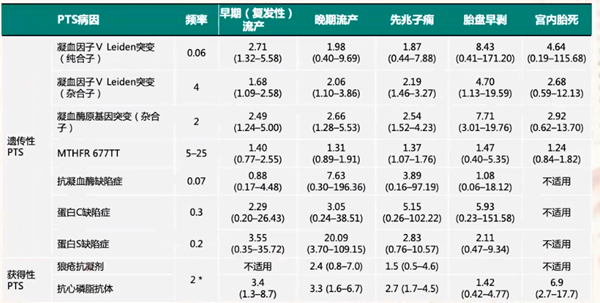
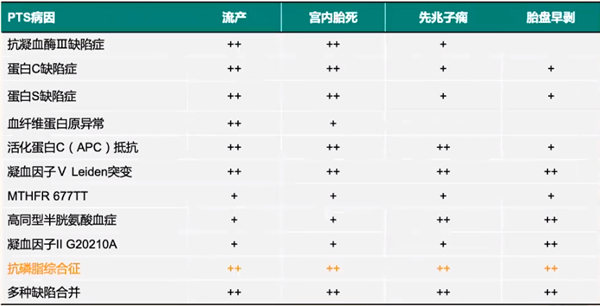
如表2所示,遗传性PTS除了与流产有相关性,和其他妊娠并发症也有一定联系,比如先兆子痫、胎盘早剥以及宫内胎死等。而获得性PTS,尤其抗心磷脂抗体阳性和各阶段流产以及妊娠并发症都有相关性。同样,如表3所示,PTS病因和流产以及不良妊娠结局都有一定相关性,尤其获得性PTS,也就是抗磷脂综合征和流产、宫内胎死、先兆子痫、胎盘早剥都表现出明显相关性,所以临床上一定要重视获得性PTS。
二、遗传性PTS的RSA患者诊断、检测以及抗凝治疗
1.PTS对RSA的诊断有重要价值
血栓前状态是早期复发性流产、晚期复发性流产尤其胚胎停止发育或胎死宫内的主要原因之一。临床上尤其要注意12周后胎死宫内,但胎儿染色体无异常,此时需要重视是否存在PTS。
2.遗传性PTS检测的方法
(1)2018版《ACOG妊娠期遗传性易栓症指南》推荐的检测方法如下表4所示:
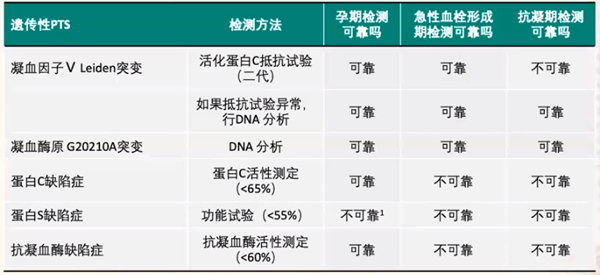
基于各指南的综合推荐,由于目前检测方法的准确性问题以及检测对治疗无较大帮助,所以对于RSA或妊娠并发症晚期患者,除临床试验外无需行遗传性PTS检测,即使发现遗传性血栓形成性缺陷,血栓形成性标志物的存在通常也不能表明在妊娠期间需要进行其他治疗。但对一些复发性流产患者无明确致病原因情况下,还是建议进行遗传性PTS检测,也许能够发现异常,以便给予相应治疗,这对总结临床诊疗经验具有较大帮助。

(2)中国共识关于合并PTS的RSA患者的诊断和检测推荐
根据2016版《复发性流产诊治的专家共识》,存在PTS的患者没有明显的临床表现,其血液学检查也没有明确的诊断标准,指南推荐常用于检测PTS的指标包括:
·凝血相关检查(凝血相关检查对胎盘绒毛微血栓引起的凝血功能异常检测存在局限性):凝血酶时间(TT)、活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、纤维蛋白原及D-二聚体。
·相关自身抗体:抗心磷脂抗体(ACA)、抗β2糖蛋白1(β2GP1)抗体、狼疮抗凝物(LA)。
·同型半胱氨酸(Hcy)。
·有条件的医疗机构还可以进行蛋白C、蛋白S、Ⅻ因子、抗凝血酶Ⅲ等血栓前状态标志物的检测。
(3)合并PTS的RSA未孕患者D-二聚体水平检测
D-Dimer(D-二聚体)是交联纤维蛋白(Fb)特异的降解产物,它的生成或增高反映了凝血和纤维系统的激活,可作为体内高凝状态和纤溶亢进的分子标志物之一。因此,D-二聚体水平越高,RSA的可能性越大,所以D-二聚体可用于筛查RAS未孕患者是否存在PTS,最佳筛查界值为233.50ug/L(AUC=0.636)。
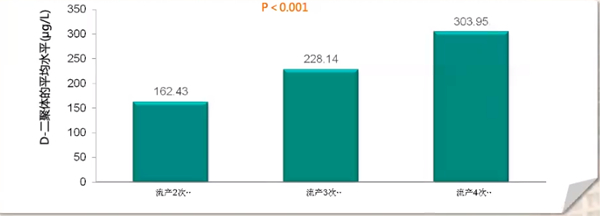
2010年7月,发表在中山大学学报(医学科学版)的《血栓前状态标志物F1+2、TAT、AT-Ⅲ、D-Dimer对早期复发性流产的预测价值》研究纳入103例早期RSA未孕患者和103例早期RSA早孕患者,以往自然流产次数2-6次,随着流产次数增多,血液中D-二聚体水平升高,3组差异有统计学意义(P<0.0167)(如上图所示)。但临床上由于D-二聚体的影响因子很多,仅依据D-二聚体判断PTS是不充分的,如果复发性流产无明显原因,可注意D-二聚体变化。
3.合并PTS的RSA患者首选LMWH(低分子肝素)治疗
根据《低分子肝素防治自然流产中国专家共识(2018)》,推荐合并PTS的RSA患者首选LMWH治疗,给药方案如下:
·无VTE(静脉血栓栓塞症)或近期无VTE表现:建议给予预防剂量LMWH(比如法安明1次/日),从确诊妊娠开始,持续整个孕期(分娩前24-48h停药),分娩后12-24h继续给药至少产后2周;
·有VTE史或有VTE家族史:建议继续治疗剂量LMWH(比如法安明2次/日),从确诊妊娠开始(从备孕前开始更佳)用药,持续整个孕期(分娩前24-48h停药),分娩后12-24h继续给药至少至产后6周;
·近期有VTE表现但未妊娠:建议血管外科、心胸外科等相关学科治疗,治愈后6个月方可再次妊娠;
·妊娠期间发生VTE:建议使用治疗剂量的LMWH,并根据血栓形成部位与血管外科、心胸外科等相关学科共同管理,给药至少至产后6-12周或更长时间(根据血栓情况决定)。注意产后和外科共同管理,决定用药时长。
·无VTE史或近期无VTE表现,但妊娠期间血浆D-二聚体水平明显增加:可根据D-二聚体适当调整LMWH的使用剂量。
(1)LMWH显著降低患者D-二聚体水平
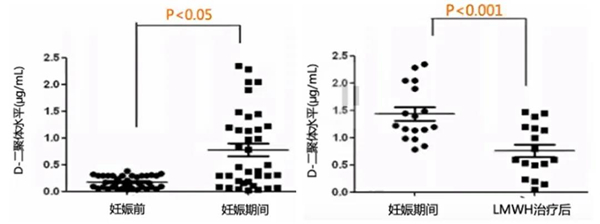
一项前瞻性观察研究纳入2011年3月至2014年3月期间在上海仁济医院的RSA(≥2次既往自然流产)患者作为观察组,无RSA病史的患者作为对照组,原因不明的RSA和血小板聚集增加的患者接受小剂量阿司匹林,而D-二聚体升高(>0.75ug/mL)的患者接受LMWH,在妊娠期间监测D-二聚体水平。
研究结果显示,不明原因复发性流产患者妊娠后的D-二聚体水平明显高于妊娠前,但D-二聚体升高的患者使用LMWH后,D-二聚体水平从1.4ug/mL降低到0.76ug/mL。所以研究表明孕期D-二聚体水平明显升高,LMWH治疗有效。
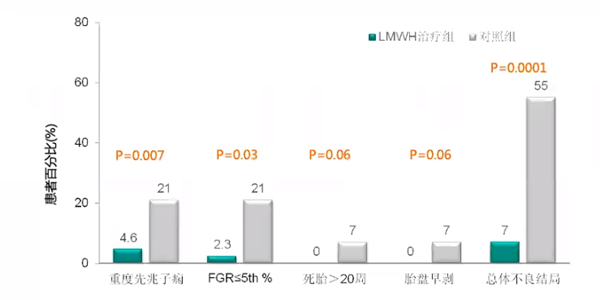
(2)LMWH显著降低遗传性PTS患者妊娠并发症的复发
一项回顾性研究纳入116例凝血因子V Leiden或因子Ⅱ基因突变,或蛋白S或蛋白C缺陷症患者,既往重度先兆子痫或FGR≤5%,或重度胎盘早剥或死胎>20周史。随机分为2组:研究组87例患者妊娠第5-15周给予LMWH治疗,对照组29例患者无治疗。
研究结果显示,经过LMWH治疗,PTS患者重度先兆子痫、FGR发生率均显著降低,总体不良妊娠结局从55%降低至7%。
(3)LMWH显著改善传统和新型遗传性PTS患者妊娠结局
一项研究纳入50例有遗传性血栓形成倾向以及既往有过不良妊娠结局的患者(包括早产、胎儿生长受限、先兆子痫、子宫内胎儿死亡、胎盘早剥和深静脉血栓形成),将入组人群分为传统PTS组(N=26例)和新型PTS组(N=24例),传统PTS指原先发现的PTS状态,包括FVL突变、凝血酶原G20210A的突变和抗凝血酶、蛋白S、蛋白C的缺乏。新型PTS包括亚甲基四氢叶酸还原酶、纤维酶原激活物抑制剂-1和血管紧张素转化酶多态性。研究结果表明LMWH显著改善传统和新型遗传性PTS患者妊娠结局,包括胎死宫内、胎儿生长受限等。

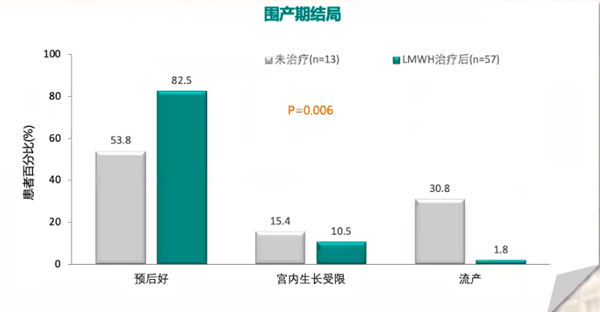
(4)LMWH改善合并PTS的RSA患者的围产期结局
一项回顾性研究纳入70例有遗传性血栓形成倾向患者,将研究人群分为LMWH治疗组(N=57例)和未接收治疗组(N=13例)。研究结果显示,未接受治疗组和治疗组相比,预后好的患者从53.8%提高至82.5%、宫内生长受限发生率从15.4%降低至10.5%、流产发生率从30.8%降低至1.8%,研究表明与未接受治疗相比,进行LMWH治疗的有遗传性血栓形成倾向患者在围产期的结局显著更好。
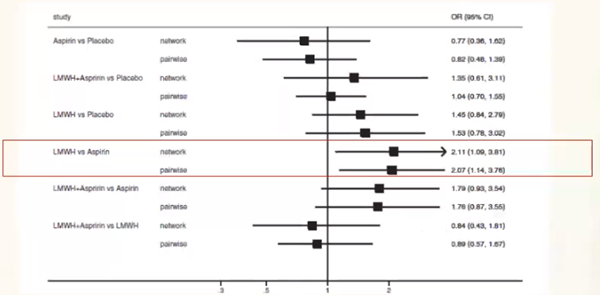
(5)LMWH提高RSA患者的活产率显著优于阿司匹林(2倍以上)
一项荟萃分析共纳入19个试验,涉及2391例有或无PTS的患者,包含543例APS患者。低分子肝素、肝素、阿司匹林改善RSA患者的活产率结果发现,相比阿司匹林,低分子肝素治疗的活产率显著提高,网络结果显示提高2.11倍,配对结果显示提高2.07倍。所以,遗传性PTS患者单纯用低分子肝素比阿司匹林更有优势。
三、获得性PTS的RSA患者抗凝治疗
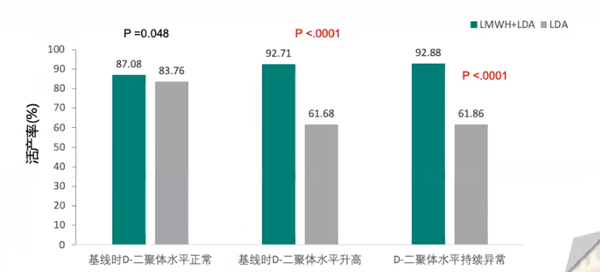
1.基线时D-二聚体水平升高以及持续异常的伴APS的RSA患者,LMWH+LDA的活产率显著高于单药LDA
一项单中心医院接受治疗的1096例RPL伴APS患者,随机分为两组,A组每天接受75mg LDA,B组每天75mg LDA+LMWH皮下注射4100u,评估两组血浆D-二聚体水平和活产率。
结果显示,对于基线D-二聚体水平升高的APS妇女,LDA+LMWH组的活产率高于LDA单独组(92.71%vs61.68%,P<0.0001);但两组正常D-二聚体水平的妇女之间没有发现显著差异(87.08%vs83.76%,P = 0.48)。在所有采血点检测D-二聚体水平均正常的妇女与D-二聚体持续异常或治疗后仍增加的患者相比具有最高的活产率(92.88%,P<0.001)。所以研究表明LDA和LMWH联合治疗并不是对所有APS妇女都是必要的,但已证明对D-二聚体水平升高的妇女是有益的。
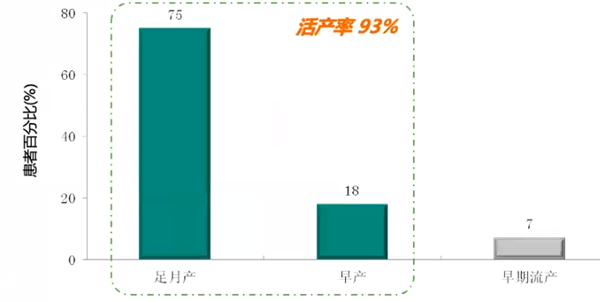
2.LMWH+LDA治疗合并APS的RSA患者,活产率达93%
一项回顾性研究纳入60例合并APS的RSA患者,从孕6-8周确定宫内妊娠开始给予皮下注射LMWH 40mg qd,同时口服阿司匹林75mg qd治疗,直至妊娠35-37周。研究结果显示,LMWH+LDA治疗合并APS的RSA患者,活产率达93%。其中75%患者足月产、18%早产、7%患者出现早期流产,无大出血并发症。
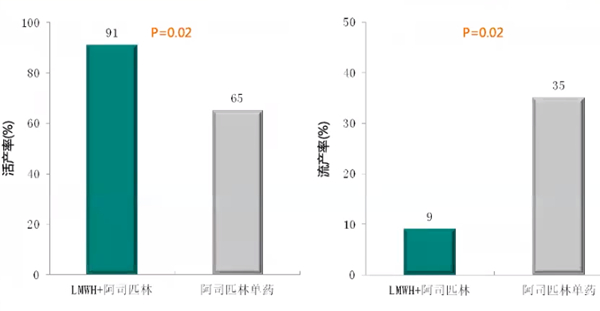
3.与小剂量阿司匹林单药治疗相比,LMWH+LDA治疗合并APS的RSA患者时活产率更高、流产率更低、胎儿出生体重更优、先兆子痫发生率更低
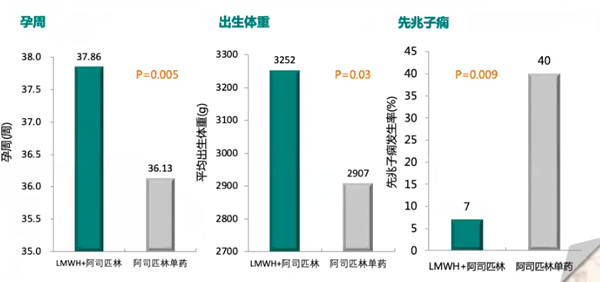
一项前瞻性、非随机研究纳入70例合并APS的RSA患者,随机分为小剂量阿司匹林单药组(N=23,口服81 mg/d)和LMWH+LDA组(N=47,LMWH 40 mg/d+阿司匹林81 mg/d),研究结果显示,合并APS的RSA患者LMWH+LDA治疗活产率显著高于阿司匹林单药(91% vs 65%),流产率更低(9% vs 35%)、孕周更高(37.86% vs 36.13%)、出生体重更优(3252g vs 2907g)、先兆子痫发生率更低(7% vs 40%)。尽管相关报道说法不一,但个人认为合并典型APS的RSA患者最好使用LMWH+LDA联合治疗;若非典型非标准APS的RSA患者,可以阿司匹林单药治疗或LMWH+LDA联合治疗,若是遗传性血栓前状态,单用LMWH即可。
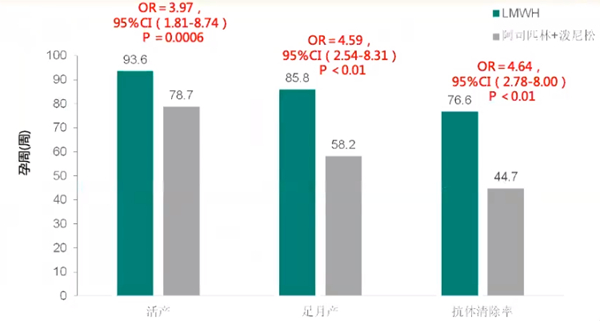
4.LMWH改善APS患者妊娠结局与清除抗体的功能均显著优于阿司匹林+波尼松
一项低分子肝素对复发性流产伴抗磷脂抗体阳性孕妇治疗的Mete分析共纳入282例患者,其中LMWH(试验组)141例,阿司匹林联合波尼松(对照组)141例。结果显示,试验组活产率、足月产率以及抗体清除率都显著高于对照组。
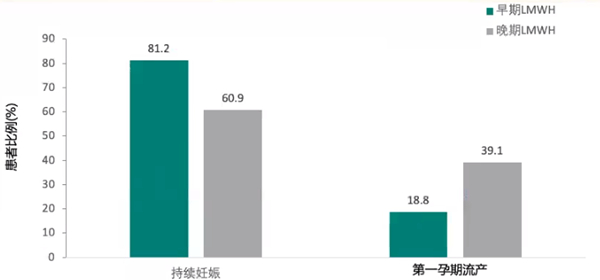
5.早期使用LMWH治疗合并APS的RSA患者,持续妊娠的患者比例高,早期妊娠流产的患者比例低
一项随机对照研究纳入286例产科APS妇女,根据妊娠试验阳性的记录,将所有参与者随机分为两组,最终纳入数据分析有94例,分为两组,早期LMWH治疗组(在妊娠的第五周,N=48例),晚期LMWH治疗组(在妊娠的第七周,N=46例),两组皮下注射LMWH(依诺肝素)的剂量均为40mg/天,治疗一直持续到妊娠结束。主要结局指标是持续妊娠率,次要结局指标包括胎儿流失、活产率、妊娠34周前的早产、宫内生长受限和先天性胎儿畸形发生率。结局表明,低分子肝素治疗对合并APS的RSA患者是有效且显著的。
6.高危APS妇女妊娠期间使用阿司匹林和/或LMWH均未增加出血的风险,安全性好
一项国际性多中心研究纳入两个患者队列,分别是回顾性法国队列和前瞻性美国队列(PROMISSE研究),共204例患者,总计264次妊娠史(血栓形成史46%,系统性红斑狼疮23%)。对于单纯产科APS,用阿司匹林和/或预防性剂量LMWH;对于血栓形成史患者,用阿司匹林和/或治疗剂量LMWH。结果显示,轻微阴道出血事件发生率很低,且LMWH和阿司匹林单独或者联合治疗出血风险都很低,即便在给药与分娩之间间隔很短情况下。

总之,APS是一种以反复病态妊娠和/或动脉或静脉血栓形成为主要表现的疾病,病因机制复杂,可引起多种不良妊娠结局。典型的APS患者主要内外科多见,以动静脉栓塞为主,抗体滴度较高。但生殖和产科多见非典型APS病例,也就是生殖和产科APS患者发生动静脉栓塞较少,主要发生胎盘微血栓,低滴度抗磷脂抗体阳性较多,中高滴度阳性相对较少,那以内外科标准诊断容易出现漏诊,所以近年来国外专家提出非标准或产科APS概念,国内专家也在编写相关共识,也就是说我们要注意产科APS的特殊表现。
伴有APS的RSA核心治疗是抗凝和抗血小板治疗,LMWH用于APS的妊娠期患者,能够改善其妊娠相关不良结局,提高活产率。但APS分为原发和继发性,两者治疗方式不太一同。原发性APS就是抗磷脂抗体阳性,出现复发性流产,但没有合并风湿免疫等其他疾病,这类患者只需抗凝治疗,不过要注意,对于原发性APS,如果抗体滴度较高或者多个抗体阳性或经过标准抗凝治疗,患者仍然出现胚胎丢失,抗凝治疗同时必须加用免疫抑制剂。继发性APS除了抗磷脂抗体阳性,出现复发性流产之外,还合并风湿免疫等疾病,尤其红斑狼疮等,这些患者的治疗除了用抗凝治疗,还要加用免疫抑制剂。
综上所述,PTS会引起凝血功能异常增高和纤溶功能的降低形成高凝状态,最终导致胚胎发育不良或流产,但合理应用低分子肝素和阿司匹林等抗凝药物能有效改善此类患者的母胎结局,在复发性流产治疗中发挥重要作用。
参考文献:
·低分子肝素防治自然流产中国专家共识编写组.中华生殖与避孕杂志.2018;38(9):701-708.
·中华医学会妇产科学分会产科学组.中华妇产科杂志,2016;51(1):3-9.
·王曌华等.中国实用妇科与产科杂志.2013;29(2):102-106.
·Simcox LE et al.Int J Mol Sci.2015 Nov 30;16(12):28418-28.
·Arachchillage DRJ et al.Semin Thromb Hemost.2019Feb;45(1):50-60.
·Brenner B et al. Best Pract Res Clin Obstet Gynaecol.2003 Jun;17(3):427-39.
·ACOG Practice Bulletin No.197:Inherited Thrombophilias in Pregnancy Obstet Gynecol.2018 Jul;132(1):e18-e34.
·祝丽琼等.中山大学学报(医学科学版),2010,31(4):476-481.
·Lu X, et al.Int J Gynecol Obstet.2015 Nov;131(2):161-5.
·Kupferminc MJ,et al.J Matern Fetal Neonatal Med.2011 Aug;24(8):1042-5.
·Aracic N et al.Yonsei Med J,2016,57(5):1230-1235.
·Sokol V et al. Acta Clin Croat.2016 Jun:55(2):309-15.
·Zhang T et al.Medicine (Baltimore).2015 Nov;94(45):e1732.
·Fawad S.J Ayub Med Coll Abbottabad.2010 Jul-Sep;22(3):197-200.
·Mohamed KAA et al.Middle East Fertility Society Journal,2014;19:176-182.
·刘育等.中国药物与临床.2016;16(6);874-876.
·Fyala EA et al.Int J Womens Health.2019 Jan 14;1141-47.
·Yelnik CM er al.Lupus.2018 Sep;27(10)1679-1686.
【专家简介】张建平,教授,主任医师,博士生导师,中山大学孙逸仙纪念医院妇产科副主任、产科主任,兼任世界中医药学会联合会围产医学专业委员会会长、中华妇产科学会产科学组成员、中国优生科学学会常务理事,还担任中华产科急诊电子杂志副主编、中华妇产科杂志等十余本杂志编委。主要研究领域为生殖免疫学和围产医学,尤其致力于复发性流产、试管婴儿多次失败及不明原因不孕的研究和诊疗工作。
声明:本文由妇产科在线独家采编,经专家审阅后发布,未经授权谢绝转载!
 妇产科在线APP下载
妇产科在线APP下载













