乳腺癌临床实践指南
目录

非浸润性乳腺癌
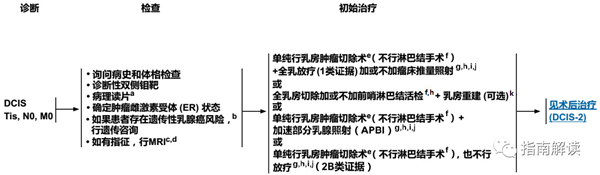
导管内原位癌的检查和初始治疗(DCIS-1)
英文版

中文版
脚注:
a.指南专家组支持所有浸润性和非浸润性乳腺癌的病理报告都遵循美国病理学家协会颁布的草案。http://www.cap.org。
b.见“NCCN遗传/家族性高风险评估指南:乳腺癌和卵巢癌”。
c.见“乳腺专用MRI检查原则”(BINV-B)。
d.进行MRI检查并未显示可以提高阴性切缘率或降低转为全乳切除的几率。缺乏支持可以改善长期预后的数据。
e.渴望接受保乳治疗的患者,可能需要再次切除以期获得阴性切缘。乳房肿瘤切除术不能获得足够的手术边距(安全边距)时应行全乳切除。关于手术安全边距的定义,见“导管原位癌和浸润性乳腺癌切缘状况的建议”(BINV-F)。
f.对于貌似单纯性导管内原位癌的女性患者,在没有浸润性乳腺癌证据或者未证实存在腋窝转移时,不应当进行全腋窝淋巴结清扫。然而,一小部分貌似单纯性导管原位癌的患者,在她们接受根治性手术的时候可能发现存在浸润癌。因此,如果貌似单纯性导管原位癌的患者准备行全乳切除术或受累的解剖部位切除,强烈推荐在切除术时行前哨淋巴结活检,否则由于解剖结构已经受到影响,以后恐怕难于再行前哨淋巴结活检。
g.见“放疗原则”(BINV-I)。
h.在全乳切除或再次切除时发现有浸润性病变的患者,应视为临床I期或II期肿瘤进行处理(包括淋巴结分期)。
i.见“需要行放疗的保乳手术患者的特别注意事项”(BINV-G)。
j.导管原位癌患者在乳房肿瘤切除后行全乳放疗可以降低约50%的复发率。复发的患者中大约有一半是浸润性乳腺癌,一半是导管原位癌。许多因素决定局部复发的风险:可触及的肿块、瘤体较大、较高级别、切缘距肿瘤近或切缘阳性、和年龄<50岁。如果患者和医生都认为个体复发风险“低”,一些患者可仅接受手术切除治疗。一些选择性的低风险DCIS患者,如果他们符合RTOG 9804试验中关于低风险DCIS定义的所有条件(包括筛查发现的DCIS、低-中等核分级、肿瘤大小≤2.5 cm、手术切缘阴性且距离肿瘤的边距>3 mm),可以考虑接受APBI。
k.见“术后乳房重建原则”(BINV-H)。
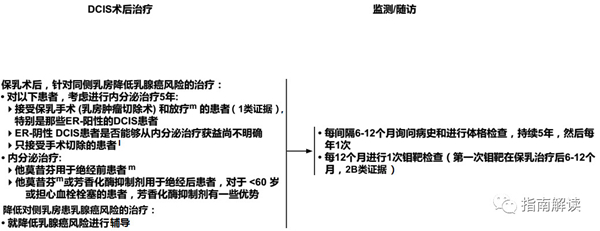
导管内原位癌的术后治疗和监测/随访(DCIS-2)
英文版

中文版
脚注:
l.现有资料表明内分泌治疗可降低接受保乳治疗的患者同侧乳房患乳腺癌的风险,以及接受全乳切除或保乳手术伴原发肿瘤ER阳性的患者对侧乳房患乳腺癌的风险。由于目前并没有显示出生存期的优势,因此个体化评估风险/获益很重要(也见于《NCCN乳腺癌降低风险指南》)。
m.对于考虑接受他莫昔芬治疗的女性患者,不推荐进行CYP2D6基因型检测。
浸润性乳腺癌
临床分期,检查(BINV-1)
英文版

中文版

脚注:
a.关于帮助老年肿瘤患者进行最佳评估和管理的工具,参见《NCCN老年人肿瘤指南》。
b.乳腺MRI可能有助于表征腋窝和/或内乳淋巴结转移性疾病。参见乳腺专用MRI检查原则(BINV-B)。
c.指南专家组支持所有浸润性和非浸润性乳腺癌的病理报告都遵循美国病理学家协会颁布的草案。http://www.cap.org。
d.见“生物标志物检测原则(BINV-A)”。
e.关于风险定义的标准,参见《NCCN遗传/家族性高风险评估指南:乳腺和卵巢》。
f.见“生育能力和节育问题(BINV-C)”。
g.见《NCCN心理痛苦管理指南》。
h.对于没有症状的早期乳腺癌,不推荐常规行全身分期。
i.如果进行了FDG PET/CT检查并在PET和CT部分均清楚地指示骨转移,则有可能不需要再行骨扫描或氟化钠PET/CT。
j.FDG PET/CT可在行诊断性CT检查的同时进行。临床I、II期或可手术的III期乳腺癌的分期并没有指征行PET或PET/CT扫描。FDG PET/CT最有助于标准分期检查难以判断或者存在疑问时的协助诊断(特别是对于局部晚期或转移性乳腺癌患者)。
k.FDG PET/CT联合常规的分期检查方法,有可能检测出局部晚期乳腺癌病例中未被怀疑的区域淋巴结转移和/或远处转移。
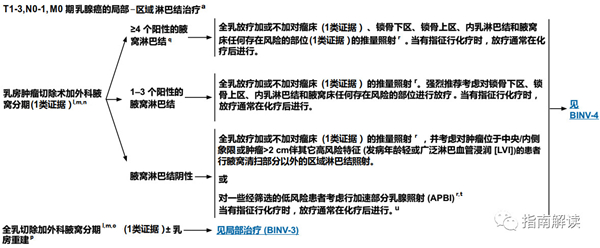
T1-3,N0-1,M0期乳腺癌的局部-区域淋巴结治疗(BINV-2,3)
BINV-2
英文版

中文版
脚注:
a.关于帮助老年肿瘤患者进行最佳评估和管理的工具,参见《NCCN老年人肿瘤指南》。
l.见“外科腋窝分期(BINV-D)”。
m.见“腋窝淋巴结分期(BINV-E)”和“DCIS和浸润性乳腺癌的切缘建议(BINV-F)”。
n.见“需要接受放疗的保乳治疗的特别注意事项(BINV-G)”。
o.除非属于《NCCN遗传/家族性高风险评估指南:乳腺和卵巢》以及《NCCN乳腺癌降低风险指南》中列出的对象,对于已知患单侧乳腺癌的患者不推荐进行对侧乳腺的预防性切除。当考虑进行此手术时,必须权衡对侧乳腺预防性切除术对于单侧乳腺癌患者所能够带来的小获益与患侧乳腺癌出现肿瘤复发的风险、双侧乳腺切除术所带来的精神心理和社会问题、以及进行对侧乳腺切除术所伴随的手术风险。强烈反对对接受保乳手术的患者进行预防性对侧乳腺切除术。
p.见“术后乳房重建原则(BINV-H)”。
q.考虑行影像学检查来进行全身分期,包括胸/腹部±盆腔诊断性CT平扫加增强扫描、骨扫描和可选择的FDG PET/CT(见BINV-1)。
r.见“放疗原则(BINV-I)”。
s.对于符合ACOSOG Z0011标准的患者,考虑采用切线野/高切线野。
t.PBI可在化疗前进行。
u.对于年龄≥70岁的ER阳性,临床淋巴结阴性,接受辅助内分泌治疗的T1期肿瘤患者,可免予行乳房放疗(1类证据)。
BINV-3
英文版

中文版

脚注:
a.关于帮助老年肿瘤患者进行最佳评估和管理的工具,参见《NCCN老年人肿瘤指南》。
l.见“外科腋窝分期(BINV-D)”。
m.见“腋窝淋巴结分期(BINV-E)”和“DCIS和浸润性乳腺癌的切缘建议(BINV-F)”。
p.见“术后乳房重建原则(BINV-H)”。
q.考虑行影像学检查来进行全身分期,包括胸/腹部±盆腔诊断性CT平扫加增强扫描、骨扫描和可选择的FDG PET/CT(见BINV-1)。
r.见“放疗原则(BINV-I)”。
v.见男性乳腺癌的特别注意事项(BINV-J)。
w.对于未行腋窝淋巴结清扫的微转移(> 0.2至≤2.0mm)病例,当考虑进行放疗时,请评估其它的患者相关危险因素。
x.存在多个高危复发因素(包括肿瘤位于中央/内侧或肿瘤>2cm伴其它高危特征[如发病年龄轻和/或广泛淋巴血管浸润])的患者在乳房切除术后,可考虑行术后放疗。
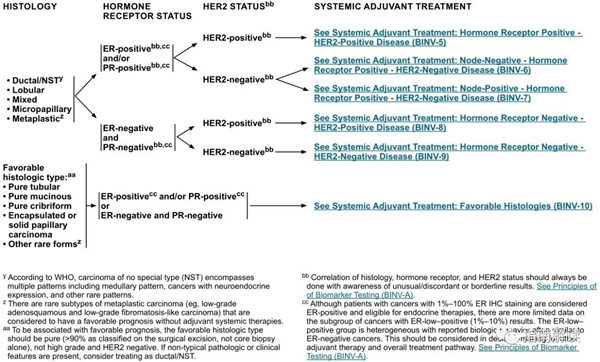
系统性辅助治疗(BINV 4~10)
BINV-4
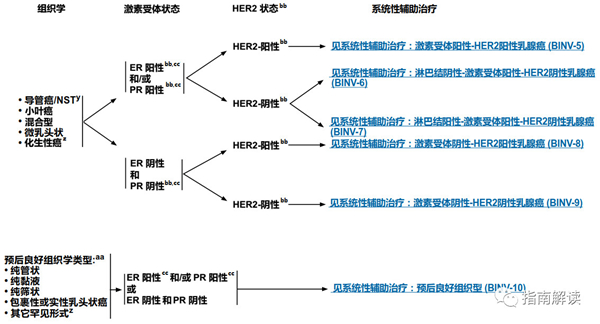
基于受体状态和Her-2状态行全身辅助治疗
英文版
中文版
脚注:
y.根据世界卫生组织的定义,非特殊型癌(NST)涵盖多种模式,包括髓样模式、具有神经内分泌表达的癌症和其它罕见模式。
zz.有一些罕见的化生性癌亚型(如低级别腺鳞癌和低级别纤维瘤样癌),被认为在不接受辅助全身治疗的情况下预后良好。
aa.良好的组织学类型与良好预后相关,但应是纯的(在手术切除标本上[不是单纯的芯针活检标本]良好组织学类型的比例> 90%),不含高级别癌且HER2阴性。如果存在非典型的病理或临床特征,请考虑按导管癌/NST治疗(请参阅BINV-4)。
bb.组织学、激素受体和HER2状态的相关性应始终在了解异常/不一致或临界结果的情况下进行。参见生物标志物检测原则(BINV-A)。
cc.尽管IHC法检测ER,染色1%-100%的癌症患者被认为是ER阳性且适合接受内分泌治疗,但关于ER弱阳性(1%-10%)亚组癌症患者的数据有限 。ER弱阳性组存在异质性,据报道其生物学行为通常类似于ER阴性的癌症。在作其它辅助治疗和总体治疗路径的决策中应考虑到这一点。参见生物标志物检测原则(BINV-A)。
BINV-5
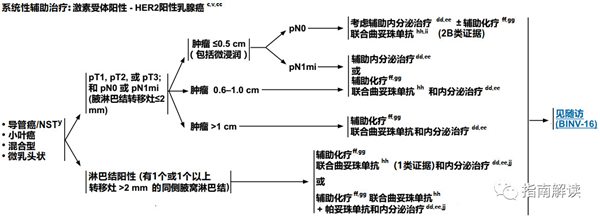
激素受体阳性,HER2阳性乳腺癌
英文版

中文版
脚注:
c.见生物标志物检测原则(BINV-A)。
v.见男性乳腺癌的特别注意事项(BINV-J)。
y.根据世界卫生组织的定义,非特殊型癌(NST)涵盖多种模式,包括髓样模式、
cc.尽管IHC法检测ER,染色1%-100%的癌症患者被认为是ER阳性且适合接受内分泌治疗,但关于ER弱阳性(1%-10%)亚组癌症患者的数据有限 。ER弱阳性组存在异质性,据报道其生物学行为通常类似于ER阴性的癌症。在作其它辅助治疗和总体治疗路径的决策中应考虑到这一点。参见生物标志物检测原则(BINV-A)。
dd.对于接受辅助治疗的绝经后(自然或诱发)患者,考虑予双膦酸盐辅助治疗。
ee.证据支持激素受体阳性的绝经前女性乳腺癌患者从卵巢手术或放疗去势的获益程度与单用CMF相似。见“辅助内分泌治疗(BINV-K)”。
ff.采用化疗和内分泌治疗联合方案行辅助治疗时应按照先化疗后内分泌治疗的顺序进行。现有数据表明,内分泌治疗加序贯或同步放疗是可以接受的。见“辅助内分泌治疗(BINV-K)”和“术前/辅助治疗方案(BINV-L)”。
gg.支持70岁以上的患者接受化疗的数据有限。见《NCCN老年人肿瘤临床实践指南》。
hh.T1a和T1b期,淋巴结阴性的患者即使HER2扩增或过表达,其预后也不确定。目前尚没有研究该类人群的随机试验。该组患者是否使用曲妥珠单抗治疗必须权衡已知的曲妥珠单抗毒性(例如心脏毒性)和不确定的绝对获益后进行决策。
ii.每周一次紫杉醇联合曲妥珠单抗的辅助化疗方案(Tolaney et al.NEJM 2015) 可考虑用于T1NOM0期,HER-2阳性的乳腺癌患者(特别是原发肿瘤激素受体阴性)。对于肿瘤大小接近T1mic(<1mm)的激素受体阳性乳腺癌患者,当预期复发风险低于5%而内分泌治疗可作为全身治疗的一个可行选择时,基于HER-2的全身治疗的绝对获益可能可以忽略不计。
jj.对于HR阳性,HER-2阳性并且认为有高复发风险的乳腺癌患者,在接受含曲妥珠单抗方案的辅助治疗后,可考虑予来那替尼(neratinib)延长辅助治疗。对曾接受过帕妥珠单抗治疗的患者,接受来那替尼延长辅助治疗的益处或毒性尚不清楚。
BINV-6
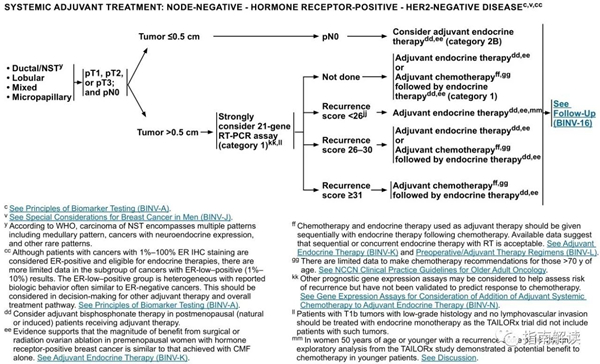
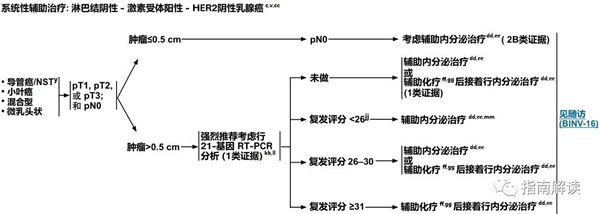
淋巴结阴性,激素受体阳性,HER2阴性乳腺癌
英文版
中文版
脚注:
c.见生物标志物检测原则(BINV-A)。
v.见男性乳腺癌的特别注意事项(BINV-J)。
y.根据世界卫生组织的定义,非特殊型癌(NST)涵盖多种模式,包括髓样模式、
cc.尽管IHC法检测ER,染色1%-100%的癌症患者被认为是ER阳性且适合接受内分泌治疗,但关于ER弱阳性(1%-10%)亚组癌症患者的数据有限 。ER弱阳性组存在异质性,据报道其生物学行为通常类似于ER阴性的癌症。在作其它辅助治疗和总体治疗路径的决策中应考虑到这一点。参见生物标志物检测原则(BINV-A)。
dd.对于接受辅助治疗的绝经后(自然或诱发)患者,考虑予双膦酸盐辅助治疗。
ee.证据支持激素受体阳性的绝经前女性乳腺癌患者从卵巢手术或放疗去势的获益程度与单用CMF相似。见“辅助内分泌治疗(BINV-K)”。
ff.采用化疗和内分泌治疗联合方案行辅助治疗时应按照先化疗后内分泌治疗的顺序进行。现有数据表明,内分泌治疗加序贯或同步放疗是可以接受的。见“辅助内分泌治疗(BINV-K)”和“术前/辅助治疗方案(BINV-L)”。
gg.支持70岁以上的患者接受化疗的数据有限。见《NCCN老年人肿瘤临床实践指南》。
kk.其它与预后分析相关的基因表达分析可考虑用于辅助评估复发的风险,但对于化疗疗效的预测尚未得到验证。见基因表达分析指导辅助内分泌治疗基础上行辅助全身性化疗的决策(BINV-N)。
ll.组织学为低级别且无淋巴脉管浸润的T1b肿瘤患者应接受单一内分泌治疗,因为TAILORx试验中不包括患有此类肿瘤的患者。
mm.对于复发评分为16-25分的年龄≤50岁的女性患者,来自TAILORx研究的探索性分析显示较年轻的患者接受化疗有潜在获益。参见“讨论”章节。
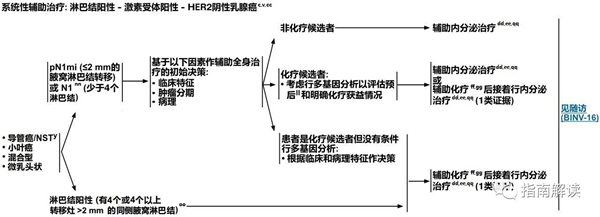
BINV-7
淋巴结阳性,激素受体阳性,HER2阴性乳腺癌
英文版

中文版
脚注:
c.见生物标志物检测原则(BINV-A)。
v.见男性乳腺癌的特别注意事项(BINV-J)。
y.根据世界卫生组织的定义,非特殊型癌(NST)涵盖多种模式,包括髓样模式、
cc.尽管IHC法检测ER,染色1%-100%的癌症患者被认为是ER阳性且适合接受内分泌治疗,但关于ER弱阳性(1%-10%)亚组癌症患者的数据有限 。ER弱阳性组存在异质性,据报道其生物学行为通常类似于ER阴性的癌症。在作其它辅助治疗和总体治疗路径的决策中应考虑到这一点。参见生物标志物检测原则(BINV-A)。
dd.对于接受辅助治疗的绝经后(自然或诱发)患者,考虑予双膦酸盐辅助治疗。
ee.证据支持激素受体阳性的绝经前女性乳腺癌患者从卵巢手术或放疗去势的获益程度与单用CMF相似。见“辅助内分泌治疗(BINV-K)”。
ff.采用化疗和内分泌治疗联合方案行辅助治疗时应按照先化疗后内分泌治疗的顺序进行。现有数据表明,内分泌治疗加序贯或同步放疗是可以接受的。见“辅助内分泌治疗(BINV-K)”和“术前/辅助治疗方案(BINV-L)”。
gg.支持70岁以上的患者接受化疗的数据有限。见《NCCN老年人肿瘤临床实践指南》。
nn.在N1mi和N1患者中,多基因检测用于预后分析,未被证实可以预测化疗是否能够获益,但可用于鉴别低风险人群,当这部分人群接受适当的内分泌治疗时,可能从化疗中获得比较小的绝对益处。关于21基因RT-PCR分析,前瞻性试验的二次分析表明,该检测可预测有1-3个同侧腋窝淋巴结转移的女性患者的化疗获益。尚未证实有其它的多基因测定方法可对化疗的获益作出预测。
oo.关于多基因检测在有≥4个同侧腋窝淋巴结转移的女性患者中的作用,数据很少。该组患者是否进行辅助化疗的决策应基于临床因素。
pp.见基因表达分析指导辅助内分泌治疗基础上行辅助全身性化疗的决策(BINV-N)。
BINV-8
激素受体阴性,HER2阳性乳腺癌
英文版
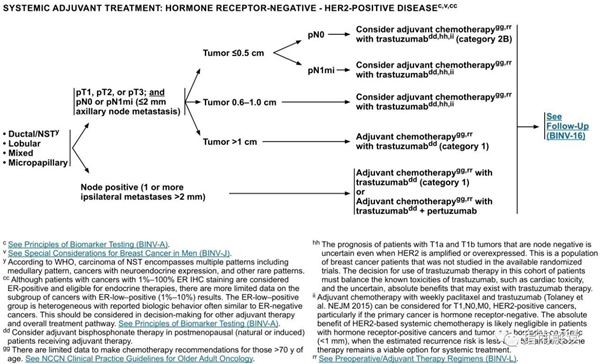
中文版
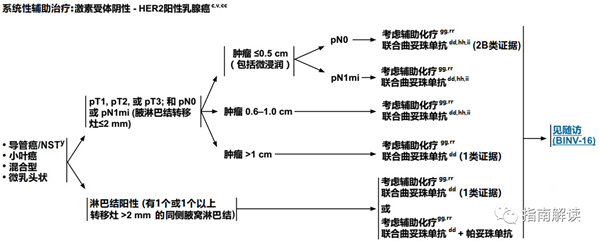
脚注:
c.见生物标志物检测原则(BINV-A)。
v.见男性乳腺癌的特别注意事项(BINV-J)。
y.根据世界卫生组织的定义,非特殊型癌(NST)涵盖多种模式,包括髓样模式、
cc.尽管IHC法检测ER,染色1%-100%的癌症患者被认为是ER阳性且适合接受内分泌治疗,但关于ER弱阳性(1%-10%)亚组癌症患者的数据有限 。ER弱阳性组存在异质性,据报道其生物学行为通常类似于ER阴性的癌症。在作其它辅助治疗和总体治疗路径的决策中应考虑到这一点。参见生物标志物检测原则(BINV-A)。
dd.对于接受辅助治疗的绝经后(自然或诱发)患者,考虑予双膦酸盐辅助治疗。
gg.支持70岁以上的患者接受化疗的数据有限。见《NCCN老年人肿瘤临床实践指南》。
hh.T1a和T1b期,淋巴结阴性的患者即使HER2扩增或过表达,其预后也不确定。目前尚没有研究该类人群的随机试验。该组患者是否使用曲妥珠单抗治疗必须权衡已知的曲妥珠单抗毒性(例如心脏毒性)和不确定的绝对获益后进行决策。
ii.每周一次紫杉醇联合曲妥珠单抗的辅助化疗方案(Tolaney et al.NEJM 2015) 可考虑用于T1NOM0期,HER-2阳性的乳腺癌患者(特别是原发肿瘤激素受体阴性)。对于肿瘤大小接近T1mic(<1mm)的激素受体阳性乳腺癌患者,当预期复发风险低于5%而内分泌治疗可作为全身治疗的一个可行选择时,基于HER-2的全身治疗的绝对获益可能可以忽略不计。
rr.见“术前/辅助治疗方案(BINV-L)”。
BINV-9
激素受体阴性,HER2阴性乳腺癌
英文版

中文版
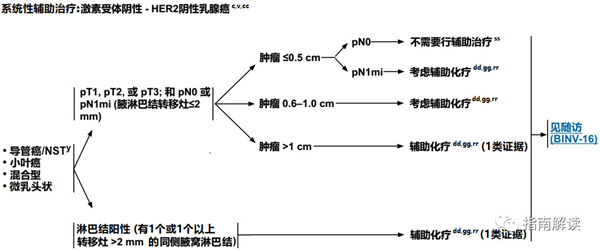
脚注:
c.见生物标志物检测原则(BINV-A)。
v.见男性乳腺癌的特别注意事项(BINV-J)。
y.根据世界卫生组织的定义,非特殊型癌(NST)涵盖多种模式,包括髓样模式、
z.有一些罕见的化生性癌亚型(如低级别腺鳞癌和低级别纤维瘤样癌),被认为在不接受辅助全身治疗的情况下预后良好。
cc.尽管IHC法检测ER,染色1%-100%的癌症患者被认为是ER阳性且适合接受内分泌治疗,但关于ER弱阳性(1%-10%)亚组癌症患者的数据有限 。ER弱阳性组存在异质性,据报道其生物学行为通常类似于ER阴性的癌症。在作其它辅助治疗和总体治疗路径的决策中应考虑到这一点。参见生物标志物检测原则(BINV-A)。
dd.对于接受辅助治疗的绝经后(自然或诱发)患者,考虑予双膦酸盐辅助治疗。
gg.支持70岁以上的患者接受化疗的数据有限。见《NCCN老年人肿瘤临床实践指南》。
rr.见“术前/辅助治疗方案(BINV-L)”。
ss.一些经过筛选的具有高风险特征的患者(例如,组织学为高级别的非常年轻的女性),可以考虑辅助化疗(2B类证据)。参见(BINV-L)。
BINV-10
预后良好组织型
英文版

中文版
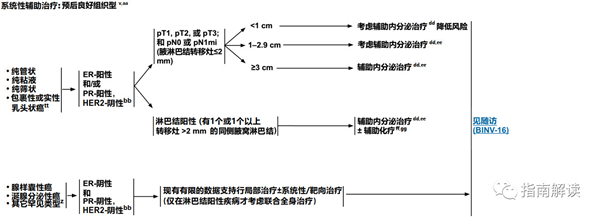
脚注:
v.见男性乳腺癌的特别注意事项(BINV-J)。
z.有一些罕见的化生性癌亚型(如低级别腺鳞癌和低级别纤维瘤样癌),被认为在不接受辅助全身治疗的情况下预后良好。
aa.良好的组织学类型与良好预后相关,但应是纯的(在手术切除标本上[不是单纯的芯针活检标本]良好组织学类型的比例> 90%),不含高级别癌且HER2阴性。如果存在非典型的病理或临床特征,请考虑按导管癌/NST治疗(请参阅BINV-4)。
bb.组织学、激素受体和HER2状态的相关性应始终在了解异常/不一致或临界结果的情况下进行。参见生物标志物检测原则(BINV-A)。
dd.对于接受辅助治疗的绝经后(自然或诱发)患者,考虑予双膦酸盐辅助治疗。
ee.证据支持激素受体阳性的绝经前女性乳腺癌患者从卵巢手术或放疗去势的获益程度与单用CMF相似。见“辅助内分泌治疗(BINV-K)”。
ff.采用化疗和内分泌治疗联合方案行辅助治疗时应按照先化疗后内分泌治疗的顺序进行。现有数据表明,内分泌治疗加序贯或同步放疗是可以接受的。见“辅助内分泌治疗(BINV-K)”和“术前/辅助治疗方案(BINV-L)”。
gg.支持70岁以上的患者接受化疗的数据有限。见《NCCN老年人肿瘤临床实践指南》。
tt.不伴相关常见浸润的包裹性乳头状癌 (EPC) 被定为pTis期,因为其行为类似于DCIS(根据AJCC)。根据WHO标准,应将实性乳头状癌(SPC)指定为原位或浸润性,但两种形式均具有良好的预后。
 妇产科在线APP下载
妇产科在线APP下载













