今年刚刚在《欧洲妇产科及生殖生物学杂志》上发表了宫颈原位腺癌意大利指南。该指南是由意大利阴道镜与宫颈病理学会临床实践委员会(SICPCV)委派的专家所撰写。虽然这只是一份针对意大利临床医生的指南,但是该指南荟萃了截止至2019年3月份发表的最新的文献,因此是目前最新、最全面的宫颈原位腺癌诊断及治疗方面的指南,对我们也有很大的参考价值。
下面把指南的核心内容摘要翻译出来,并且跟ASCCP指南(2006年版,2012年版)进行比较分析,以期能从总体上反映近年来学术界对宫颈原位腺癌诊断及治疗观点的演变。
首先介绍指南对细胞学AIS和组织学AIS处理的建议。
诊断
(1)对于细胞学结果为AGC(包括各种亚型)及AIS者,除外不典型子宫内膜细胞,不论HPV结果如何,建议行阴道镜检查及宫颈管取样(ⅡA)。
(2)对于细胞学AIS,但阴道镜检查未见异常和/或ECC阴性的妇女,建议在阴道镜下行诊断性切除术(ⅡA)。
(3)所采用诊断性切除术的术式应能够提供完整的组织标本,并且切缘状态应能评价(ⅡB)。
保守性处理
(1)如果怀疑是AIS,可以采用以下其中一种锥切方法:LEEP、冷刀锥切(CKC)、激光锥切。目前没有确切的证据表明不同的锥切方法对预后有影响(Ⅲ B)。
(2)如果锥切术后马上进行的ECC结果为阳性,应进一步锥切(ⅤC)。
(3)对于希望保留生育力的妇女,如果锥切切缘阳性,应进一步锥切(Ⅲ B)。
(4)如果阴道镜检查充分,应采用圆柱状切除(3型锥切),包括切除整个转化区以及鳞柱交界以上至少10~15mm的宫颈管组织(Ⅲ B)。(译者注:此处“阴道镜检查充分”并不是国际阴道镜联盟IFCPC 2011年阴道镜术语中的原义,而是与ASCCP 2012年指南所指相同,等同于原来的“阴道镜检查满意”,指宫颈和阴道可完全暴露,鳞柱交界完全可见,1型或2型转化区。延伸阅读:《阴道镜检查充分等同于阴道镜检查满意吗?—— 从ASCCP指南变迁看CIN1的处理系列之七》)。
(5)如果阴道镜检查不充分,应采用3型锥切,包括切除整个转化区,切除深度为20~25mm(Ⅲ B)。
锥切术后随访
关于AIS锥切术后最佳的随访方案并没有确切的证据。尤其对于采取保守治疗的患者来说,长期随访是必需的。
建议术后2年内每6个月进行一次细胞学+HPV+阴道镜评估,随后3年每年一次随访。此后每年要进行一次细胞学随访,持续随访。在每次的临床评估中,都要进行宫颈管刷子取样或者宫颈管搔刮(ECC)。锥切术后HPV阳性是疾病复发和进展的一个可靠的预测指标。当出现AIS复发或者鳞状上皮高级别病变复发时,在行全子宫切除术前应再次锥切。
治疗后需要间隔多长时间才能怀孕并没有特别的建议。如果随访结果一直正常,等待至少6~12个月是合理的。
根治性治疗
对于不需要保留生育功能的AIS患者,全子宫切除术是标准的根治性治疗方法(ⅡB)。
与ASCCP指南相比,2019年意大利指南尽管荟萃了最新文献,但并没有在AIS处理方面体现重大的进展。不过,不同版本的指南之间仍存在细微的区别,这些区别体现了学术界对AIS认识的变化。以下对一些关键性的认识问题进行具体分析,并且也跟CIN3的处理作比较。
细胞学AGC是否需要用HPV进行分流?
不同版本的指南意见一致。不应采用HPV进行分流。
是否应采用分流的措施,主要取决于风险评估(对于鳞状上皮病变,主要看5年内CIN3+风险;腺上皮病变则要看宫颈癌的风险),其次是这种筛查结果在人群中所占的比例。
ASCUS的情况跟AGC有一些类似。下面首先以ASCUS为例来说明分流的问题。
按照北加州凯撒医疗集团(KPNC)的大数据研究结果,HPV(+)的ASC-US者5年累积的CIN3+风险为6.8%,略高于LSIL的风险(5.4%),因此需要转诊阴道镜。而HPV(-)的ASC-US者5年累积的CIN3+风险只有0.44%,与细胞学正常者的风险相似(0.25%),因此可以在3年后复查。因此ASC-US可以通过HPV进行分流,从而达到很好的风险分层效果。(延伸阅读:《不同细胞学和HPV结果的CIN2+、CIN3+及宫颈癌风险(更新)》,《重温经典之 “同种风险,同样管理”—— “风险基准”的确定》)。
另一方面,如果某项筛查结果5年累积的CIN3+风险虽然不高,但患宫颈癌的风险比较高,而且该筛查结果非常罕见,这种病例即便全部转诊阴道镜也不会明显增加阴道镜检查的负担。AGC就是一个典型的例子。HPV(+)的AGC者5年累积的CIN3+风险达30%,而HPV(-)的AGC风险仅为1.2%。表面上看似乎HPV是AGC极好的分流手段。但这一数字仅反映了鳞状上皮病变的情况,AGC当中有相当比例可能存在腺上皮病变,因此不能完全用CIN3+风险来代表。鉴于AGC仅占所有细胞学异常者的0.2%,而且有部分宫颈腺癌跟HPV感染无关(宫颈管腺癌发病率升高可能跟HPV感染有关,但肠型或输卵管型跟HPV感染不太密切,内膜样型则跟HPV感染完全无关),因此所有的指南均不提倡采用HVP分流。
锥切方法
无论是CIN2,3,还是AIS,关于应采用何种方法进行锥切,一直以来都有争议。争议主要集中在以下几个方面:治疗成功率与并发症发生率,对手术切缘病理学评估是否有影响。
2001年版ASCCP指南没有论述AIS的治疗问题。但是,在谈到CIN2,3的治疗时,指南指出,有多项随机对照研究发现,冷刀锥切(CKC)与电环锥切(LEEP)比较,治疗成功率与并发症发生率是相当的。两种方法对于手术切缘病理学评估是否有差别仍存在争议。有一些研究(并非全部的研究)认为冷刀锥切(CKC)更少出现切缘受累,而且切缘的评估也更容易。因此,当时的指南更倾向于冷刀锥切(CKC)。
在2006年版ASCCP指南开始增加了对AIS处理的论述。指南提到,部分研究显示,电环切除术与冷刀锥切术相比较而言,复发率增加,切缘阳性率也增加。但指南没有强调锥切必须采取何种方法。只是需要注意保证标本的完整性以及切缘可评估,避免把标本切成碎块(包括了“牛仔帽”式的序贯切除方式)。
2012年版ASCCP指南没有再强调如何选择锥切方法的问题。
2019年意大利指南则明确指出,如果怀疑是AIS,可以采用以下其中一种锥切方法:LEEP、冷刀锥切(CKC)、激光锥切。目前没有确切的证据表明不同的锥切方法对预后有影响(Ⅲ B)。
因此,从指南对锥切方法论述的变迁可以看出,至少目前还不能看出不同的锥切方法(LEEP、冷刀锥切、激光锥切)对预后的影响存在差别。换句话说,这些方法本身没有优劣之分,关键是掌握这门技术的医生的熟练程度,以及根据患者的具体情况选择合适的锥切方法。使用自己擅长的技术手段,可以起到事半功倍的效果。
锥切的切除深度
AIS有可能是多灶性的,在10%~15%的患者中存在“跳跃性”的病灶,即病灶之间至少相隔2mm的正常粘膜。此外,AIS可以位于宫颈管的上段。因此,在临床实践中,对AIS进行宫颈锥切术时,切除深度往往是一个重要的考虑因素。
不过,以往各个版本的ASCCP指南没有针对AIS的特殊性在锥切的切除深度方面作出额外的说明。
根据2011年国际阴道镜联盟(IFCPC)制定的阴道镜术语,锥切手术分为“1型切除”、“2型切除”及“3型切除”。“1型切除”指切除1型转化区;“2型切除”指切除2型转化区,其中包括部分宫颈管组织(阴道镜下可见的范围);“3型切除”指切除3型转化区,切除的长度比“1型切除”及“2型切除”要更长,其中包括更多的宫颈管组织。“3型切除”也用于腺上皮病变和宫颈微小浸润癌的治疗,以及以往曾接受过治疗的患者。
按照这种说法,即便是AIS病灶位于宫颈外口,阴道镜下可以看到病灶的边界,也应采取3型切除。但考虑到宫颈管内“跳跃性”病灶的可能性,切除深度应该多少为合适呢?另外,如果AIS病灶位于宫颈管深部,阴道镜下病灶不可见或者仅可见部分,这种情况下,切除深度是否应有所不同?
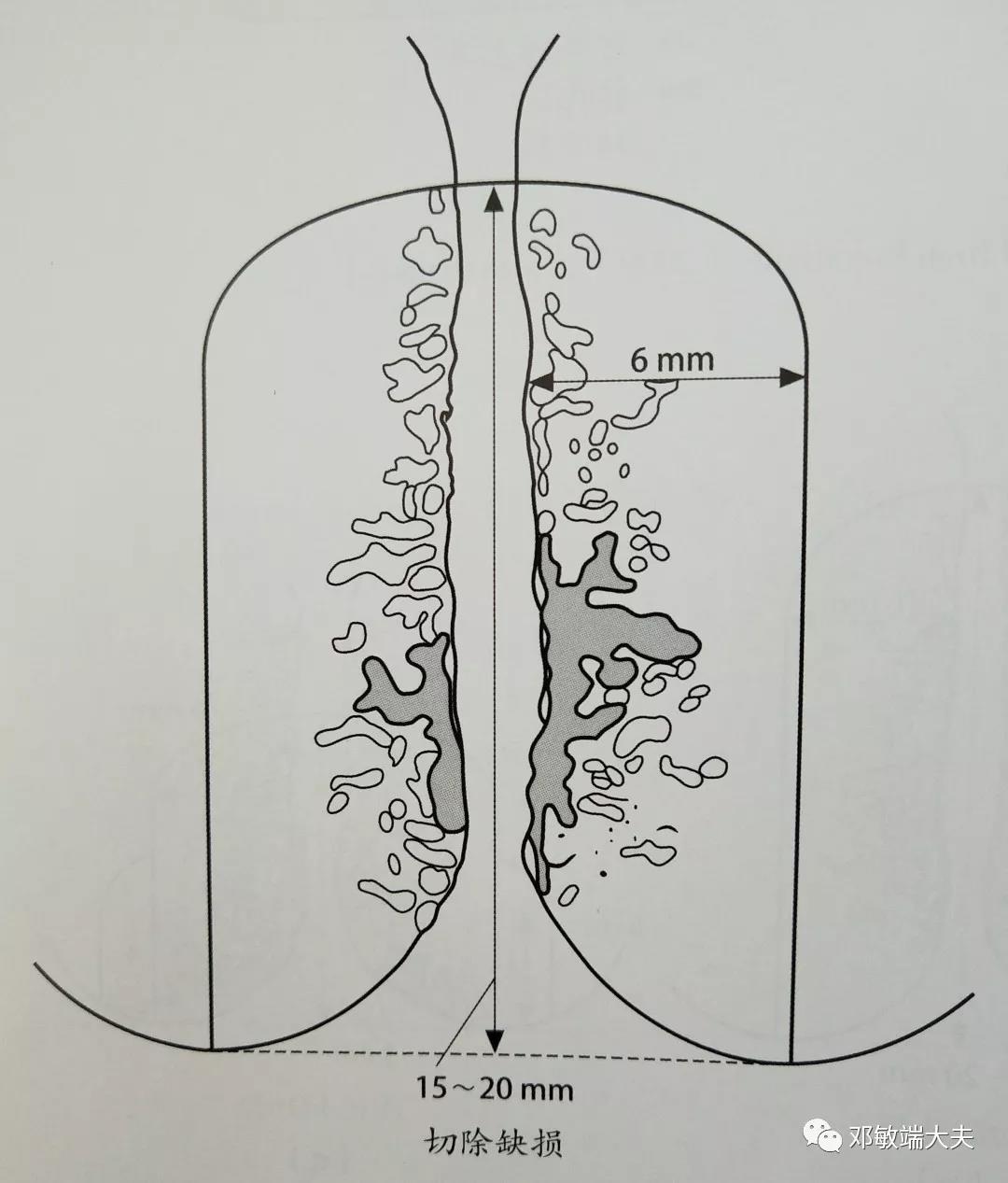
3型切除
图片引自:Albert Singer《宫颈与下生殖道癌前病变诊断与治疗》,第3版
一般认为,为获得切缘阴性,锥切深度应达到10~25mm。当然,锥切深度20~25mm更容易实现切缘阴性(Bertrand,1987),不过,这样的锥切深度会增加宫颈狭窄及不良妊娠结局的风险。基于AIS的组织病理学特点,病灶顶端距离切缘3~10mm的正常组织已经可以降低残留卫星灶的可能性了(Goldstein ,1998)。
基于这样的认识,2019年意大利指南对锥切深度提出了明确的意见:如果阴道镜检查充分,应采用圆柱状切除(3型锥切),包括切除整个转化区以及鳞柱交界以上至少10~15mm的宫颈管组织。如果阴道镜检查不充分,应采用3型锥切,包括切除整个转化区,切除深度为20~25mm。
事实上,由于宫颈管内“跳跃性”病灶的不确定性,锥切深度更多是手术医生综合患者病情及术中所见的个人判断。
锥切切缘阳性或锥切术后颈管取样阳性的进一步处理
2006年版及2012年版ASCCP指南对此有着相同的论述:如果计划采用保守性治疗,而标本的切缘阳性,或锥切术后颈管取样为CIN或AIS,建议再次行切除术以增加完全切除的机会。不过,6个月后采用“细胞学+HPV DNA检测+阴道镜检查+颈管取样”的联合方案进行重新评估是也可以接受的。显然,ASCCP更倾向于再次切除,不过还保留着追踪随访这一条后路。
2014年的一项系统回顾发现,AIS锥切切缘阳性者49.3%存在残留病灶(Baalbergen,2014)。2017年的一篇荟萃分析共纳入了97项研究,包括了44446名进行宫颈癌前病变治疗的妇女(包括CIN2+,以及CGIN和宫颈原位腺癌),切缘阳性比阴性者CIN2+残留或复发率要升高(分别为17.1%及3.7%,相对风险为4.8)。外切缘阳性、内切缘阳性、内外切缘均阳性这三种情况,CIN2+残留或复发率分别为7.2%、16.3%及18.9%。
因此,2019年意大利指南指出,对于希望保留生育力的妇女,如果锥切切缘阳性,应再次锥切(Ⅲ B)。跟ASCCP指南相比,意大利指南更为积极,不再保留追踪随访的策略。
相比之下,CIN2,3锥切切缘阳性的处理显得保守很多。2012年版ASCCP指南中,如果锥切切缘或者锥切术后ECC为CIN2,CIN3,或CIN2,3,推荐4~6个月后复查细胞学并行宫颈管取样(Ⅱ B);再次进行诊断性锥切也是可接受的(Ⅲ C);如果再次诊断性锥切不可行的话,全子宫切除术是可接受的方案(Ⅲ C)。因此,在2012年版ASCCP指南中,同样是切缘阳性或者锥切术后ECC阳性,假如是CIN2,3,更倾向于复查而不是再次锥切;假如是AIS,更倾向于再次锥切而不是复查。这种区别,体现了AIS与CIN2,3生物学行为的不同。
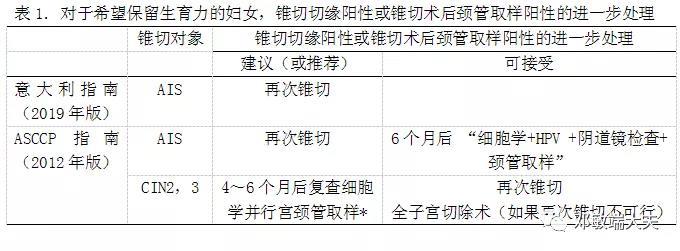
*注:根据2017年的一篇荟萃分析,治疗后高危型HPV对于治疗失败的预测比切缘状态更为准确。因此,“细胞学+HPV DNA检测+阴道镜检查+颈管取样”可能会更合适。
锥切切缘阴性的意义
2019年意大利指南指出,切缘的阴性预测值不高,切缘阴性并不意味着AIS被完整切除。
有研究发现,经过了12~120个月的追踪随访,发现切缘阴性者复发率为3%,切缘阳性者复发率为17%(Baalbergen,2014)。
2017年的一篇针对CIN2+,以及CGIN和宫颈原位腺癌进行锥切治疗的荟萃分析文章,发现切缘阴性者CIN2+风险为3.7%,而高危型HPV阴性者(不管切缘状态如何)1%。
因此,锥切术后高危型HPV阴性比切缘阴性能更好地预测治疗的成功。
锥切术后随访
关于AIS锥切术后随访,2006年版及2012年版ASCCP指南只提到对于未行全子宫切除术的妇女,建议长期随访。但具体的随访方案没有明确。
2019年意大利指南指出,建议术后2年内每6个月进行一次细胞学+HPV+阴道镜评估+宫颈管评估,随后3年每年一次随访。此后每年要进行一次细胞学随访,持续随访。在每次的临床评估中,都要进行宫颈管刷子取样或者宫颈管搔刮(ECC)。锥切术后HPV阳性是疾病复发和进展的一个可靠的预测指标。
相比之下,CIN2,3锥切术后随访要简单一些。2012年版ASCCP指南建议,CIN2,3治疗后应在12个月和24个月复查细胞学+HPV。如果结果均正常,3年后再次复查。再次复查仍正常的患者,继续常规筛查至少20年。随访方案没有强调宫颈管评估及阴道镜检查的重要性。
综上所述,与2012年版ASCCP指南比较,2019年意大利指南对以下问题作出了明确的建议:
(1) 不同的锥切方法对预后的影响没有差别。
(2) 对于希望保留生育力的妇女,如果锥切切缘阳性或锥切术后颈管取样阳性,应进一步锥切。
(3) 如果阴道镜检查充分,应采用圆柱状切除(3型锥切),包括切除整个转化区以及鳞柱交界以上至少10~15mm的宫颈管组织。如果阴道镜检查不充分,应采用3型锥切,包括切除整个转化区,切除深度为20~25mm。
(4) 建议锥切术后2年内每6个月进行一次细胞学+HPV+阴道镜评估+宫颈管评估,随后3年每年一次随访。此后每年要进行一次细胞学随访,持续随访。
(本文仅为笔者对指南的个人理解,如有疑问,请阅读指南原文。)
参考文献:
(1)Ciavattini A,Giannella L,Delli Carpini G,et al.Adenocarcinoma in situ of the uterine cervix: Clinical practice guidelines from the Italian society of colposcopy and cervical pathology (SICPCV).Eur J Obstet Gynecol Reprod Biol.2019V240N:273-277
(2)Massad LS,Einstein MH,Huh WK,et al.2012 updated consensus guidelines for the management of abnormal cervical cancer screening tests and cancer precursors.J Low Genit Tract Dis.2013V17N5 Suppl 1:S1-S27
(3)Arbyn M, Redman CWE,Verdoodt F. Incomplete excision of cervical precancer as a predictor of treatment failure: a systematic review and meta-analysis.Lancet Oncol.2017V18N12:1665-1679
(4)Demarco M;Lorey TS;Fetterman B;et al.Risks of CIN 2+, CIN 3+, and Cancer by Cytology and Human Papillomavirus Status: The Foundation of Risk-Based Cervical Screening Guidelines.J Low Genit Tract Dis.2017V21N4:261-267
(5)Katki HA,Schiffman M,Castle PE,et al.Benchmarking CIN 3+ risk as the basis for incorporating HPV and Pap cotesting into cervical screening and management guidelines.J Low Genit Tract Dis.2013V17N5 Suppl 1:S28-35
(6)Bertrand M,Lickrish GM,Colgan TJ. The anatomic distribution of cervical adenocarcinoma in situ: implications for treatment. Am J Obstet Gynecol.1987V157N1:21-5
(7)Goldstein NS,Mani A.The status and distance of cone biopsy margins as a predictor of excision adequacy for endocervical adenocarcinoma in situ. Am J Clin Pathol.1998V109N6:727-32
 妇产科在线APP下载
妇产科在线APP下载













