摘要
中国年轻乳腺癌患者所占比例较高,在临床、病理和遗传方面具有特殊性。抗肿瘤治疗后,提前闭经和生育力受损等问题可能对患者造成躯体、心理和社会等多方面的影响。年轻乳腺癌患者更需要多学科会诊、跨学科讨论来制定整体的治疗方案。为了规范年轻乳腺癌的诊疗流程和生育管理策略,全国肿瘤相关学科和妇科生殖领域专家经过反复、充分讨论,参考国际先进经验,针对中国患者独特的临床病理及遗传特征,共同制定了年轻乳腺癌诊疗与生育管理专家共识。
一、中国年轻乳腺癌患者特征
1.临床病理特征:
乳腺癌是中国女性发病率最高的恶性肿瘤,中国患者的发病年龄比欧美国家早近10年,平均发病年龄48.7岁[1]。年轻乳腺癌特指发病年龄≤35岁的乳腺癌患者。在发达国家,年龄<40岁的乳腺癌患者在所有乳腺癌患者中所占比例<7%[2]。在中国,年轻乳腺癌患者在全部乳腺癌患者中所占比例>10%,发病年龄≤25岁的极年轻乳腺癌约占0.5%[3,4]。
国外研究显示,年轻乳腺癌患者诊断时往往临床分期较晚,雌激素受体、孕激素受体和人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)阴性的三阴性乳腺癌以及HER-2阳性型乳腺癌的比例更高[5,6,7,8,9,10]。我国一项临床研究显示,大多数年轻乳腺癌患者具有乳腺癌或卵巢癌家族史(8.8%),初次诊断时即为Ⅲ或Ⅳ期(30.8%),分子分型多为三阴性乳腺癌(24.7%)或HER-2阳性乳腺癌(28.7%)。以上这些临床病理特征在年龄≤25岁的极年轻乳腺癌患者中更加突出[11]。年轻乳腺癌患者复发转移和死亡风险更高、临床预后更差[12]。
2.遗传特征:
年轻乳腺癌患者更具有遗传倾向,可能对局部和全身治疗决策产生影响。我国一项年轻乳腺癌遗传特征的研究显示,突变的基因涉及不同的信号通路,其中包括乳腺癌常见易感基因,如BRCA1、BRCA2、PALB2、ATM、TP53、RAD51B、RAD51D和SLX4等,以及一些新的易感基因如APC、SLX4、TSC2、TGFBR2、RET、SBDS和FANCE等;年轻乳腺癌患者胚系突变频率达24.0%,极年轻乳腺癌患者(≤25岁)突变频率更高达50.0%,均明显超过中国非选择性乳腺癌患者胚系突变频率(9.2%),也超过肿瘤基因组图谱数据库中乳腺癌患者的胚系突变频率(11.6%);BRCA2突变患者更多为Luminal B型,更容易出现分期晚、淋巴结转移和复发转移,BRCA2突变携带者的中位无病生存时间明显短于非BRCA2突变携带者,而BRCA1突变患者更多为三阴性乳腺癌[11]。
无论是否具有家族史,年轻乳腺癌患者均应接受遗传咨询。为了更好地制定综合治疗方案,遗传咨询应在开始治疗前进行。应告知基因检测可能影响患者本人及亲属的社会关系、心理、筛查策略、医疗决策及后续随访,基因检测内容应依据患者个体情况及家族史等综合决定。除了BRCA1/2,还应该包括其他中国年轻乳腺癌常见的突变,如PALB2、ATM和TP53等。基因检测的结果判读和临床应用标准流程目前仍在进一步研究中,可参考我国现有遗传病理相关指南[13]。
3.生育管理现状:
随着抗肿瘤治疗的进步,乳腺癌患者长期生存率得到改善。手术、化疗和内分泌治疗等综合治疗手段相结合,可以显著改善年轻乳腺癌患者的无病生存时间和总生存时间,但同时也带来包括卵巢功能损伤等近期及远期不良反应。基于人群的调查研究显示,经治乳腺癌患者妊娠率仅为3%,比一般人群妊娠率低40%[14]。经治乳腺癌患者的生育能力取决于年龄和治疗方式。在乳腺癌治疗过程中,环磷酰胺等化疗药物会破坏卵巢功能,导致患者更早绝经;因5~10年的辅助内分泌治疗而延误最佳生育年龄,同样会降低患者的生育能力[15]。另一方面,患者对生育问题的担忧可能会导致患者不愿开始或不能坚持抗肿瘤治疗。因此,恶性肿瘤患者,尤其是年轻乳腺癌患者生育力的保护在全球受到越来越广泛的关注。
2017年欧洲肿瘤内科学会制定的年轻乳腺癌患者诊治指南中提到,对于年轻乳腺癌患者,在确诊时就应该立即得到医师关于生育力保护的咨询与建议[16]。2018年美国临床肿瘤学会及英国生育协会先后更新了恶性肿瘤患者生育能力保护指南,从辅助生殖技术角度为患者提供可选的技术方案[17,18]。针对欧美人群的生育管理建议不一定适合中国人群,而我国在生育力保护方面的工作开展较晚,目前仍处于初级阶段,尚缺乏针对恶性肿瘤尤其是年轻乳腺癌患者的指导性意见。
二、外科治疗相关内容
外科治疗是乳腺癌综合治疗的重要组成部分。对于年轻乳腺癌患者而言,外科治疗更需做好肿瘤疗效、术后美观和远期并发症之间的平衡。乳腺癌外科手术部分主要涉及乳房的处理和腋窝分期。在美国国立综合癌症网络(NCCN)指南、St. Gallen专家共识和中国抗癌协会乳腺癌诊治指南与规范中均对乳腺癌外科治疗给出了相关建议:具备保乳条件和意愿的患者可以选择保乳治疗,保乳治疗的生存率和远处转移发生率与乳房切除的患者相似;前哨淋巴结活检是临床腋窝阴性患者的首选腋窝分期方式[19]。年轻乳腺癌可能存在BRCA1/2等基因的胚系突变,从而具有遗传倾向,由于缺乏预防性对侧乳房切除患者长期生存获益的证据,因此,对这些患者在外科治疗的原则上应有所考虑。
1.保乳治疗:
年轻可手术乳腺癌患者的手术治疗应遵循外科治疗指南。有研究显示,年轻患者保乳术后局部复发风险增加[20,21]。2016年美国临床肿瘤学会会议中,以壁报形式发布了丹麦的一项回顾性研究,结果显示,年龄<45岁、无淋巴结转移的早期乳腺癌女性患者选择保乳术联合放疗,与行乳房切除术但未放疗的女性患者比较,20年内的疾病局部复发率升高13%。此外,局部复发使转移的风险加倍。在一项对2 784例保乳手术患者的回顾性研究显示,<35岁患者的局部复发率为2.5%,高于整体人群的1.1%[21]。但在一项随访达20年的随机对照研究中,对于<50岁的Ⅰ~Ⅱ期患者,保乳治疗组和乳房切除组患者在总生存和至远处转移时间上均无差异[22]。这提示符合一般保乳适应证的年轻乳腺癌患者可以选择保乳治疗。年轻乳腺癌患者保乳后,局部复发风险可能高于整体人群,需要长期随访。年轻乳腺癌患者的腺体致密,建议充分进行术前影像评估,推荐乳腺增强MRI、超声和(或)X线检查,降低可能因多灶性、多中心性病变和癌残余导致的局部复发风险。
目前缺乏针对年轻乳腺癌患者分子分型和保乳术后局部复发风险的前瞻性数据。一项荟萃分析回顾性分析了中位年龄为51岁的12 592例乳腺癌的临床资料,其中保乳手术7 176例,乳房切除者5 416例,按分子分型进行局部复发率的统计,结果显示,Luminal型乳腺癌患者的局部复发率低于HER-2过表达型和三阴性乳腺癌;无论在保乳术后还是乳房切除术后,三阴性乳腺癌患者的局部复发率均较高[23]。年轻乳腺癌患者在选择保乳时,是否需参考分子分型结果,目前尚无定论,但建议对HER-2过表达型和三阴性乳腺癌保乳术后的患者加强随访。
携带BRCA1/2基因突变是乳腺癌保乳治疗的相对禁忌证。一项纳入了BRCA1/2突变携带者行保乳治疗后随访结果显示,术后10年和15年同侧乳腺癌的复发率分别为12%和24%,而未携带者分别为9%和17%;术后10年和15年对侧乳腺癌的发生率分别为26%和39%,而未携带者分别为3%和7%[24]。如果术前已经明确年轻乳腺癌患者为胚系BRCA1/2基因致病突变携带者,应与患者就手术方式进行沟通,告知可选择的手术方式及其利弊,包括保乳手术+放疗、同侧乳房切除±乳房重建和双侧乳房切除±乳房重建,提示保乳后同侧复发风险和对侧乳腺癌风险,以及同侧或对侧全乳切除并未降低乳腺癌死亡率,并告知其他降低风险的方法,如术后辅助治疗、密切随访和定期增强乳腺MRI筛查等,帮助患者做出决定。
2.保乳治疗后的哺乳问题:
年轻保乳患者在放疗后如果生育,患侧乳房仍有可能哺乳,但即使可以分泌乳汁,由于手术及放疗的影响,乳头延展性下降,可能导致患侧母乳喂养困难。对于乳晕区切口、相对放疗剂量高的情况下,更易出现患侧乳房无乳汁分泌。在一项回顾性小样本量的研究显示,>50%的患者有可能患侧乳房产生乳汁,只是分泌量有所下降,患侧乳汁在生化表现上有所变化(脂肪含量下降、盐分增高),而健侧乳房的泌乳功能不受影响[25]。目前,保乳治疗后的哺乳问题尚缺乏高级别循证医学证据,在妊娠哺乳期间可能会增加患侧乳房罹患乳腺炎的风险。可在充分告知的前提下,选择母乳喂养或其他替代方式。
3.前哨淋巴结活检:
腋窝分期是乳腺癌综合治疗的重要参考信息,目前推荐对于临床腋窝阴性、非炎性的乳腺癌患者首选前哨淋巴结活检作为腋窝分期的方式。NSABP B32研究比较了临床腋窝阴性的乳腺癌患者行前哨淋巴结活检或直接腋窝清扫的总生存、无病生存、局部复发和手术并发症的情况,两组患者的8年无病生存率和局部复发率无明显差异[26]。NSABP B32研究中,≤49岁的人群占26%,目前尚无专门针对年轻乳腺癌患者前哨淋巴结活检的随机对照临床研究。结合现有的临床研究结果和临床实践,推荐符合前哨淋巴结活检指征的年轻患者首选前哨淋巴结活检作为腋窝分期方式。
4.肿瘤整形技术与乳房重建:
保乳治疗后应用肿瘤整形技术进行乳房缺损修复,有助于保证切缘阴性和术后良好的乳房外形。应用肿瘤整形技术可以在保证术后外形的前提下,切除更宽的切缘,更容易获得阴性切缘。一项纳入1 177例应用肿瘤整形技术保乳乳腺癌患者的研究显示,相较于传统保乳,其出现切缘阳性或切缘接近的比例明显降低,分别为5.8%和8.3%,差异有统计学意义(P=0.04)[27]。一项肿瘤整形保乳和传统保乳相比较的研究显示,前者的再次扩切率和中转切除乳房的比例均低于传统保乳[28]。对于有保乳需求且肿瘤较大的年轻乳腺癌患者,新辅助化疗后应用肿瘤整形技术可以增加保乳机会,同时亦可改善术后乳房外观,对年轻乳腺癌保乳有重要实践意义。对年轻乳腺癌计划行保乳手术时,推荐应用肿瘤整形技术和理念,改善术后乳房的美学效果。
年轻乳腺癌患者更需要术后良好的外形。不能行保乳治疗的年轻乳腺癌,接受乳房重建是合理的选择。重建时机可以根据患者体型、后续治疗方案选择一期重建或二期重建;重建方式可以选择假体重建或自体组织重建。如乳头乳晕未累及,可考虑行保留乳头乳晕的乳房切除联合乳房重建,可提高术后乳腺外形的满意度。一项<35岁行保留乳头乳晕乳房切除和传统乳房切除的回顾性研究显示,两组手术方式患者的局部复发、无病生存和总生存情况无显著差异[29]。年轻乳腺癌患者的乳房重建可以根据患者年龄、乳房类型(致密型或脂肪型)和术后计划接受的辅助治疗等进行规划。疾病分期晚、预后不良的年轻乳腺癌患者接受重建手术需谨慎考虑,要综合考虑术后系统治疗的早期应用、局部复发风险、肿瘤远处转移的风险、重建手术的创伤以及对疾病监控的潜在影响决定。
5.预防性切除:
对于携带BRCA1/2基因突变的乳腺癌患者,对侧乳腺癌的年发生率可以达到3%[30],而乳腺癌整体人群这一概率只有0.6%[31]。对侧乳腺癌风险管理的策略包括影像学定期筛查、对侧乳房预防性切除、预防性输卵管卵巢切除和应用化学药物预防,其中最有效的办法是对侧乳房预防性切除,可以降低95%对侧乳腺癌风险[32,33]。对于携带BRCA1/2基因突变的年轻乳腺癌患者,在外科治疗决策时,应充分告知其手术的风险、未来乳腺癌发生风险、以及可以选择的非手术预防措施。对侧乳房预防性切除术的实施,需要基于对患者家族遗传史、BRCA等基因突变的准确评估,且基于循证医学证据,由医患双方通过良好沟通后共同决定。
预防性乳房切除术主要针对具有乳腺癌高危因素的患者,可为双侧或单侧预防性切除,后者即在一侧确诊为乳腺癌而行乳房切除术的同时,对另一侧行预防性切除术。因对健侧乳腺癌的恐惧以及希望双侧切除后的乳房重建手术获得更好的对称性,美国研究显示,年轻乳腺癌患者选择行预防性切除的比例呈逐年升高[34]。年轻乳腺癌患者是否行对侧预防性切除需要根据对侧乳腺癌发生风险进行评估。
对于未携带BRCA1/2基因突变的年轻乳腺癌患者,无明确证据显示对侧预防性切除可以带来乳腺癌生存相关获益,因此,推荐采用其他策略进行风险管控,如术后的内分泌治疗、定期影像学检查等。
三、化疗相关内容
1.必要性和药物选择:
化疗方案组合的进步降低了乳腺癌患者的复发风险,年龄<50岁的患者从中获得的益处更大,因此,年轻患者的化疗会更加积极[31]。越年轻的患者,化疗的获益越大,但是年轻不应成为早期乳腺癌辅助化疗的唯一依据。化疗方案的选择除充分考虑患者年龄因素外,还需要结合患者肿瘤病理分期、分子分型等多种因素。对于除年龄因素外,无其他危险因素的早期激素受体阳性的乳腺癌患者,可以仅行内分泌治疗。对于中高危患者,应依据患者具体临床分期及病理分型,参考我国现有乳腺癌治疗指南[19]进行化疗、靶向治疗和内分泌治疗。
对于有强烈生育要求的年轻乳腺癌患者,辅助治疗期间应充分考虑环磷酰胺对卵巢功能的不良影响,以及可能因此所致生育功能障碍,但环磷酰胺对生育质量、后代健康方面的影响比较小。辅助化疗药物选择应该遵循现有指南,充分告知患者环磷酰胺对卵巢功能的影响及其带来的不孕风险增加,以及早发性卵巢功能不全风险明显增加等。这部分患者建议在化疗前2周即开始使用促性腺激素释放激素类似物(gonadotropin releasing hormone agonist, GnRHa)保护卵巢功能,直至化疗结束[35,36]。
2.化疗期间的生育力保护:
化疗会降低卵巢储备功能,甚至导致卵巢功能衰竭,因此,化疗对年轻患者生育功能有较大影响。对于未来有生育需求的年轻乳腺癌患者,建议化疗前与妇产科和生殖专科医师讨论决定卵巢功能保护策略,其中包括化疗前使用生育力保护技术冷冻胚胎、卵子和卵巢等,以及化疗期间应用GnRHa,实现对卵巢不同程度的保护(详见本共识生育管理相关内容)。具体生育力保护方法及时机需要针对每例患者的实际情况讨论,需要寻求专业生殖内分泌专家的指导与帮助。
最佳的怀孕时机是无法准确预测的,需个体化地结合年轻患者的身体状况、乳腺癌病理特点和肿瘤复发危险度[37](详见本共识生育管理相关内容)。
四、内分泌治疗相关内容
1.必要性及药物选择:
2017年欧洲肿瘤内科学会在年轻乳腺癌患者的国际指南共识中提出,三苯氧胺是低复发风险的绝经前激素受体阳性乳腺癌患者的标准治疗方案。但近年来研究表明,部分中高危绝经前患者可从联合卵巢功能抑制中获益[16,38]。对于低危患者,推荐选择性雌激素受体调节剂类药物;中危患者应接受包含卵巢功能抑制治疗,卵巢功能抑制联合选择性雌激素受体调节剂或芳香化酶抑制剂均为可行方案;高危患者更能获益于卵巢功能抑制联合芳香化酶抑制剂,考虑因素包括累及≥4枚淋巴结、≤35岁、组织学分级为3级或多基因检测提示高复发风险[39]。
2.疗程选择:
2011年EBCTCG Meta分析再次证实,与无内分泌治疗比较,激素受体阳性患者行三苯氧胺治疗5年远期获益更明显[40]。三苯氧胺治疗10年较三苯氧胺治疗5年可降低乳腺癌远期复发率,但年轻乳腺癌患者增加子宫内膜癌的发生风险尚缺乏足够的证据;鉴于绝经后的数据,以及同时延长内分泌治疗会延迟生育,甚至错过最佳生育年龄,需要综合考虑利弊,慎重选择[41,42]。同时,三苯氧胺长期应用的患者应每3~6个月监测子宫内膜厚度,绝经前患者内膜厚度不是决定活检的指征,>12 mm建议行孕激素治疗等专科处理。
3.卵巢功能抑制:
卵巢功能抑制主要有3种方式,分别为手术去势、放疗去势和药物去势。卵巢手术去势可以快速而有效地降低雌激素至绝经后水平,但手术去势的缺点是有创且不可逆,会导致年轻女性的生育能力永久丧失[43];放疗去势在临床容易实施且费用低廉,但缺点是20%~30%会出现去势不完全,并且产生盆腔放疗不良反应,因此,临床上使用受到限制[43]。而药物去势具有损伤少、不良作用低和停药后可逆性等优点,成为绝经前乳腺癌内分泌治疗的首选方式。
SOFT研究显示,接受化疗的患者在末次化疗后8个月内确认绝经前状态后,再接受卵巢功能抑制,但是大部分化疗后观察卵巢恢复时间长达6~8个月,这会造成部分患者丧失尽早接受卵巢功能抑制联合芳香化酶抑制剂治疗的机会[44]。因此,GnRHa可以在化疗结束后直接序贯使用,已接受化疗的患者不推荐确认卵巢功能状态后再使用GnRHa。有研究显示,GnRHa同步化疗不影响患者的生存获益[44,45,46,47]。
GnRHa的最佳疗程目前尚无定论。既往2~3年疗程的临床研究均证实了GnRHa良好的安全性和耐受性[48,49,50,51,52]。而TEXT和SOFT研究则选择了5年疗程。因此,建议GnRHa辅助内分泌治疗的疗程为2~5年,若GnRHa联合芳香化酶抑制剂,基于SOFT&TEXT研究应选择5年。延长内分泌治疗可能延迟生育时机,需综合衡量利弊。使用GnRHa每月剂型与3月剂型的病理生理和临床结局相似,因此,3个月剂型也是一种合理选择[53]。
4.药物相关不良反应及处理:
既往研究显示,接受三苯氧胺治疗的患者有较多的妇科症状,如潮热、阴道分泌物增加和子宫内膜增厚等,以及较多的心血管事件,如血栓形成等;而接受芳香化酶抑制剂治疗的患者骨折和关节痛的发生率更高,但两组患者的生活质量没有显著差异[54,55]。芳香化酶抑制剂联合卵巢功能抑制组多见骨质疏松、骨折、阴道干燥等;三苯氧胺联合卵巢功能抑制组多见血栓形成症状、潮热和夜汗。早期的治疗中断率在依西美坦联合卵巢功能抑制治疗组更多见[45,56]。
虽然不良事件基于患者自述报告,可能存在差异,但接受三苯氧胺或依西美坦治疗的两组患者的总体生活质量相似。应与患者充分沟通可能发生的不良事件,选择合适的内分泌治疗方案;积极处理不良事件,改善患者生存质量,提高患者依从性(表1)。

表1 含GnRHa辅助内分泌治疗安全管理治疗推荐
五、生育管理相关内容
1.生殖咨询的时机和内容:
肿瘤科医师应尽早与育龄期乳腺癌患者及其配偶讨论生育功能保护的方案,并在必要时转诊至妇科或生殖科医师。应在肿瘤治疗前尽早告知肿瘤治疗可能对生育力产生的不良影响,使其有可能尽早选择适合的生育力保护方案,并最大限度减少因生育力下降或丧失引起的抑郁等心理问题,提高生活质量。
对于具有生育需求的患者,治疗的每一阶段均应与患者讨论生育相关信息。患者治疗结束后随诊和(或)考虑妊娠时,应再次讨论生育力相关问题或转诊至妇科或生殖专家。讨论均应记录于病历中[17,18]。
推荐多学科共同对年轻女性的生育力下降风险和可选择的保护方法提供咨询,为这些患者在选择方法时提供心理支持,同时充分告知不同技术的风险[17,18]。有研究显示,接受过抗肿瘤治疗后的患者,妊娠不增加早期乳腺癌复发风险,胎儿先天畸形和基因疾病也无明显增加[17,18,57]。
虽然乳腺癌辅助内分泌治疗导致更多年轻患者进一步推迟妊娠时间,甚至错过最佳生育时机,但是不推荐患者为生育而中断规范的内分泌治疗。对于因生育中断内分泌治疗的患者,在完成生育后,应要求患者继续完成剩余的内分泌治疗。在实施生育计划前,应与肿瘤医师充分讨论肿瘤复发风险[17,18]。实施生育计划时,首选自然妊娠,难以自然妊娠者可进行辅助生育技术,但需要考虑患者身体状况能否耐受有创性操作[17,18]。
2.妊娠时机:
最佳的怀孕时机无法准确预测,需个体化地综合考虑年轻患者的身体状况、乳腺癌病理特点和肿瘤复发危险度[37]。避孕方式建议采用工具或不含孕激素的宫内节育器,禁用激素类避孕药。建议年轻乳腺癌患者超过复发高峰年限后再考虑怀孕。一般认为辅助化疗结束后2~3年可以考虑怀孕,但高风险患者或需要长期辅助内分泌治疗的患者,这一建议时间需延长至5年或更久。为避免抗肿瘤治疗对胎儿的健康风险,一般建议在停止抗肿瘤治疗>6个月再实施生育计划。如发生非预期意外怀孕,妇产科和肿瘤科医师应综合评估患者的肿瘤治疗情况、怀孕前3个月内用过抗肿瘤药物的情况,充分考虑妊娠对肿瘤治疗的影响和治疗药物对胎儿可能的影响,患者及家属应充分知情同意,共同决定是否继续妊娠。若选择继续妊娠,应严密监测胎儿发育情况,孕期应同时在乳腺科严密随访。对于未完成内分泌治疗疗程的患者,强烈建议患者在分娩后继续完成内分泌治疗方案。
3.生育力保护技术:
生育力保护技术涉及药物、手术或冷冻技术等不同的助孕方法。目前,可选择的方法有卵母细胞冷冻、胚胎冷冻、卵巢组织冷冻保存与移植、未成熟卵母细胞体外成熟保存和GnRHa类药物。
对于已婚且婚姻关系稳定家庭,胚胎冷冻是最成熟的生育力保护方案,常规用于体外受精后多余胚胎的保存。胚胎冷冻已开展30年,是生育力保存的最常见技术,应用患者卵子和伴侣精子受精。胚胎冷冻适用于已婚、双方均同意体外受精并保存胚胎的患者;未来生育治疗时需要双方共同同意应用冷冻胚胎。冻融胚胎移植活产率与女性取卵时年龄相关。移植化疗和(或)放疗前冷冻胚胎的活产率与年龄相匹配对照组的成功率相近[17,18,57]。
卵母细胞冷冻技术适用于未结婚或其他原因无法选择胚胎冷冻、而且需要进行有损卵巢功能的放疗和化疗或行卵巢切除术的女性恶性肿瘤患者。玻璃化冷冻技术明显提高卵母细胞冷冻的成功率。卵母细胞玻璃化冷冻的结果依赖于冷冻卵母细胞的数量和冷冻时患者的年龄,应用这种冷冻技术,每个复苏卵母细胞的活产率约为6.4%[17,18,56]。参照原国家卫生部于2003年6月27日颁布的《人类辅助生殖技术规范》和《人类辅助生殖技术和人类精子库伦理原则》等文件[58,59],目前认为仅从法律法规角度考虑,单身女性因肿瘤治疗要求冷冻卵细胞保存生育力并不违规[60]。
未成熟卵母细胞体外培养成熟技术(in vitro maturation, IVM)是辅助生殖技术中用于治疗多囊卵巢综合征、卵巢反应不良和激素依赖性肿瘤不适宜行常规促排卵治疗的新技术。由于IVM复杂仅在部分辅助生殖技术中心开展,在肿瘤保留生育功能中主要用于无法延迟肿瘤治疗的患者[17,18,61]。未成熟卵母细胞可在月经周期任何时间取卵,减少患者进行超促排卵方案的经济与时间花费,避免卵巢过度刺激综合征的发生。但经体外培养后成熟的卵母细胞与成熟卵母细胞相比,着床率更低,可将IVM与卵巢组织冻存联合应用。目前国内IVM已应用于临床。
卵巢组织冻存和移植无需卵巢刺激,可立即进行无需性成熟,因此是儿童唯一可选择的生育力保护方法;卵巢组织移植成功后不仅可以恢复部分生育能力,也可以在一段时间内恢复卵巢的内分泌功能[17,18,62]。另外,卵巢组织冻存技术不会增加体内雌激素水平,适用于年轻乳腺癌患者。该技术发展迅速,在欧洲如德国等发达国家已逐渐成为临床常规,在我国已初步应用于临床。而且,卵巢组织冻存和IVM同时应用,可提高该技术在乳腺癌患者中应用的可能性[61]。
以上生育力保护方法的远期有效性与安全性仍需进一步临床研究和远期随访的证实[17,18,63]。患者应被告知,卵母细胞冻存、胚胎冻存前进行的卵巢刺激可提高体内雌激素水平,有可能促进肿瘤细胞快速增殖。目前,应用较广的以芳香化酶抑制剂为基础的刺激方案,可减少上述情况的发生率。多项研究显示,添加芳香化酶抑制剂的卵巢刺激方案和后续妊娠未增加肿瘤复发风险[17]。目前,在乳腺癌患者中,为降低卵巢刺激方案造成的体内雌激素水平升高,更推荐采用控制性卵巢刺激方案[17,18,64,65,66,67,68]。这种方案中从控制性卵巢刺激至取卵大约需2周,取卵后48 h可开始化疗。在多数患者中,这种方案的启动时机已不再依赖月经周期,与传统的促性腺激素刺激方案比较,延误时间更少,但其安全性、有效性需要进一步研究[18]。
在年轻乳腺癌患者中,若无法实施标准生育力保护方案,可在化疗前和化疗过程中给予GnRHa进行短暂的卵巢抑制,以期降低化疗引起的卵巢功能不全,对卵巢功能保护有一定作用。推荐化疗前2周开始使用GnRHa,每月1次,直至化疗结束后2周给予最后一剂药物。但是目前,对于GnRHa用于生育力保护尚存争议,GnRHa不应取代明确有效的生育力保护方案[17,18]。
六、诊疗与生育管理流程
年轻乳腺癌患者面临特有的身体、社会和心理问题,其诊治方案及生育管理计划应该由多学科会诊、跨学科讨论协商制定,包括乳腺内科、外科、放疗科、妇产科、生殖科、肿瘤心理学科和乳腺专科护士等。在确诊乳腺癌之后、制定抗肿瘤方案(包括手术、化疗和内分泌等)之前,所有年轻女性患者均应该明确是否有生育要求,并进行卵巢功能评估。所有想保留生育能力的女性,在开始任何治疗前,均应向相关专家咨询。患者应被告知生育管理的可行性及其对乳腺癌治疗的影响,治疗相关闭经和过早绝经的风险、相关症状和结局,可替代治疗方案,以及抗肿瘤治疗后的生育管理随访及助孕指导。
专家组推荐,年轻乳腺癌患者诊疗与生育管理流程如图1所示。
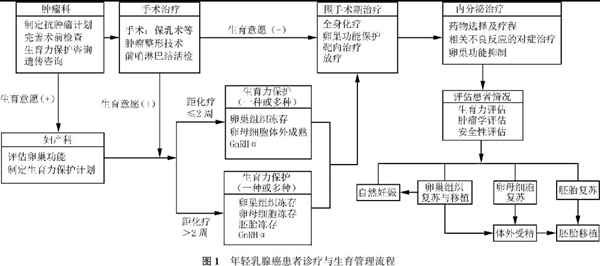
图1 年轻乳腺癌患者诊疗与生育管理流程
参考文献略
 妇产科在线APP下载
妇产科在线APP下载













