摘要
阻断母婴传播是消除乙型肝炎病毒(hepatitis B virus,HBV)感染的关键环节。由中华医学会感染病学分会发起,联合多学科专家,基于系统评价证据,结合患者意愿,采用评估、制订和评价(Grades of Recommendation, Assessment, Development,and Evaluation,GRADE)分级,遵循RIGHT报告标准,制订我国首部循证HBV母婴传播防治指南,以期为临床医师和妇幼保健相关人员提供围产期监测、干预和新生儿免疫的决策依据。
母婴传播是HBV感染的最主要传播途径。新生儿期感染后,90%以上表现为慢性感染[1],是家族聚集性HBV感染的主要原因[2]。母婴传播聚集性家族中,感染子代患肝硬化、肝癌风险显著升高,且发病年龄逐代提前[3]。阻断母婴传播可显著降低HBsAg流行率,是降低HBV相关疾病负担的关键。
在乙型肝炎疫苗广泛接种之前,我国HBV母婴传播率约为50%,在HBeAg阳性孕妇中高达72%~91%[4]。新生儿接受乙型肝炎疫苗联合乙型肝炎免疫球蛋白(hepatitis B immunoglobulin,HBIG)后,母婴传播率降至6%,但在HBeAg阳性高病毒载量孕妇中仍高达11%[4]。妊娠期抗病毒治疗进一步显著降低了高病毒载量孕妇的母婴传播,但抗病毒治疗的阈值、药物选择、起始时间和停药时机等问题仍存在诸多争议。
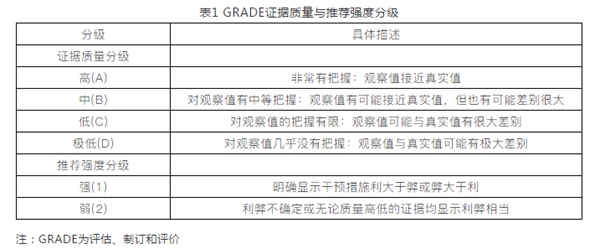
制订符合中国国情、多学科共同参与且结合患者意愿的循证HBV母婴传播防治指南,对规范防治措施、提高我国HBV母婴传播预防水平起到重要的作用。鉴于此,中华医学会感染病学分会遵循国际指南制订方法和步骤,基于当前最佳证据,综合感染科、肝病科和妇产科等多学科专家临床经验,平衡干预措施的利弊,制订本指南,指导HBV母婴传播的防治(图1)。本指南中的证据质量和推荐意见分级采用评估、制订和评价(Grades of Recommendation, Assessment, Development,and Evaluation,GRADE)分级系统[5],证据质量分为A、B、C和D四个级别,推荐意见分为强推荐(1)和弱推荐(2)两个级别。见表1。
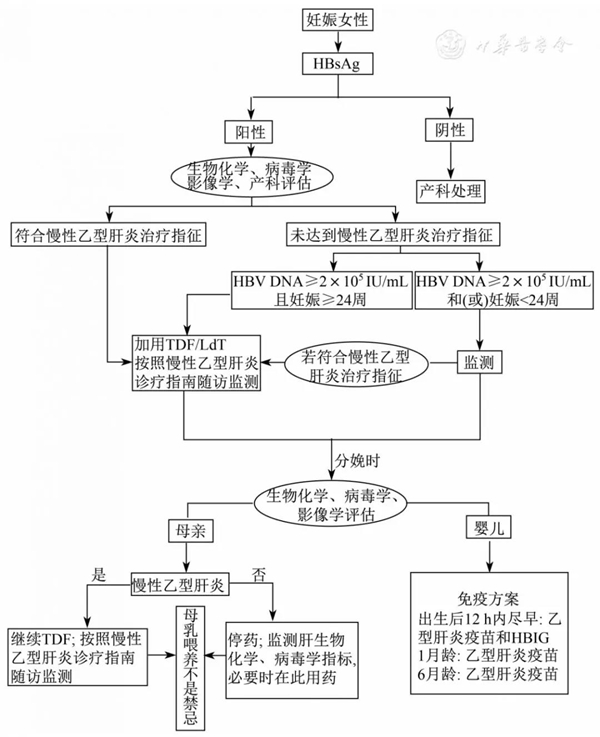
注:HBsAg为乙型肝炎病毒表面抗原;HBV为乙型肝炎病毒;TDF为富马酸替诺福韦二吡呋酯;LdT为替比夫定;HBIG为乙型肝炎免疫球蛋白
图1 乙型肝炎病毒母婴传播防治流程
表1 GRADE证据质量与推荐强度分级
推荐意见1:婴儿7~12月龄静脉血检测HBsAg和(或)HBV DNA阳性,可诊断发生母婴传播(1B)。
HBV母婴传播率由于检测标本、时间和诊断标准的不一致而存在明显差异。目前,大多数研究将婴儿6月龄或7月龄HBsAg和(或)HBV DNA阳性作为发生母婴传播的标准,但缺乏系统评价支持。网状meta分析和系统评价结果显示,新生儿出生24 h内静脉血或脐带血HBsAg和(或)HBV DNA阳性率显著高于6月龄、7月龄或12月龄时静脉血检测结果[6],表明出生时HBsAg和(或)HBV DNA阳性并不能说明发生了母婴传播,可能是母血污染导致的假阳性,或生产时胎盘剥离造成新生儿体内短暂病毒血症[7,8],6月龄、7月龄和12月龄3个时间点之间差异无统计学意义[6],因此建议在完成免疫计划后随访确定是否发生母婴传播。如果超过12月龄首次就诊检测HBsAg和(或)HBV DNA阳性,也应诊断发生了母婴传播。
推荐意见2:HBV DNA≥2×105 IU/mL的孕妇,推荐口服抗病毒药物以阻断母婴传播(1B);1×104 IU/mL≤HBV DNA<2×105 IU/mL时,可与患者充分沟通后决定是否干预(2C)。
母亲高病毒载量与HBV母婴传播密切相关[9],目前对于妊娠期抗病毒治疗的HBV DNA阈值尚未达成共识且未有系统评估证据[10,11,12]。系统评价结果显示,慢性HBV感染孕妇分娩前HBV DNA<1×104 IU/mL、1×104 IU/mL~1×105 IU/mL、1×105 IU/mL~1×106 IU/mL、1×106 IU/mL~1×107 IU/mL、1×107 IU/mL~1×108 IU/mL、≥1×108 IU/mL时,母婴传播率分别为0、0.88%、1.15%、4.81%、10.04%和18.80%,与病毒载量呈正相关[4]。分娩前孕妇HBV DNA≥1×106 IU/mL时,发生母婴传播的风险显著高于HBV DNA<1×106 IU/mL的孕妇,循证医学证据表明HBV DNA≥1×106 IU/mL为最合适的干预阈值。
2017年欧洲肝病研究学会(European Association for the Study of Liver Diseases,EASL)HBV感染临床实践指南、2018年美国肝病研究学会(American Association for the Study of Liver Diseases,AASLD)慢性乙型肝炎防治指南和2019年中国慢性乙型肝炎防治指南建议,HBV DNA≥2×105 IU/mL的孕妇口服抗病毒药物进行阻断[11,12]。为最大程度阻断母婴传播,本指南推荐HBV DNA≥2×105 IU/mL时,妊娠期口服抗病毒药物进行阻断;当1×104 IU/mL≤HBV DNA<2×105 IU/mL时,仍存在一定的母婴传播风险,特别对有HBV感染家族史、一胎感染史者,可与患者充分沟通,权衡利弊后决定是否口服抗病毒药物进行干预。
推荐意见3:推荐妊娠期服用富马酸替诺福韦二吡呋酯(tenofovir disoproxil fumarate,TDF)或替比夫定阻断母婴传播(1B);对拉米夫定或替比夫定经治、耐药者,推荐TDF治疗(1B)。
在动物试验中未发现TDF和替比夫定的生殖毒性。大量研究表明,妊娠期接受TDF或替比夫定抗病毒治疗可进一步降低高病毒载量孕妇母婴传播的风险[8,13,14,15],二者的抗病毒效果及阻断效率无明显差异,孕妇血肌酐异常、产后出血和剖宫产率及婴儿出生缺陷、早产率等不良事件的风险与普通人群差异无统计学意义[16]。妊娠期接受替比夫定治疗的孕妇所生婴儿5年不良事件发生率与普通人群无差异[17]。因此,推荐高病毒载量孕妇服用TDF或替比夫定以阻断母婴传播。
拉米夫定或替比夫定抗病毒治疗存在较高耐药率,当耐药产生后换用TDF是最优治疗方案[18]。有队列研究表明,对拉米夫定耐药的孕妇给予TDF治疗仍可获得良好的阻断效果[19]。对于拉米夫定或替比夫定经治、耐药的孕妇,推荐给予TDF阻断母婴传播。
在动物试验中未发现富马酸丙酚替诺福韦(tenofovir alafenamide,TAF)生殖毒性,HIV感染孕妇临床应用TAF安全性良好[20],欧洲及中国版说明书中表明"如有必要,可考虑在妊娠期间使用",正在进行的临床研究将提供高级别的循证医学证据。
推荐意见4:HBV DNA≥2×105 IU/mL的孕妇,建议妊娠24~28周期间开始服用抗病毒药物以阻断母婴传播(2C)。
目前,孕妇不同用药时机有效性及安全性的系统评价证据尚且缺乏。贝叶斯网状meta分析和系统评价结果表明,妊娠28周以前进行干预与28周及以后进行干预相比,前者母婴传播风险明显降低(RR=0.019, 95%CI:0.000 34~0.19);均未见孕妇及婴儿不良事件发生率的异常升高[21]。少数队列和病例对照研究显示,孕24~28周接受抗病毒治疗能有效阻断母婴传播[13,14,15,22,23]。对于HBV DNA≥2×105 IU/mL的孕妇,建议妊娠24~28周期间开始抗病毒治疗阻断母婴传播。28周以后首次就诊的高病毒载量孕妇,签署知情同意后,立即开始抗病毒治疗。对于1×104 IU/mL≤HBV DNA<2×105 IU/mL,有HBV感染家族史、一胎感染史者的孕妇,如已决定抗病毒,建议28周内启动抗病毒治疗。
推荐意见5:抗病毒治疗期间意外妊娠者,若服用TDF或替比夫定,建议继续妊娠(2B);若服用阿德福韦酯(adefovir dipivoxil,ADV)或恩替卡韦,可不终止妊娠,建议更换为TDF治疗(2C);若正在接受干扰素治疗,建议向孕妇和家属充分告知风险,由其决定是否继续妊娠,如继续妊娠应换用TDF治疗(2C)。
妊娠期采取TDF、替比夫定抗病毒治疗总体安全性良好。系统评价显示,妊娠期接受(暴露)核苷(酸)类似物的孕妇所生婴儿出生缺陷率为0.66%[24],低于我国(5.6%)[25]和美国亚特兰大市先天性缺陷计划(2.8%)[26]的出生缺陷率。因此,对于TDF或替比夫定治疗期间意外妊娠者,建议继续妊娠。
系统评价显示,纳入现有研究及抗反转录病毒药物妊娠登记网站中报告的病例,ADV或恩替卡韦暴露的慢性HBV感染孕妇所生婴儿出生缺陷率不高于普通人群[24]。因此,ADV或恩替卡韦治疗过程中意外妊娠的女性可不终止妊娠。但体外毒理和动物试验显示,妊娠期大剂量应用ADV、恩替卡韦有导致突变、出生缺陷的风险。所以,如继续妊娠,建议更换为TDF继续治疗。
妊娠期干扰素暴露的安全性存在争议[27,28]。恒河猴妊娠期接受高于推荐治疗剂量90~180倍的干扰素时,流产率显著增加,但未观察到致畸作用。部分指南建议孕妇禁用干扰素,干扰素治疗期间禁止妊娠[11,29,30],但均未涉及干扰素治疗期间意外妊娠后的处理。病例报告显示,妊娠期暴露于干扰素的特发性血小板增多症、多发性硬化症孕妇不良事件发生率与普通孕妇相比差异无统计学意义[31,32,33,34]。妊娠早期暴露于干扰素的慢性HBV、HCV感染孕妇,未发现严重不良事件[27,35,36]。拜耳保健全球药物警戒线数据库(Bayer Health Care′s global pharmacovigilance database)1 045例干扰素暴露孕妇的统计数据显示,妊娠期不良事件并未明显增多[34,37]。本指南经充分评估干扰素毒理学、临床病例报告结果和产科专家意见,建议向孕妇及家属充分告知相关风险,由其决定是否继续妊娠,继续妊娠者应及时更换为TDF进行治疗。
推荐意见6:妊娠期肝脏生物化学指标异常者,若HBV DNA<2×105 IU/mL、ALT<2×正常值上限(upper limit of normal value,ULN)时,建议随访监测(2C);若评估后符合CHB抗病毒治疗指征的孕妇,按照CHB防治指南进行治疗、随访及监测(1C)。
约10%慢性HBV感染孕妇妊娠期出现ALT水平波动,绝大部分仅表现为轻度升高[38,39]。对于HBV DNA<2×105 IU/mL、ALT正常或仅轻度异常(ALT<2×ULN)、无肝硬化表现的孕妇,基于现有研究建议暂不处理,随访观察[39,40]。ALT轻度异常的慢性HBV感染者仍有疾病进展风险,近年来倾向于放宽其抗病毒治疗指征[11],但妊娠期此类人群抗病毒治疗指征是否扩大需要更多证据支持。
当2×ULN≤ALT<5×ULN时,应密切观察。如果出现ALT持续升高,或≥5×ULN时,排除其他可能导致ALT升高的因素后,综合其他检测指标,提示处于肝炎活动期,建议符合CHB抗病毒治疗指征者采用TDF治疗,按照CHB防治指南[11,41]随访、监测。对于重度肝纤维化、肝硬化孕妇,不论ALT水平如何,均应进行抗病毒治疗。
推荐意见7:妊娠期口服抗病毒药物的孕妇,如果肝生物化学指标正常,建议在抗病毒治疗后4周以及分娩前监测肝生物化学指标和HBV DNA(2C);如果肝生物化学指标异常,建议抗病毒期间按照CHB患者监测,增加监测频率,密切随访(2D);服用TDF期间还需监测肾功能和血磷,服用替比夫定期间需同时监测肌酸激酶(2C)。
妊娠期抗病毒治疗后监测的时间点和检测项目尚无共识。系统评价结果显示,妊娠期抗病毒治疗的前4周HBV DNA快速下降(平均3.16 lg IU/mL, 95%CI:2.97~3.35 lg IU/mL)[42],可根据抗病毒治疗4周后HBV DNA下降水平来评判抗病毒效果,建议分娩前再次检测,综合评估母婴传播风险。
长期TDF治疗有潜在发生肾损伤及骨代谢异常风险[43],替比夫定治疗期间有发生肌酸激酶升高的风险[44],因此,建议孕妇服用TDF期间监测肾功能和血磷,服用替比夫定期间监测肌酸激酶。
推荐意见8:慢性HBV感染不孕症女性,行辅助生殖后的卵裂率、种植率、临床妊娠率和流产率等与非HBV感染者相比差异无统计学意义,建议可正常进行辅助生殖,妊娠期常规进行母婴阻断及随访(2C)。
HBV感染对辅助生殖过程中胚胎发育及妊娠结局的影响尚不明确,慢性HBV感染不孕症女性行辅助生殖后母婴传播的研究有限。既往病例对照研究显示,慢性HBV感染不孕症女性患者行辅助生殖后的受精率、卵裂率、优质胚胎率和临床妊娠率低于非HBV感染者[45]。当HBV DNA≥5×102 IU/mL时,卵巢储备功能低下风险更高,受精率和优质胚胎数随病毒载量的增高而降低[46,47]。系统评价结果表明,女性为慢性HBV感染者的不孕症夫妇与双方均为非HBV感染不孕症夫妇进行辅助生殖比较,仅受精率偏低,两者的卵裂率、优质胚胎率、种植率、胚胎着床率、临床妊娠率和流产率均差异无统计学意义[48]。因此,慢性HBV感染的不孕症女性可正常进行辅助生殖。妊娠成功后,妊娠期进行常规随访,根据肝功能、病毒定量等制定相应阻断策略。
推荐意见9:对于HBV DNA≥1×106 IU/mL的孕妇,羊膜腔穿刺术会增加胎儿发生宫内感染的风险,妇产科医师评估后若获益显著,可行羊膜腔穿刺术;HBV DNA<1×106 IU/mL的孕妇,权衡利弊后可行羊膜腔穿刺术(2B)。
已有系统评价结果显示,HBV DNA<1×106 IU/mL时,行羊膜腔穿刺术未增加母婴传播风险;而HBeAg阳性、HBV DNA≥1×106 IU/mL孕妇行羊膜腔穿刺术,母婴传播的风险增加3.41~9.54倍[49]。2018年AASLD的CHB防治指南也提出,羊膜腔穿刺术可能会增加HBV DNA≥1×106 IU/mL孕妇的母婴传播的风险[12]。对于HBV DNA低复制孕妇,签署知情同意后可考虑行羊膜腔穿刺术;对于高病毒载量孕妇,为诊断胎儿染色体病及遗传性疾病,妇产科医师评估后若获益显著,可考虑行羊膜腔穿刺术。
推荐意见10:对妊娠期未进行抗病毒阻断、分娩时HBV DNA≥2×105 IU/mL且存在胎儿窘迫、巨大儿和过期妊娠等情况时,孕妇有可能从剖宫产中获益(2C)。
在妊娠期密切监测和有效抗病毒干预后,分娩方式不影响HBV母婴传播。但对于妊娠期未监测及抗病毒阻断、分娩时HBV DNA≥2×105 IU/mL的孕妇,系统评价显示,剖宫产可降低母婴传播的风险(RR=0.41, 95%CI:0.25~0.67, P<0.01)[50]。对于这类人群,若存在胎儿窘迫、巨大儿和过期妊娠等剖宫产相对指征时,孕妇可能从剖宫产中获益。
推荐意见11:妊娠期以母婴阻断为目的进行抗病毒治疗者,产后立即、4周或12周停药不影响ALT异常率(2C);停药后病毒反弹、伴有肝生物化学指标异常者,建议参照CHB患者处理(2C);妊娠期因肝炎活动接受抗病毒治疗者,产后继续治疗,监测、停药标准参照CHB患者(2D)。
产后母体各系统器官发生一系列变化。目前,对以母婴阻断为目的抗病毒治疗、孕妇产后停药安全性尚存在疑虑,何时停药观点不一[11,12,51]。研究表明,不论妊娠期是否抗病毒干预,约20%慢性HBV感染孕妇产后出现ALT波动,表现为产后1个月和3个月的"双峰波动模式",大多能够自行恢复[38,39,52,53]。网状meta分析显示,产后持续用药、立即停药、4周停药、或12周停药与未抗病毒者相比,ALT异常率差异均无统计学意义,且大多数能够自行恢复[54]。因此,产后不同时间点停药不影响ALT异常率,可考虑停药。产后停药后HBV DNA出现不同程度反弹,建议密切监测,是否再次抗病毒治疗,参照CHB患者处理[11,41]。
研究表明,妊娠期ALT波动是产后ALT异常的独立危险因素[53],也有研究报道了停药后出现重症化倾向的个案[55],对妊娠期因肝炎活动接受抗病毒治疗的慢性HBV感染孕妇,建议产后继续用药,监测、停药标准参照CHB患者处理。
推荐意见12:慢性HBV感染孕妇所生婴儿在接受联合免疫治疗后,可以母乳喂养(2B);产后继续应用TDF治疗者,可以母乳喂养(2C)。
关于慢性HBV感染母亲所生婴儿的母乳喂养的推荐意见证据不充分。系统评价结果表明,慢性HBV感染孕妇所生婴幼儿接受联合免疫后,母乳喂养不会增加婴幼儿HBV感染的风险(RR=0.73, P=0.21)[56]。虽有研究表明,乳汁中病毒载量与母亲病毒载量呈正相关[57];但高病毒载量母亲母乳喂养并不增加婴幼儿HBV感染风险[58,59]。鉴于母乳喂养获益明显,建议慢性HBV感染孕妇所生婴儿在接受联合免疫后母乳喂养。
哺乳期间服用TDF的HIV感染者,母乳及婴幼儿体内TDF剂量分别为建议婴幼儿口服剂量的0.03%和0.01%[60,61,62],哺乳期间服用TDF的慢性HBV感染母亲的婴儿体内未检测到替诺福韦[63],且母体血液和乳汁中有效成分为替诺福韦,几乎不经肠道吸收,因此产后继续应用TDF治疗者可以母乳喂养。替比夫定继续治疗者母乳喂养安全性的研究数据有限。
推荐意见13:慢性HBV感染孕妇所生婴儿应在出生12 h内尽早完成乙型肝炎疫苗和100 IU HBIG的联合免疫,并在1月龄和6月龄分别接种第2针和第3针疫苗(1A);所生早产儿或低出生体质量儿,若生命体征稳定则在出生12 h内尽早完成联合免疫,满1月龄后,再按0-1-6月程序接种3针疫苗;若生命体征不稳定,应在生命体征平稳后尽早接种第1针疫苗(1A)。
联合免疫是阻断HBV母婴传播的重要措施。国家免疫计划及多部指南建议,新生儿在出生12 h内接种乙型肝炎疫苗(10 μg重组酵母疫苗或20 μg重组CHO疫苗)和HBIG,按0-1- 6月程序接种3剂乙型肝炎疫苗;早产儿或低出生体质量儿除出生12 h内接种乙型肝炎疫苗和HBIG外,满1月龄后,还需按0-1- 6月程序接种乙型肝炎疫苗(即0-1-2-7);危重症新生儿,如极低出生体质量儿、严重出生缺陷、重度窒息和呼吸窘迫综合征等,应在生命体征平稳后尽早接种第1剂乙型肝炎疫苗[12,64,65,66,67]。系统评价结果表明,HBeAg阳性、HBV DNA≥1×106 IU/mL孕妇所生婴儿接种200 IU HBIG的阻断效率并不优于100 IU HBIG(RR=1.16, P=0.41)[68]。考虑经济效益成本,推荐慢性HBV感染母亲所生新生儿接种100 IU HBIG。
对于慢性HBV感染母亲所生婴儿是否需要加强疫苗接种尚无共识。系统评价结果表明,慢性HBV感染母亲所生婴儿与普通婴儿疫苗应答率差异无统计学意义[69]。鉴于这些婴儿处于HBV感染高危环境,建议定期检测其抗-HBs水平,必要时加强免疫。
指南形成说明
本指南由中华医学会感染病学分会发起和负责制订,由GRADE中国中心/兰州大学循证医学中心提供方法学与证据支持。2017年10月21日在陕西省西安市召开指南启动会,2019年6月21日在汉中市定稿。本指南的制订步骤主要基于2014年WHO发布的《世界卫生组织指南制订手册》[70]以及2016年中华医学会发布的《制订/修订<临床诊疗指南>的基本方法及程序》[71],同时依据指南研究与评价工具Ⅱ(Appraisal of Guidelines for Research and EvaluationⅡ,AGREEⅡ)[72]和卫生保健实践指南的报告条目(Reporting Items for Practice Guidelines in Healthcare, RIGHT)制作及报告指南全文[72,73,74]。
参考文献:略
 妇产科在线APP下载
妇产科在线APP下载













