宫颈肿瘤的自然病史
人乳头瘤病毒(HPV)分为两类:1)致癌型(高危型)和2)非致癌性。感染高危型HPV通常是宫颈鳞癌的的必要非充分条件。因此,只有一小部分感染高危型HPV的人会进展为明显的宫颈病变和癌。绝大多数HPV感染都是一过性的,进展的风险较小。仅有小部分感染会持续存在,但是初始感染1年和2年后感染仍然持续强烈预示着发生CIN3或癌的潜在风险增加。
何种因素决定了哪种HPV会发生持续性感染还不完全清楚。HPV的基因型似乎是决定持续感染和病情进展的最重要因素。HPV-16具有最强的致癌能力,全世界55-60%的宫颈癌和它有关。HPV-18是第二常见的致癌类型并且和10-15%的宫颈癌相关。大约还有12种类型的HPV和剩余的宫颈癌病例有关。已知的能够增加HPV持续感染的因素包括:吸烟、免疫系统功能抑制和HIV病毒感染。HPV感染在青少年和早期20-30岁年龄段的女性中最常见,24-27岁区间流行率降低。大多数青年女性,尤其21岁以下的女性,能够产生有效的免疫反应,从而在平均8个月的时间里清除病毒或者在8-24个月内将病毒载量降低到无法测出的水平。随着感染的清除,该人群的绝大多数宫颈瘤变也将自发消失。
30-65岁人群HPV感染后的自然病史和年龄似乎不相关。无论30岁还是以上年龄的女性,新感染的HPV依旧较少可能变成持续性感染。但是,30岁以上才发现的HPV感染更可能反映的是持续感染。这一点和年龄愈大、发生HISIL的几率越高也是相符的。
低级别瘤变(或CIN1)反映了急性HPV感染,有很高的比率可自然消退到组织学正常状态,所以目前的推荐是观察而不是治疗。CIN2的临床处理还有争议,因为准确诊断和理想的处理方案都尚存挑战。CIN2的诊断存在高度的观察者间变异。另外,CIN2的预后似乎反映了低级别和高级别病变共同混合作用的结果,而不是一种特殊的中间型病变。考虑到CIN2这一分类的局限性,ASCCP和美国病理学家协会将CIN2分为2个类型:低级别鳞状上皮内病变(LSIL)和HSIL。在一组未经治疗的CIN3患者队列中,30年浸润癌累计发生率为30.1%,这一点证明CIN3有进展为癌的明确风险。
在评估合适的筛查间隔时,考虑疾病的进展时间是很重要的。大多数HPV相关的宫颈肿瘤进展缓慢。CIN3进展到癌的明确时间还不明确,但是从筛查发现CIN3的年龄和癌发生的年龄之间的差异达到10年,提示癌前状态的持续时间比较长。这一点支持采用较低频的筛查策略(如间隔>1年)。
宫颈细胞学筛查技术
液基技术和传统细胞学采集方法对于筛查而言是可接受的。采集来自宫颈移行带的脱落细胞并将其转移到含有保存液的小管中然后送检到实验室(液基技术),或者直接将细胞转移到玻片上固定(传统技术)。血液、分泌物、某些润滑剂(包括患者自行使用的润滑剂)可能干扰对标本的判读。和单纯使用水相比,阴道窥具使用少量的以水为基质的润滑剂能够减轻检查时的不适,至少有一家厂商具有不含影响结果判读的润滑剂产品列表。如果使用水为基质的润滑剂,应该尽量减少接触宫颈的机会并使用厂商推荐的润滑剂产品。少量水溶性润滑剂不会降低宫颈细胞学检测结果的质量。4项发表的随机对照研究显示少量润滑剂对传统的细胞学检测那个方法没有影响。在宫颈上使用大量的润滑剂(如宫颈外口形成1-1.5cm的润滑剂带)会影响标本细胞的数量,但这并非标准的临床操作。在一项包含4068例液基宫颈刮片检测的回顾性分析中,0.4%的标本存在造成结果错误解读的干扰物质,大约一半的这类杂质和润滑剂使用有关。
液基细胞采集方法的一大好处是通过单次采集标本就可以完成细胞学、HPV、淋球菌和支原体检测。液基技术除了一些好处以外,包括结果易于解释、可过滤杂质和血液成分、更少的标本不满意率,一项包含8个研究的meta分析没有发现液基技术和传统细胞学筛查技术在发现CIN的敏感性和特异性方面有明显差异。
细胞学检测结果报告
Bethesda报告系统在美国已经获得了广泛的采用。自1988年以来已经进行了3次修订。
2014年Bethesda宫颈细胞学报告系统
标本类型
传统检测(Pap刮片检查),液基技术,或其他采集方法
标本细胞数量
● 满意评价(描述颈管内/移行带成分存在或缺失以其他满意性指标,如血液成分、炎症
● 不满意评价(特殊原因)
——标本被拒绝或未被处理(特殊原因)
——标本被处理和检测,但是因为某个特殊原因不能满意地评价上皮异常
通用分类(最好有)
● 上皮内病变或恶性病变阴性
● 其他:见解释/结果(如45岁以上女性看到内膜细胞)
● 上皮细胞异常:见解释/结果(指明“鳞状细胞异常”还是“腺体细胞异常)
解释/结果
● 无上皮内病变或恶性病变(当没有肿瘤的细胞学证据时,在通用分类部分,或者解释/结果部分两者之一(或两者同时)报告上述情况,同时报告是否有微生物或其他非肿瘤发现)
——非肿瘤发现(最好进行报告,不限于下述列表)
● 非肿瘤性细胞改变
● 鳞状化生
● 角化改变
● 颈管化生
● 萎缩
● 妊娠相关改变
● 细胞反应性改变和下列有关
● 炎症(包括典型的修复)
● 淋巴细胞性(滤泡性)宫颈炎
● 放疗
● 宫内节育器
● 子宫切除术后的腺细胞状态
——微生物
● 滴虫
● 白色念珠菌形态一致的真菌性微生物
● 菌群改变提示细菌性阴道病
● 放线菌形态一致的细菌形态
● 单纯疱疹病毒导致的细胞形态改变
● 巨细胞改变导致的细胞形态改变
● 其他
——内膜细胞(≥45岁)(特别是当“鳞状上皮内病变阴性”时)
● 上皮细胞异常
——鳞状细胞
● 不典型鳞状细胞(ACS)
● 意义不明确(ASC-US)
● 不能排除高级别鳞状上皮内病变(HSIL)(ASC-H)
● 低级别鳞状上皮内病变(LSIL)(包含:人乳头瘤病毒/轻度异常/宫颈上皮内瘤变(CIN)1
● 高级别鳞状上皮内病变(HSIL)(包含:中-重度异常,原位癌,CIN2和CIN3)
● 合并浸润癌的征象(如果怀疑浸润时)
● 鳞状细胞癌
——腺细胞
● 不典型
● 颈管内细胞(未另做特殊说明)
● 内膜细胞(未另做特殊说明)
● 腺细胞(未另做特殊说明)
● 不典型
● 颈管内细胞,倾向于瘤变
● 腺细胞,倾向于瘤变
● 宫颈内原位腺癌
● 腺癌
● 颈管内
● 子宫内膜样
● 子宫外
● 未另做特殊说明
● 其他恶性肿瘤(特殊说明)
附加测试
提供测试方法的简要描述并报告结果,以便临床医生易于理解。
计算机辅助的宫颈细胞学解释
如果病例由仪器自动判读,特别说明仪器和结果。
附加于报告后的注释和建议(最好有)
建议应该明确,并且和专业组织发表的临床随访指南一致(可能需要包括相关文献)
人乳头瘤病毒检测
FDA已经批准了若干种检测宫颈HPV的方法。这些方法评估宫颈脱落细胞是否含有15-18种可能致癌的高危型HPV。大多数检测方法可检测13-14中最常见的高危型亚型。使用这些检测试剂盒的时候必须按照FDA批准的说明书、采用正确的方法、并且满足临床操作的特殊标准。液基细胞学和HPV检测必须使用FDA批准的专用标本收集液,因为未经批准的收集液在特殊情况下可能带来错误结果。HPV检测的指征如下:
● 决定细胞学结果为ASC-US的病例是否需要阴道镜检查(“反映性测试”)
● 30-65岁及以上女性宫颈癌细胞学筛查的附加检测(“联合测试”)
● 2014年FDA批准了一种HPV检测用于25岁及以上年龄女性的初始宫颈癌筛查
检测应该只用来测试是否存在高危型HPV。检测低危型HPV没有用处,不应该进行针对低危型HPV的检测。本文中所有涉及HPV检测的内容都是针对高危型的检测。主要协会的指南还包括了HPV检测的超说明书指征,但是这些超说明书指征应该仅限于那些主要协会颁布的、经过同行评议的指南。
人乳头瘤病毒分型
现有FDA批准的、商业化HPV-16、HPV-18或两者同时检测的试剂盒。指南支持在30-65岁女性Pap刮片阴性但是高危型HPV阳性的女性进行使用HPV分型。
人乳头瘤疫苗
宫颈癌疫苗靶向免疫最常见的致癌HPV病毒,成为宫颈癌预防的一级措施。在澳大利亚,以人群为基础的免疫计划实施良好,在3年内有效地降低了高级别宫颈异常的发生率。FDA已经批准了3种疫苗以有效地预防HPV感染:1)二价疫苗,覆盖HPV-16和18;2)四价疫苗,覆盖HPV-16、18、6和11;3)2014年批准9价疫苗,覆盖另外5种高危亚型。二价和四价疫苗在30%的病例中可保护除外HPV-16和18以外的其他高危亚型的致癌作用。九价疫苗覆盖大约20%的有额外5种高危亚型导致的感染。美国疾控中心和美国妇产科学会推荐9-26岁的女性接受疫苗接种。HIV感染的9-26岁女性也建议接种HPV疫苗。疾控中心鼓励女孩在暴露于HPV年龄到来前就进行HPV疫苗接种。然而,依旧有很多女性在暴露于HPV以后才获得了疫苗接种。据估计,大约在全面接种疫苗20年后才会出现宫颈癌发病率的显著下降。在这一天来临之前,宫颈癌筛查依旧是预防宫颈癌的最佳方法,且筛查建议和HPV疫苗的接种状态无关。
既往已接受3剂二价或四价疫苗接种的人群,不建议再接受9价疫苗接种。如果一个女性已经开始了HPV疫苗的系列接种过程,那么后续的接种步骤可以采用任何一种HPV疫苗产品。鉴于任何HPV疫苗都能提供高水平的保护作用,同时无免疫的女性存在病毒感染的风险,合适的患者应该及时接种任何易得的疫苗,不要因为为了某种特殊的疫苗类型而推迟接种。
宫颈癌预防和效益-风险平衡
保护宫颈癌发生是筛查的首要目的,但是随着疾病流行率的下降,其他因素在筛查决定过程中也变得同等重要。例如,侵入性诊断(如阴道镜和活检)的效果和对一些可自然消退病变的过度治疗会对费用和潜在的生育结局造成不利影响。另外,参与宫颈癌筛查项目的女性对HPV感染的焦虑也要重视。
在过去10年宫颈癌筛查指南已经经历了若干次修改,在这些不同的筛查策略中全生命周期的宫颈癌风险差别很小。因为大多数筛查发现的宫颈癌都是早期,所以由于生存概率很高所以预期寿命之间的差别更加微小。最近的筛查方法修改已经对HPV检测阴性预测值的效力和筛查间隔进行了平衡。现有筛查基于每3年进行宫颈细胞学筛查可获得基准肿瘤风险。更频繁的筛查可以降低癌症风险,但是可能带来更多的诊断操作、患者不适、费用和其他筛查的危害。平衡效益-风险的筛查间隔也是现今活跃讨论的话题。和患者讨论筛查的收益和风险有助于更好地进行临床决策,并且允许患者参与到筛查决策的过程中来。
临床考虑和推荐
何时开始筛查?
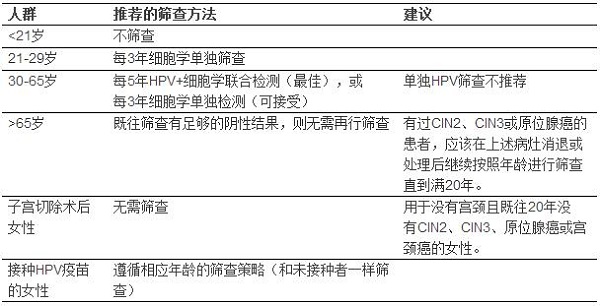
应该在21岁时开始宫颈癌筛查。除了已经感染HPV的女性外,小于21岁女性无论其性生活开始的年龄还是有无其他行为相关的高危因素(表1)。之所以<21岁女性无论其性生活开始年龄都不建议筛查是因为该年龄组的宫颈癌发病率很低,且缺乏该组筛查有效性的数据。仅有0.1%的宫颈癌发生于20岁前,也就是说15-19岁女性每年每一百万人只有1-2例宫颈癌。另外,美国和英国的研究显示更年轻女性的筛查不能降低宫颈癌的发生率。
年轻女性在开始阴道性交和其他性行为后短期内就会招致HPV感染。绝大多数感染都会被免疫系统在1-2年内清除,且不发生瘤样改变。尽管癌在青少年少见,但是瘤样病变不少见。在一项报告中,10090张来自12-18岁女孩的宫颈Pap刮片有422例(5.7%)LSIL,55例(0.7%)HSIL。
早于推荐年龄进行筛查可能增加焦虑、发病率(译者注:原文如此)以及花费,导致随访措施的过度使用。给青少年女性贴上性传播疾病和潜在癌前病变的“标签”所带来的心理影响必须加以考虑,因为青少年期是自我意识快速形成和性活动初期的时期。研究显示接受过宫颈瘤变病灶切除操作的患者发生早产的几率明显升高。但是在一项荟萃分析中发现,这种早产风险升高仅见于和那些细胞学或阴道镜结果为阴性的女性相比较时出现。在年轻女性避免不必要的病灶切除和病灶消融很显然是必要的,尽管leep操作和早产的相关性目前还有争议。
宫颈癌筛查时不应该作为生殖健康保健的开端。小于21岁女性预防宫颈癌的重要策略包括HPV疫苗免疫和安全性行为的咨询,以保证避免暴露于性传播疾病的风险之下。
筛查时应该采用何种技术?
21-29岁的女性应该仅采用细胞学单独筛查,每3年筛查一次。30岁以下的人群不应该进行联合筛查。30-65岁的女性最好每5年行一次细胞学+HPV联合检测;每3年一次细胞学单独筛查也可接受。液基的或传统宫颈细胞学采集方法都可用于筛查。上述筛查策略不适用于以下人群:已患宫颈癌、HIV感染伴免疫抑制、或宫内曾暴露于乙烯雌酚者。因为2011年ACS\ASCCP\ASCP联合发表了指南以及USPSTF的指南,FDA已经批准了HPV检测作为首先筛查手段,这一点后面将单独讨论。
和细胞学相比,HPV检测更灵敏,但是特异性较差。在2011年ACS\ASCCP\ASCP联合指南以及USPSTF指南,均不推荐30岁以下使用联合检测,因为该年龄组的高危型HPV感染率很高但宫颈癌发生率很低。在30岁以下人群大规模进行联合筛查只能发现那些没有致癌风险的一过性HPV感染。因此,30岁以下人群使用联合筛查可提高筛查的灵敏性但降低了特异性,和细胞学单独筛查相比并没有降低宫颈癌的发生率。
30岁及以上人群如果细胞学筛查阴性并且高危型HPV检测阴性,那么未来4-6年内发生CIN2或3的几率非常低。这类人群的风险显著低于单单细胞学阴性的人群。在Kaiser PermanenteNorthern California队列研究中,单独细胞学阴性人群发生CIN3的5年风险为0.26,而联合检测阴性者为0.08。
有3项随机试验比较了联合检测和细胞学单独筛查在30-65岁人群的效力。每项试验都显示,在第一轮筛查中联合检测增加了发现高级别病变的比例,在后续的筛查中较之细胞学单独筛查降低了癌的比率。第一项研究显示了联合检测在第二轮筛查时显著降低了CIN3和癌的病例数,而第二项研究显示联合筛查在第二轮将CIN3/癌的几率从0.03%降为0. 第三项研究没有报告联合检测和单独检测在癌发现率之间的差别。
和鳞癌相比,单独细胞学检测发现腺癌的效率很低。联合检测是另一个好处是可以增加对腺癌及其癌前病变的检出。
对患者进行宫颈癌筛查的流程、局限性、延长筛查间隔的合理性进行宣教是很重要的。无论筛查的频率如何,都推荐每年的妇女健康体检,即便每次体检的时候不一定要做宫颈筛查。
表1 普通人群的宫颈癌筛查方法:美国癌症协会、美国阴道镜和宫颈病理协会及美国临床病理协会联合推荐
21-29岁女性宫颈细胞学筛查的最佳频率是什么?
很少有研究来明确21-29岁年龄段最理想的筛查间隔是多少。一项建立在20岁年龄段筛查超过10年的所获得的资料建立的模型显示,如果每3年进行一次细胞学筛查,和每年筛查一次相比可以减少大约一半的阴道镜数量(187/1000人vs 403/1000人),并且一生患宫颈癌的风险也无明显差别(0.69% vs 0.33%)。另一项研究比较了1年、2年、3年为间隔进行筛查的效果,结果和前述研究结果类似。当每3年筛查和每2年进行筛查比较时,2年筛查降低癌症风险的效果不明显(37例/100000人 vs 39例/100000人),但是增加了阴道镜操作数量(176例/100000人 vs 134例/100000人)。一项英国的研究发现,20-39岁女性前次筛查为阴性时,采用2年筛查还是3年筛查面临的宫颈癌风险没有差别。每年进行筛查对宫颈癌的预防仅仅起到很微小的提升作用,但是也增加了费用,因此不应该进行每年的筛查。因为2年和3年为间隔进行筛查获得的预防效果相似,并且3年为间隔减少了额外的检查次数,因此21-29岁人群应该每3年筛查一次。
30-65岁女性宫颈细胞学筛查的最佳频率是什么?
在30-6岁人群,最好每5年进行一次细胞学+HPV联合检测。如果仅仅做细胞学筛查,那么应该每3年进行一次,液基的或传统的细胞刮片方法都可以采用。不应该每年都进行筛查。
和单独细胞学筛查相比,联合检测提高了检出CIN3的灵敏性。但是,特异性的降低导致需要更多的随访检测。每3年行单独细胞学筛查带来的宫颈癌降低可以作为筛查效果的基准,并且是可接受的筛查措施。以每3年单独细胞学筛查为基准,5年一次联合筛查轻度降低癌症的风险,但是筛查间隔更长,阴道镜操作次数也更少。一项汇集欧洲7项研究的巢式分析发现,联合筛查阴性人群6年后发生CIN3或癌的风险为0.28%,单独细胞学筛查阴性人群3年后发生CIN3或癌的风险为0.51%。在Kaiser PermanenteNorthern California队列研究中,单独细胞学筛查阴性者发生CIN3+的3年风险为0.16,联合筛查阴性者发生CIN3+的5年风险为0.08。保健研究和质量局建立了若干模型来研究宫颈癌病例数、死亡数和筛查危害(以阴道镜进行测算),这些模型显示5年联合筛查和3年细胞学单独筛查相比,联合筛查具有相同(或更少)的宫颈癌病例数、宫颈癌相关死亡数和阴道镜操作数。
单独细胞学筛查可作为联合筛查的替代措施,每3年进行一次直到65岁。既往几十年的研究提示,在有组织的筛查方案中每年筛查并不比2年或3年筛查有更多的好处。在更年轻的女性,模型显示1年和3年的筛查间隔都降低了宫颈癌的发生率,尽管3年为间隔进行筛查是宫颈癌发生率轻微上升,但是3年间隔筛查的阴道镜操作数量大大减少。决策分析显示,每3年一次细胞学 单独筛查和每5年一次联合筛查在筛查效益和负担之间提供了最佳的平衡。通过复习为制定ACS\ASCCP\ASCP的指南而参考的文献,没有发现有高质量的数据支持在任何年龄组但前次细胞学筛查阴性时而改变筛查的间隔。一项病例对照研究计算了不同筛查间隔时间组浸润癌风险的差异,发现前次宫颈细胞学异常病史或者既往正常的筛查结果数量都不会改变罹患浸润癌的风险。
停止筛查的合适年龄是几岁?
无论采用任何方式的筛查,当既往有足够多的阴性筛查结果,且没有CIN2或以上病变的历史时,>65岁就应该停止筛查。足够多的阴性筛查结果定义为:在过去10年内连续3次细胞学结果阴性或连续2次联合筛查阴性,且最近的一次筛查在5年之内。既往有CIN2、3或原位腺癌的患者应该在上述病变消退或治疗后继续筛查足够20年,哪怕超过了65岁的年龄界限。
65岁以上人群确实可以患宫颈癌。该年龄段占全美人口的14.1%,但是占据了19.6%的宫颈癌新发病例。然而,和<65岁年龄组类似,该年龄组发生宫颈癌的患者通常没有筛查或者筛查不足。
由于宫颈癌在HPV感染后中位发生时间为15-25年,因此对65岁以上年龄组进行筛查仅能预防很少的宫颈癌发生。模型研究显示,接受每3年细胞学筛查一次直到65岁的人群中,如果继续每3年细胞学筛查一次直到90岁,那么1000人中只能预防1.6例宫颈癌发生以及0.5例癌相关的死亡。这点微不足道的收益却需要付出显著的花费,包括阴道镜操作次数增加。考虑到该年龄组新感染HPV后进展到宫颈癌的风险很低,哪怕接受筛查者有了新的性伙伴,也不再有必要继续筛查。
>65岁年龄组的筛查还有一些混淆因素。上皮萎缩在绝经后常见,似乎会增加细胞学筛查的假阳性率。一项研究显示,绝经后女性异常宫颈细胞学结果的阳性预测值很低。在该年龄组,大多数异常宫颈Pap刮片都是假阳性,并且带来了诸如更多检测操作、焦虑、花费升高等一系列问题。
全子宫切除术后何时停止筛查?
对于切除了宫颈的全子宫切除术后患者,如果既往没有CIN2或更高级别的病变,应该终止常规的细胞学和HPV筛查,且不要因为任何原因而重启筛查。
原发阴道癌是最罕见的的妇科恶性肿瘤。全子宫切除后且没有CIN2或更高级病变的患者发生阴道癌的风险非常微小。该组人群进行细胞学筛查发现异常病变的可能非常低,阳性预测值很低。一项荟萃分析纳入了19个研究共6543名宫颈无CIN且接受全子宫切除术的患者和5037名宫颈CIN3且接受全子宫切除术的患者。在随访过程中,没有CIN的患者1.8%出现了阴道细胞学筛查异常,活检后0.12%的患者为阴道上皮内瘤变,没有阴道癌发生。对这类人群继续进行阴道细胞学筛查是无效的,尤其是阴道癌是一种非常罕见的肿瘤,继续筛查只会带来不适、焦虑和过度治疗。
全子宫切除术前就有宫颈高级别病变的患者在术后可能发生阴道残端的上皮内瘤变或癌。在一项系统性分析中,既往有CIN3的患者切除子宫后14.1%的病例在随访中出现细胞学异常,但是活检证实的阴道上皮内瘤变很少(1.7%),且只有一例阴道癌的报道(全子宫切除术后3年出现)。在过去20年里有CIN2及以上病变,或者在任何时期曾有宫颈癌的患者,在全子宫切除术后应该继续筛查。HPV检测在该组人群的作用尚不明了。对于保留宫颈且既往有CIN2及更高级别病变的患者,推荐继续筛查20年。因此,对于子宫切除术后需要继续筛查的人群每3年一次细胞学单独筛查是合理的。
HPV检测作为宫颈单独筛查手段的作用如何?
2014年4月,美国FDA通过一种已上市的HPV检测手段作为宫颈癌单独筛查的手段。2011年版ACS/ASCCP/ASCP联合指南明确不建议将HPV检测作为宫颈癌的首要筛查方法。上述决定基于HPV检测的特异性差、缺乏有效手段决定哪些HPV检测阳性的患者需要进一步的诊断评价、以及潜在的对诊断评估手段和治疗的过度使用。从那以后,一项美国进行的评价HPV作为宫颈癌筛查初始手段的研究(称作“Addressing theNeed for Advanced HPV Diagnostics trial”)确认了HPV检测作为首选宫颈癌筛查手段的有效性。在该项研究中,HPV阳性标本进行了病毒分型。如果标本HPV-16或18阳性,则行阴道镜检查。如果HPV-16或18阴性,则行细胞学检测,假如细胞学结果异常则行阴道镜。如果细胞学结果正常,则一年后重复HPV+细胞学联合检测。
基于Addressing the Need forAdvanced HPV Diagnostics trial研究显示的HPV检测作为宫颈癌初始筛查手段的有效性相当于甚至超过细胞学筛查手段,FDA修改了HPV检测的说明,允许其作为25岁及以上女性宫颈癌筛查的初始方法。单独细胞学筛查和细胞学联合HPV筛查目前仍旧是各大学术团体首选推荐的筛查方式。2015年,ASCCP和SGO联合发布了一项过渡指南,可以使用FDA批准的HPV检测方法作为宫颈癌的初始筛查手段。指南制定委员会认为,鉴于25岁及以上人群中使用HPV检测具有等于甚至优于细胞学检测的有效性,因此HPV检测可以考虑作为当前细胞学为基础的宫颈癌筛查方法的替代措施。
如果使用HPV检测作为初始筛查手段,必须遵循ASCCP/SGO的过渡指南进行操作。HPV检测不应用于25岁以下女性,这些女性只应该接受单独的细胞学筛查。前次HPV筛查阴性的人群再次行HPV检测不应短于3年。HPV检测阳性病例应该启动HPV-16和18分型,如果HPV分型阴性则继续细胞学筛查。如果HPV分型和细胞学检测均为阴性,患者应该1年后再次联合筛查。
在过渡指南中还有一些重要的内容需要说明。既往筛查历史阴性的人群应该在65岁时终止筛查。HPV检测作为初始筛查手段不应该用于已切除宫颈的患者。HPV初始检测阳性,但是分型和细胞学阴性的患者在随访1年后该采用何种检查方式指南中未说明,但是采用联合筛查是合理的。没有指南说明HPV检测如何用于HIV携带(患)者和免疫抑制的人群。只有一种专门的HPV检测方法被FDA批准用于初始筛查。其他HPV检测方法没有进行有效性的评价。如果采用HPV检测作为初始筛查手段,必须采用FDA批准的方法。
如何处理细胞学为ASC-US但HPV阴性的结果?
细胞学检测为ASC-US但是HPV检测阴性的患者,无论HPV检测是ASC-US的“分流”手段还是联合筛查,患CIN3的风险较低,但是仍旧略高于联合筛查阴性的人群。该类病例推荐3年后行联合筛查(表2)。此推荐有别于2011年ACS/ASCCP/ASCP联合指南,当时推荐对这类患者行常规筛查。
ASC-US的处理存在很多不清晰的地方。ASC-US经常被按照一个诊断来处理,实际上它代表的是一种诊断不明的状态,既包含存在鳞状上皮内病变的患者,也混有不存在病变的人群。
表2 宫颈癌筛查结果的处理
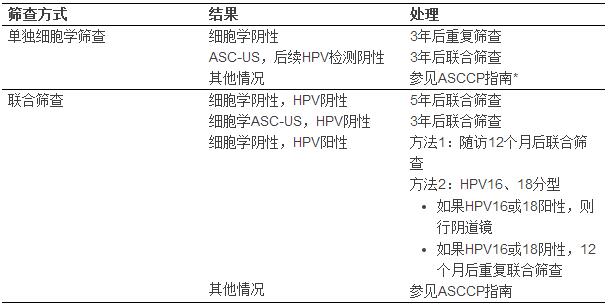
HPV检测是ASC-US分流的很有效方法。当HPV阴性时,癌前病变的风险非常低。在Kaiser PermanenteNorthern California队列研究中,30-64岁ASC-US+HPV(-)女性5年CIN3和癌的风险分别为0.43%和0.05%,明显高于联合筛查阴性的人群(0.08%和0.011%)。因为ASC-US+HPV(-)患者CIN3的风险和单独细胞学筛查阴性的风险相似,2012年ASCCP发布的《异常宫颈筛查结果和癌前病变处理共识》推荐30-65岁女性应该3年后再次联合检测,而不是5年。如果3年后联合检测阴性,可以回归到年龄相关的常规检查中。
如何处理细胞学阴性,HPV阳性的结果?
距近期的一项研究,细胞学阴性+HPV(+)发生于3.7%的30岁以上人群。该组人群发生明显病理学异常的风险较小。11项前瞻性研究的总结(随访1-16年)显示,随访12个月时CIN3的风险为0.8-4.1%。在Kaiser PermanenteNorthern California队列研究中,5年CIN3和癌的风险分别为4.5%和0.34%。癌前病变的低风险使得阴道镜在该类人群不是好的诊断措施。
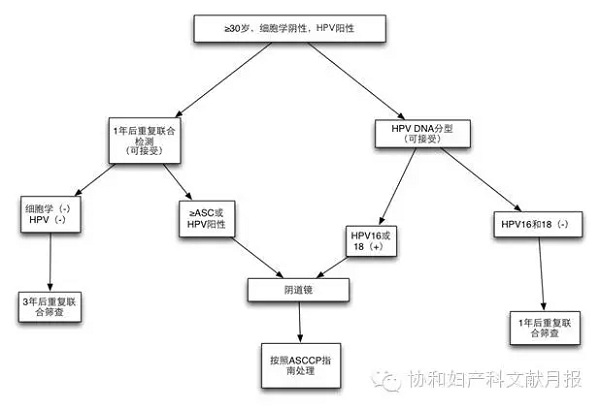
30岁以上的细胞学(-)+ HPV(+)病例应该采用如下之一的处理(图1):
12个月后重复联合检测。如果重复检测的结果为ASC-US或更高级别病变,或HPV依旧阳性,应该行阴道镜检查。否则,3年后重复联合筛查。
即刻行HPV16和18分型。任何一个高危型阳性则行阴道镜。高危型分型阴性则12个月后重复联合检测,检测结果按照2012年ASCCP指南处理。
图1.30岁及以上细胞学阴性,但HPV阳性的处理流程
没有研究来直接比较HPV(+)和细胞学(-)女性采用不同处理的差异。重复筛查的合理性来源于若干队列研究的结果显示绝大多数一过性感染在12个月内清除。一项队列研究报道,60%HPV阳性、液基细胞学阴性的女性中位清除感染的时间为6个月。另一项队列研究显示67%的HPV感染在1年内清除。那些感染超过1年的患者中,在30个月内21%发展为CIN2或更高级别的病变。在Kaiser PermanenteNorthern California研究中,47%的女性在1年时仍旧HPV阳性。在重复检查时,任何联合筛查结果的异常较之基线筛查时同样的异常结果,发生更严重病变的风险增加。一年后重复联合筛查给了绝大多数一过性感染和无致癌之虞感染充分的时间以清除病毒,并且可以缩小范围以明确有癌前病变风险的人群进行阴道镜检查。
如果联合筛查发现HPV阳性,可以采用FDA批准的HPV分型方法来检测是否为HPV-16或18阳性。如果确是HPV16或18型阳性,那么未来数年内发生CIN3的风险将达到10%,足以高到需要阴道镜检查的程度。HPV分型检测可以作为细胞学(-)但HPV(+)患者的一种分流手段,如果高危型阳性,那么应该立即行阴道镜检查。如果HPV16或18型阴性,那么可1年后重复联合筛查,因为其他高危型HPV带来的风险仍旧存在,重复筛查结果的处理见图1。
接种HPV疫苗应该改变宫颈癌筛查的流程吗?
接种HPV疫苗的女性应该接受和未接种女性一样的筛查流程。2价和4价的疫苗只能免疫2种最致癌的HPV高危型,即HPV16和18型。这两种HPV亚型和超过75%的宫颈癌有关。然而,尽管数据显示既往未感染HPV的女性中疫苗能提供100%针对HPV16和18造成的CIN,但是另有30%的宫颈癌来自于疫苗尚未覆盖的其他HPV高危亚型。9价疫苗可以额外提供另外5种高危型的免疫,但是依旧不能覆盖所有高危亚型。现今ACIP和ACOG的推荐允许疫苗接种到26岁,这一年龄很多女性都感染了HPV,这样疫苗的免疫效果会明显降低。疫苗的接种率现在远达不到100%,并且由于美国缺乏疫苗等级体系,所以很难明确谁接种谁没接种,以及接种者是否接受了足够的3剂接种。疫苗长期的效力目前还未完全明了。尽管HPV疫苗是宫颈癌预防的重要一步,但是还不能取代常规的宫颈癌筛查。
对特殊的人群有推荐的替代筛查措施吗?
在观察性研究中确实发现一些CIN相关的确定风险。有下述危险因素的女性应该接受比常规推荐给普通人群的更频繁的宫颈癌筛查:
● HIV感染者
● 免疫抑制状态者(如接受实体器官移植的病人)
● 子宫内暴露于已烯雌酚者
● 既往曾接受CIN2、3或宫颈癌治疗者
HIV感染成人和青少年机会感染专家委员会推荐HIV感染者接受下述宫颈癌筛查方案:
● 无论感染HIV的类型,在性活动开始时即启动筛查,且不要晚于21岁。
● HIV感染者的筛查应该持续整个生命期(例如,不要在65岁即停止筛查)
<30岁的hiv感染者应该在诊断hiv感染时即行宫颈细胞学筛查。如果细胞学筛查正常,下一次细胞学筛查在12个月内。如果连续3次年度细胞学筛查阴性,后续的细胞学筛查可每3年一次。<30岁的感染者不推荐联合筛查。
● ≥30岁的HIV感染者可以行细胞学单独筛查或联合筛查。每年一次细胞学单独筛查且连续3年阴性,后续细胞学筛查可以每3年一次。HIV感染者联合筛查阴性时(正常细胞学和HPV阴性),下次筛查可以在3年后。
● 联合筛查时细胞学(-)但HPV(+),处理同普通人群。
● HIV感染者细胞学为LSIL或更严重病变,应该行阴道镜检查。
● HIV感染者细胞学为ASC-US时,如后续HPV检测阳性,推荐阴道镜检查。如果没有HPV检测条件,推荐6-12个月后重复细胞学检查。如果重复检查仍旧是ASCU-US或更严重病变,推荐阴道镜检查。
没有研究或专业协会指南来指导如何对非HIV感染造成的免疫抑制者进行宫颈癌筛查。传统的每年一次细胞学筛查已经用于该类人群,但是借鉴HIV感染者的筛查方法也是合理的。每年一次宫颈细胞学筛查对于宫内曾暴露于已烯雌酚者是合理的。
既往曾治疗过CIN2或更高级别病变者,在治疗后至少20年内病变持续或者复发的风险依旧持续存在。一项荟萃分析显示,既往接受过CIN2或以上病变治疗者在治疗后20年发生浸润性病变的风险仍旧高2.8倍。鉴于上述数据,有过CIN2或以上病变者应该在治疗后继续筛查20年,哪怕筛查时间已经超过了65岁。
推荐总结和结论
以下建议和结论基于良好的、一致的科学证据(A级证据):
● 宫颈癌筛查应该在21岁时开始。除了HIV感染者外,<21岁者无论性生活开始年龄或者有无其他行为相关危险因素,都不应该启动筛查。
● 21-29岁者单行细胞学筛查,每3年一次。<30岁者不应行联合筛查。不应该每年都筛查。
● 30-65岁者最好每5年行细胞学+HPV联合筛查。每3年一次细胞学单独筛查也可接受。不应该每年都进行筛查。
● 液基的或传统的宫颈细胞采集技术都可用于筛查。
● 既往有足够的阴性筛查结果且没有CIN2及以上病变者, 65岁后应该停止任何方式的筛查。足够的阴性筛查结果定义为:过去10年里连续3次细胞学阴性或连续2次联合筛查阴性,且最近一次筛查在5年内。
● 已切除宫颈的子宫切除术(即全子宫切除术)且既往没有CIN2或以上病变者,常规细胞学筛查和HPV检测应该终止,并且不因为任何原因而重新启动。
● 有下述风险因素者应该接受比常规人群(即’标危”人群)更频繁的筛查:
——HIV感染者
——免疫抑制状态者(如接受实体器官移植的病人)
——子宫内暴露于已烯雌酚者
——既往曾接受CIN2、3或宫颈癌治疗者
以下推荐基于有限的、不一致的科学证据(B级证据):
● 既往有CIN2、CIN3或原位腺癌的女性应该在病变自发消退或适当治疗后继续筛查满20年,哪怕筛查年限会超过65岁。
● 全子宫切除术患者过去20年有CIN2或以上病变者以及任何时间内有宫颈癌者,都应该继续筛查。在上述病变初始治疗结束后每3年一次细胞学筛查持续20年似乎是合理的。
● 25岁及以上年龄女性,采用FDA批准的HPV检测方法进行初始筛查可以考虑作为现今基于细胞学的筛查方法的替代。细胞学单独筛查和联合筛查依旧是目前主要专业协会指南的推荐措施。如果采用HPV检测作为单独筛查,应该遵循ASCCP和SGO的过渡指南。
● 细胞学为ASC-US而HPV阴性人群(不管是后续HPV检测还是联合HPV检测),CIN风险较低,但略微高于联合筛查阴性人群,推荐3年后再次联合筛查。
● ≥30岁细胞学阴性但HPV阳性的联合筛查结果应该按下述两种方法之一进行处理:
1. 12个月后再次联合筛查。如果再次联合筛查为ASC-US或以上病变,或者HPV依旧阳性,应该行阴道镜检查。否则,该患者3年后再次联合筛查。
2. 即刻HPV分型以鉴定HPV16或18型。HPV16或18阳性者直接行阴道镜检查。如果2种高危型均阴性,那么12个月后再次联合筛查。再次筛查结果按照《2012年修订版ASCCP异常宫颈筛查结果处理指南》进行处理。
下述推荐基于专家意见和共识(C级证据)
● 接种HPV疫苗者和未接种疫苗者采用相同的筛查方法和策略。
(本文由北京协和医院妇产科编译)
本文为作者原创并授权妇产科在线发布,版权归原作者所有,欢迎转载,但请务必注明出处,否则将追究法律责任。
 妇产科在线APP下载
妇产科在线APP下载













