【摘要】 目的 比较受精后第四天与第五天两种移植方方案对于IVF-ET临床妊娠结局的影响。方法 回顾性分析于2018年1月至2019年4月在我院生殖中心行IVF-ET的357例患者临床数据。选取受精后第四天新鲜胚胎移植周期为D4移植组(292例),受精后第五天新鲜胚胎移植周期为D5移植组(65例)。比较两组间患者基本资料,卵裂胚胎质量,临床妊娠率,种植率等临床资料。结果 D4移植组与D5移植组患者的基本资料无明显差异,D5移植组多为输卵管因素且优质卵裂胚胎数和可用卵裂胚胎数显著多于D4移植组,然而D4移植组的临床妊娠率为(66.78%)与D5移植组(66.15%)无显著统计学差异;D4移植组的种植率为(51.75%)与D5移植组(52.99%)无显著统计学差异。 结论 虽然D5移植组的胚胎质量较好,但受精后第四天与第五天两种移植方方案的临床妊娠结局无差异,患者在可用胚胎数较少时,担心囊胚移植取消风险和D3天形态学胚胎评分不足以反应胚胎发育潜能,可选择受精后第四天优选早期囊胚和桑葚胚移植。
【关键词】 新鲜周期;胚胎移植;妊娠结局
随着辅助生殖技术的发展,已经解决了大量不孕症夫妇的生育需求。多数研究报道,D3移植卵裂胚可能遭遇胚胎基因组未激活和异常受精等风险[1-2]。相对于卵裂胚移植,囊胚移植在临床妊娠率和种植率上均具有明显的优势,且具有更低流产率[3]。然而胚胎在体外培养过程中不可避免的遇到培养微环境的波动,这些波动如PH,温度、渗透压的改变据有可能对胚胎发育造成影响[4-5],导致D5未能获得可移植囊胚,移植周期取消,或者种植后胚胎发育停滞等影响。有报道指出桑椹胚与囊胚具有相似的优势,因为它们具有激活的胚胎基因组,且与D2、D3的卵裂期胚胎相比,它们与子宫内膜环境有更好的同步性[6,7]。因此我们通过比较受精后第四天与第五天两种移植方方案对于IVF-ET临床妊娠结局的影响。探讨了第四天新鲜胚胎移植周期的优势。期望降低移植周期取消率和好的临床结局。
材料与方法
1、研究对象与分组
选取2018年1月至2019年4月在我院生殖中心行IVF-ET共357例患者临床数据。按照受精后发育天数分为第四天新鲜胚胎移植周期为D4移植组和第五天新鲜胚胎移植周期为D5移植组。
纳入标准:年龄小于等于35 岁,首次因女方因素输卵管因素和卵巢高反应或男方因素接受辅助生殖助孕行常规长方案IVF或ICSI受精;
排除标准:子宫内膜异位症,子宫肌瘤、宫腔粘连、子宫内膜炎等子宫内膜病史的患者。
2、控制性促排卵
纳入研究对象均采用常规长方案超促排卵,女方在黄体期肌注促性腺激素释放激素类似物(GnRHa)(达菲林,Ipsen Pharma Biotech,法国),达到降调节目的后,给予重组促卵泡β素(普利康,Meck Sharp&Dohme Limited,英国)或尿促性素(乐宝得,丽珠制药,珠海)促排卵,定期通过阴道B超监测卵泡发育情况,当1/3卵泡直径≥1.8cm时肌肉注射绒毛膜促性腺激素(立柱制药,珠海)5000-1000 U,36.5 h左右B超引导下经阴道穿刺取卵,卵冠丘复合体置于37℃,6 %CO2培养箱中培养。
3、体外受精和胚胎移植
授精方式分为IVF和ICSI两种,取卵后 3-4h 体外授精。IVF:授精密度为 2万条每个卵母细胞,授精后4-6 h拆除卵子周围颗粒细胞,观察受惊情况酌情行早补救ICSI。ICSI:取卵后4-6 h选择成熟卵子进行卵胞浆内显微注射。根据受精后第三天胚胎的形态学评分,在受精后第三天,根据卵裂球数目、大小和碎片等情况进行形态学评分:Ⅰ级为卵裂球大小均匀,形态规则,胞质均匀清晰,无碎片或<10%;Ⅱ级为卵裂球大小均匀或略不均匀,形态欠规则,无碎片或10-20%;Ⅲ级为卵裂球大小不均,形态欠规则,碎片20-50%;Ⅳ级为卵裂球大小严重不均,碎片>50%。级别在Ⅲ级及以上的胚胎为可移植用胚,Ⅱ级及以上为优质胚胎。若患者可用胚胎数量多于移植个数,则受精后第4 天移植选择早期囊胚或桑葚胚移植;若优质胚胎数量≥4个,则受精后第五天选择囊胚移植。
4、黄体支持和妊娠确定
取卵当日即肌注黄体酮注射液(浙江仙琚)进行黄体支持。视HCG注射日E2水平,移植日给予适量雌二醇(补佳乐,拜耳医药,德国)补充,移植当日常规使用黄体酮(安琪坦,博赏医药,法国)口服或阴道上药进行黄体支持。移植后14 d查血HCG确定生化妊娠,移植后28 d B超检查,见孕囊确定临床妊娠。
5、统计学分析
采用SPSS17.0软件进行统计学分析,定量资料采用x±s表示,组间比较用独立样本t检验;计数资料用百分比表示,组间比较采用卡方检验,P<0.05表示差异有显著性。
结 果
1、基础资料比较
选取2018年1月至2019年4月在我院生殖中心行IVF-ET共357例患者临床数据,受精后第四天新鲜胚胎移植周期为D4移植组(292例),受精后第五天新鲜胚胎移植周期为D5移植组(65例)。两组在年龄、体质量指数、基础FSH水平、hCG日激素水平、移植日子宫内膜厚度等方面无显著性差异(P>0.05);两组人群不孕因素占比分析中原发性不孕症,排卵障碍,多囊卵巢占比没有显著差异(P>0.05),但D4移植组不孕因素的输卵管因素占比显著低于D5移植组(P<0.05)(表1)。
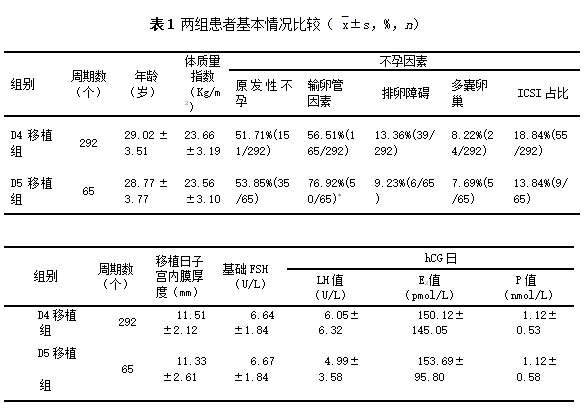
注:D5移植组与D4移植组相比,* P<0.05。
2、胚胎情况比较
D4移植组的D3可用囊胚个数和优质胚胎个数显著低于D5移植组,差异有统计学意义(P<0.05)(表2)。

3、临床结局比较
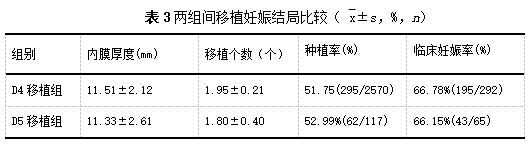
D4移植组和D5移植组在移植日子宫内膜厚度和移植胚胎个数无显著性差异(P均>0.05);两组的种植率和临床妊娠率也没有明显的统计学差异,D4移植组在可利用胚胎数较少的情况下妊娠结局并不比D5移植组差 (表 3)。
讨 论
辅助生殖助孕通过超促排卵的方式可以获得足够的卵子用于体外受精后胚胎移植。然而随着取卵数的增多, 虽然可用胚胎数是增加的, 但可用胚胎的转化率却降低了,多数胚胎因为非整倍体等异常情况不能继续发育[8]。这符合了优胜劣汰的自然规律,但是为了减少患者负担,如何选择出正常的胚胎移植入子宫,获得满意的临床结局,在生殖医学领域成为永恒的话题。
由于多种原因,核逆转、多核、逆乱裂和异常卵裂模式的存在,定时定点的形态学观察并不能有效的反应胚胎的发育情况[9-10],即使D3的优质胚胎也没有一个满意的种植率。
多数中心通过延长培养时间的方法优选最具发育潜能的胚胎,同时大量研究表明,囊胚移植具有较高的种植率[11-12]。然而,培养养囊胚具有较高的移植取消率[13];同时,囊胚期胚胎移植同卵双胞胎发生率也明显升高,成为孕妇多胎妊娠的危险因素[14]。
我们的研究数据表明,虽然D5移植组多为输卵管因素,且卵裂期胚胎质量较好,D4移植组相对于D5移植组根据形态学评分优选胚胎移植,具有类似的种植率和临床妊娠率。我们认为D4可能具有较好的移植种植率。
综上所述,患者具有多余可用胚胎时,建议受精后第四天根据胚胎发育情况优选早期囊胚和桑葚胚移植进行移植。但是,我们仍然缺乏足够的证据证实体外受精胚胎移植中桑葚期胚胎相对于D5移植囊胚的优势。我们下一步将验证桑葚期胚胎冷冻的可行性,并进一步通过研寻找D4桑葚胚与D5囊胚优劣的证据。
参考文献
1.Bianchi E, Wright GJ. Izumo meets Juno: preventing polyspermy infertilization[J]. Cell Cycle, 2014, 13 (13): 2019-2020.
2.Morbeck DE. Air quality in the assisted reproduction laboratory: amini-review[J]. J Assist Reprod Genet, 2015, 32(7):1019-1024.
3.Braga DP, Setti AS, Figueira RC. The importance of the cleavage stage morphology evaluation for blastocyst transfer in patients with good prognosis. Journal of assisted reproduction and genetics[J]. 2014 Aug;31(8):1105-10.
4.Morbeck DE. Air quality in the assisted reproduction laboratory: amini-review[J]. J Assist Reprod Genet, 2015, 32(7):1019-1024.
5.方丛, 梁晓燕. 胚胎实验室质量控制[J]. 中华生殖与避孕杂志, 2018,08: 640-642.
6.余兰, 王树玉, 贾婵维. 囊胚解冻移植与卵裂期冻胚解冻后培养囊胚移植的比较研究[J]. 中国优生与遗传杂志, 2018,6: 138-139.
7.Papanikolaou EG, Kolibianakis EM, Tournaye H,et al. Live birth rates after transfer of equal number of blastocysts and cleavage stage embryos in IVF[J]. A systematic review and meta-analysis[J]. Hum Reprod,2008,23(1):91-99.
8.潘家坪, 滕晓明, 王羽. 获卵数目对有效胚胎形成率的影响:2578个体外受精周期分析. 中华生殖与避孕杂志[J],2017,03: 175-181.
9.Zhan Q, Ye Z, Clarke R. Direct Unequal Cleavages: Embryo Developmental Competence, Genetic Constitution and Clinical Outcome[J]. PloS one,2016,11(12):e0166398.
10.Yan W. An interview with Magdalena Zernicka-Goetz[J]. Biology of reproduction,2017, 1;96(3):503-504.
11.Thomas MR, Sparks AE, Ryan GL, et al. Clinical predictors of human blastocyst formation and pregnancy after extended embryo and transfer[J]. Fertil Steril, 2010, 94 (2):543-548.
12.Mangalraj AM, Muthukumar K, Aleyamma T, et al. Blastocyststage transfer vs cleavage stage embryo transfer [J]. J HumReprod Sci, 2009, 2(1):23-26.
13.Mullin CM, Fino ME, Talebian S, et al. Comparison ofpregnancy outcomes in elective single blastocyst transferversus double blastocyst transfer stratified by age[J]. Fertil Steril, 2010,93(6):1837–1843.
14.薛侠, 施文浩, 师娟子. D5 选择性的单囊胚移植和双囊胚胎移植妊娠结局比较[J]. 生殖医学杂志,2014,23(4): 276-279.
 妇产科在线APP下载
妇产科在线APP下载













