摘要
青春期前女孩(9-15岁)可选择接受二剂HPV疫苗注射,间隔六个月或一年,以提供HPV16(与宫颈癌相关的最普遍的类型)以及几种其他不太普遍的类型的防护。直至进入常规筛查计划,即单纯HPV检测,或HPV检测联合细胞学检查。自2015年起,世界卫生组织(WHO)推荐了二剂方案。对于15岁以上的女性,仍建议使用三剂疫苗方案。

证据表明,过去10年Gardasil四价疫苗高覆盖率国家HPV 16/18感染率降低。 Gardasil9九价疫苗已经取代Gardasil四价疫苗。
Gardasil9九价疫苗与Gardasil四价疫苗具有相同的快速免疫HPV18和HPV45功效。 Cervarix二价疫苗在预防HPV感染和任何一种HPV类型导致的癌前病变方面与Gardasil9九价疫苗相当; Cervarix二价疫苗在至少10年内显示出持续的高抗体滴度。
一剂Cervarix二价疫苗以高于自然感染的强效抗体滴度提供针对HPV16 / 18感染的保护。在中低收入国家,这有可能提供最简单和最具成本效益的疫苗接种计划。
根据世界卫生组织的定义,针对预防性HPV疫苗的未来研究必须证明可以预防6个月的特异性持续感染,而不是以真正的宫颈癌前病变如宫颈上皮内瘤样病变3级(CIN 3)或原位腺癌(AIS)作为终点,这简化了现有疫苗和新的仿制疫苗之间的比较研究,且可降低成本。
1.简介
人乳头瘤病毒(HPV)相关的癌症包括宫颈、外阴、阴道、阴茎、肛门、直肠和口咽癌。 由于80%以上HPV相关癌症发生于子宫颈,几乎所有的预防性HPV感染的证据都以宫颈疾病为代表。第一个批准疫苗Gardasil四价疫苗已经被Gardasil9九价疫苗所取代,并且Gardasil9九价疫苗对CIN3全面预防与Cervarix 二价疫苗并无二致。
2.疫苗成分
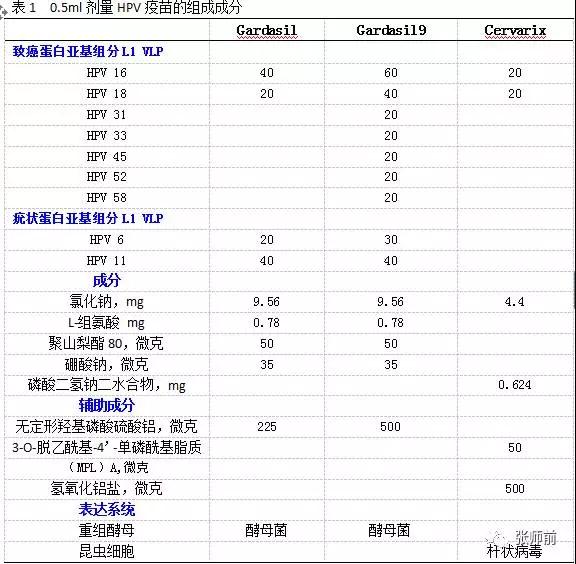
所有三种疫苗均包含HPV L1抗原颗粒(VLPs)。 表1列出了不同的疫苗组分。 Gardasil9九价疫苗含有两倍以上的抗原负荷和两倍以上的铝负荷;Gardasil9九价疫苗增加了对HPV16和18的L1病毒颗粒(VLPs)浓度,抗体应答不劣于Gardasil四价疫苗。 三种疫苗中Cervarix二价疫苗抗原浓度最低,并含有一种用于增强免疫原性的高级辅助剂AS04 。 AS04模拟Toll样受体4激动剂,直接刺激抗原呈递细胞,产生显著的细胞和体液免疫应答以及持久的抗体应答。
表1 0.5ml剂量HPV疫苗的组成成分
3. 免疫原性
3.1. 作为终点的免疫原性
2013年世界卫生组织(WHO),美国国家癌症研究所(NCI)和国际癌症研究机构(IARC)达成一致共识,对于16-26岁人群非劣效抗体滴度是唯一可接受的研究终点,认为免疫非劣效性是基于VLP的HPV疫苗试验的足够终点,持续型特异性感染保护至少6个月后建立。
对于年龄小于16岁的人群而言,WHO标准指出,非劣效抗体滴度是唯一可接受的终点;而年龄超过26岁人,在至少6个月的时间里,通过疫苗特异性HPV类型来预防宫颈、肛门和口腔部位持续感染是可以接受的。外阴/阴道保护必须通过定义为2/3级HPV16/18特异性上皮内瘤变(VaIN 2 + / VIN 2+)的实际疾病的预防来证明。
抗体滴度虽然是基于VLP的HPV疫苗研究中公认的主要终点,但迄今为止,还不能确定针对癌症或癌前病变的保护水平。由于基于疾病的终点研究非常有限,随着时间的推移,抗体滴度被用于评估接种后保护持续时间的指标。抗体滴度在很大程度上取决于疫苗剂量的数量和时间。 自然感染滴度不能提供对同类型感染的保护作用,因此,可作为长期诱导几何平均滴度(GMTs)的对照,以推断针对特定类型HPV感染的保护期。 自然感染滴度高于血清阳性检出水平。
3.2.三种HPV疫苗的免疫原性比较
在成年妇女和12 -15岁的青少年中,三剂Cervarix 二价疫苗vs Gardasil四价疫苗的随机对照研究已经完成,5年后抗HPV16滴度的血清学抗体水平都很高,对于Gardasil四价疫苗来说,通过假病毒颗粒中和试验(PBNA)测得的实际诱导GMTs明显低于Cervarix二价疫苗;滴度降低可能会影响长期的保护期。Gardasil四价疫苗具有显著低于Cervarix二价疫苗的血清阳性保留率和抗HPV18滴度的GMT。Cervarix二价疫苗也表现出比Gardasil四价疫苗更高的针对HPV 16/18的血清结合抗体反应。Gardasil9九价疫苗可诱导类似于Gardasil四价疫苗的抗HPV16 / 18应答。同样地,Gardasil四价疫苗在针对HPV16和18的CD4 + T细胞应答率和几何平均数方面均低于Cervarix二价疫苗;48个月时HPV18记忆B细胞的几何平均数也显著较低。
抗体反应的持续时间对于临床预防HPV感染至关重要。 在纵向随访研究中,Cervarix二价疫苗抗HPV16和HPV18抗体滴度至少持续9.4年的时间; Gardasil四价疫苗抗HPV16滴度高于自然感染滴度,且至少持续9年,但在接种疫苗后的24个月内,抗HPV18疫苗的抗体滴度与自然感染滴度没有区别。
Gardasil9九价疫苗在三种剂量下,与Gardasil 四价疫苗相比,具有相同的HPV18 GMT血清阳性率。 近20%的Gardasil9九价疫苗在24个月后可检测到抗HPV18滴度的渐低。 Gardasil四价疫苗受试者经过1年以上,超过10%的女性没有检测到抗HPV18滴度,3年后超过20%的女性检测布道有效滴度,5年后这一数字接近35%。 接近15%的Gardasil9九价疫苗受试者24个月后丧失了可检测到的抗-HPV 45(一种与HPV 18的α7系统发生相关类型)滴度。 这两种HPV类型的抗体的消失度显著大于Gardasil9九价疫苗受体对抗HPV16滴度所见的最小损失,并且可能影响保护期。 与Gardasil9九价疫苗相关的抗HPV31,33,52和58的血清阳性率和GMTs在24个月内遵循抗HPV16的衰减模式。
3.3.第二剂Gardasil四价疫苗后第三剂作为增强剂
加拿大对9-10岁的女孩初次接种Gardasil四价疫苗三年后,试验了间隔六个月的强化免疫注射。Cervarix二价疫苗或Gardasil四价疫苗作为增强剂被随机分配。 结果显示:接受Cervarix二价疫苗者在接受加强剂量后一个月的抗HPV16 / 18滴度显著高于接受Gardasil四价疫苗者。
3.4.第三剂Gardasil四价疫苗之后的增强剂
接种三剂Gardasil四价疫苗的青春期前女孩对HPV16 / 18以外的其他致癌型HPV没有显著的抗体。随着Gardasil9九价疫苗取代Gardasil四价疫苗,为了防止另外五种致癌型HPV,年轻女孩重新接种的愿望在所难免。一项随机试验测试了这个假设,在最初的三剂Gardasil四价疫苗后一至三年给予三剂Gardasil9九价疫苗。峰值(第三次剂量后一个月)测量的GMTs显示,在已经接种Gardasil四价疫苗的女孩中,对于HPV 16/18具有记忆性应答,滴度较Gardasil9九价疫苗原始接种者高2-3倍。不幸的是,重新接种女孩的抗HPV31 / 33/45/52/58滴度显著低于原始接受Gardasil9九价疫苗,没有迹象表明这些低滴度会提供针对HPV类型特异性感染保护。虽然Gardasil四价疫苗能够诱导小的抗HPV31抗体反应,但当与Gardasil9九价疫苗重新接种时,与HPV16 / 18相比,在抗-HPV31滴度中没有观察到记忆性应答。这些结果以及成本效益分析总结性地表明,Gardasil9九价疫苗不应该被用于给已经接种了三剂Gardasil四价疫苗疫苗的人进行再接种。
3.5. 少于三剂的免疫原性
在服务不足的地区和发展中国家,遵守三剂计划可能困难。鉴于目前这个情况,世界卫生组织和疾病预防控制中心(CDC)建议9-15岁的患者提供两剂的计划,时间间隔是6个月或12个月。用以平衡少于三剂的机会与抗体介导的长期保护。
Cervarix二价疫苗和Gardasil四价疫苗在两剂后产生的抗体效价与三剂的抗体效价相同,如果两剂相隔六个月,则为各自的疫苗效价。图1(Cervarix)和2(Gardasil)显示抗HPV16和HPV18滴度低于三剂。图1是基于18-25岁的女性的数据;图2基于10-18岁的女孩的数据。

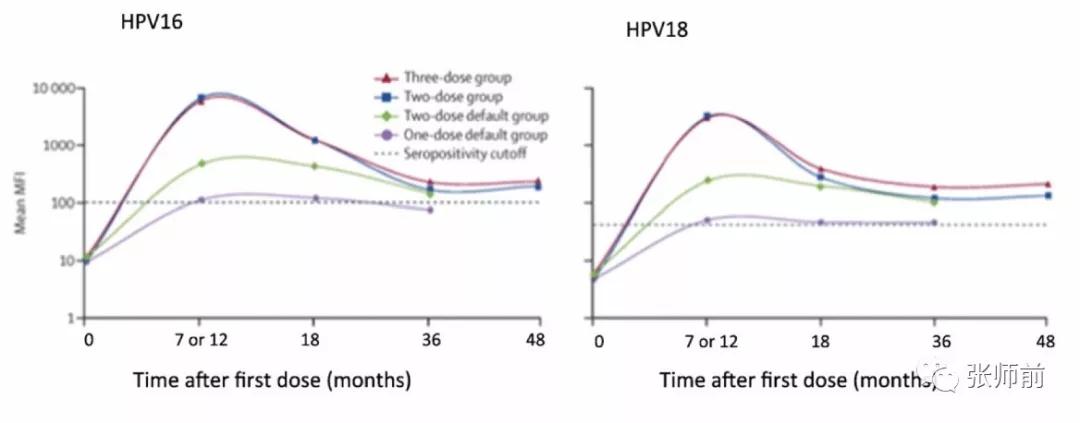
尽管最初两次剂量之间的间期增加在逻辑上更容易,但直到第二次注射后,直接抗体滴度不一定增加超过自然感染的滴度,已知自然感染滴度不能抵抗新感染。一项荟萃分析指出,与18个月内三剂HPV18相比,六个月的间隔,两剂Gardasil四价疫苗方案导致较低的抗体反应;和两年内、三剂的Cervarix二价疫苗用于HPV16相比的抗体反应较差。两剂Gardasil四价疫苗比三剂提供更少的长期保护需要更长期的后续研究。
将注射间隔时间由6个月缩短到1个月,可使滴度峰值降低,但在48个月的时间里仍保持稳定,远远高于自然感染滴度水平,并且每隔六个月仅仅略低于3剂和两剂的水平。同样,Gardasil四价疫苗第二次剂量的两个月较短间隔,比其他剂量方案诱导更低的峰值效价,但36个月时与三次给药的Gardasil四价疫苗达到相同的GMT。尽管在3个月内两次剂量未被正式推荐,36个月的相似高度的GMTS表明滴度足够高于自然感染滴度,反映了较长的两个剂量间隔和三个剂量计划的平台; 唯一的问题就是维持短间隔两剂量抗体的持续时间。
对11-13岁女孩进行Gardasil四价疫苗免疫后,将间隔延长到一年的时间,结果在12个月的抗HPV16和HPV18滴度相当于达到了三剂Gardasil四价疫苗的平台。两年一次间隔剂量的管理可以增加依从性; 第三剂在第24个月可能会增加抗体的持续时间。
单剂量方案也已被观察。 一剂Cervarix二价疫苗会诱导产生高滴度的HPV16和18抗体,分别高于自然感染滴度的9倍和近5倍。 18个月后,一个剂量的Gardasil四价疫苗能诱导HPV16和18抗体的浓度低于血清型的效价。 青春期前的一剂Cervarix二价疫苗联合一到两次宫颈癌筛查项目,在资源有限的国家可能具有低成本高效益。
在9-14岁的女孩中6个月时间内进行一次随机对照试验,结果显示,一年内Cervarix二价疫苗的GMTs比Gardasil四价疫苗高得多:抗HPV16高1.7倍, 抗HPV18高5倍 。 除了两剂的Cervarix二价疫苗诱导比两剂的Gardasil四价疫苗更高的滴度外,两剂的Cervarix二价疫苗也诱导产生高于三剂的Gardasil四价疫苗的GMTs:抗-HPV16高1.4倍,抗HPV18高2.8倍。
间隔6个月的两个剂量的Gardasil9九价疫苗会诱导GMTs峰值,相当于两剂Gardasil四价疫苗在六个月的间隔时间内对HPV16和HPV18诱导的效价。 当两剂间隔2个月取代6个月时,Gardasil9九价疫苗比Gardasil四价疫苗诱导的GMTs峰值更高:抗HPV16高1.8倍,抗HPV18高1.5倍。 事实上,Gardasil9九价疫苗中的所有7种致癌型HPV在一年内给药时与6个月时相比具有更高的GMT峰值。 根据Gardasil四价疫苗的研究,在36个月及更多的时间里,效价峰值与稳定效价无关联,第二剂Gardasil9九价疫苗注射时机在6个月或12个月对最终保护无关,从而为临床实施提供了空间。
3.6. 25岁以上女性的免疫原性
Gardasil四价疫苗和Cervarix二价疫苗在25-45岁女性中均使用三剂疫苗进行试验。 在成年Gardasil四价疫苗受者中抗-HPV16的最高抗体滴度不低于16-26岁年轻女性; 同样,四个月的随访期在两个年龄组相似。 随着时间的推移,抗HPV16的血清阳性仍保持在97%以上。 相比之下,中年女性Gardasil四价疫苗诱导的抗-HPV 18滴度显著低于年轻女性,并在24个月时降至无保护性自然感染滴度水平。在四年的时间里,无论Gardasil四价疫苗使用年龄如何,抗HPV18血清阳性率减少仍然是存在的问题,仅有60%的16-26岁的年轻女性和48%的成年女性保留了血清阳性。
Gardasil9九价疫苗在成年女性中没有试验。
与16-25岁妇女的反应类似,Cervarix二价疫苗在25岁以上的女性中诱导产生的抗-HPV16和HPV18的峰值效价至少比自然感染高50倍。六年后的稳定滴度水平上在成年女性中抗HPV16滴度仍然不劣于年轻女性; 而在成年女性中,抗HPV18滴度低于16-25岁的人群,但仍大大高于自然感染的滴度。6年内所有中年女性都保留了抗HPV16的血清阳性,而抗HPV18的血清阳性保留率为97%。 在接种后的10年里,96%的女性表达了抗HPV16血清阳性,84%的女性表达抗HPV18血清阳性。
4.功效
4.1.针对意外感染和疾病的疗效
表2列出了WHO针对三种疫苗定义的感染和宫颈疾病分期的疗效汇总。 大多数预防HPV感染群体的疗效为95%置信区间。 以预防HPV16 / 18感染的终点为预防由HPV16 / 18引起的70%的宫颈癌; Gardasil四价疫苗和Cervarix二价疫苗都可以很好地预防持续的HPV16 / 18感染。 Gardasil四价疫苗和Cervarix二价疫苗对HPV16 / 18感染的保护分别持续至少5年和10年。 然而,HPV 16/18感染并不是Gardasil9九价疫苗的研究终点,只是仅从非劣效抗体滴度中推断功效。
表2宫颈HPV感染和疾病终点的疫苗疗效汇总表

Gardasil9九价疫苗和Cervarix二价疫苗都能很好地预防由任何HPV型引起的宫颈上皮内瘤变2级或更严重(CIN2,CIN3,原位腺癌(AIS),腺癌和癌,“CIN2 +”)的疾病终点。 Gardasil四价疫苗比Cervarix二价疫苗对任何HPV类型的CIN 2+的保护效果明显要差。 对于由任何HPV类型引起的CIN 3+终点,Cervarix二价疫苗提供了93%保护,显著高于Gardasil四价疫苗 ;Gardasil9九价疫苗没有这方面数据的报告。
预防性疫苗对于接种时已经HPV 阳性的妇女,没有任何一种疫苗能诱导感染或疾病的清除。
HPV相关疫苗血清阳性而HPV DNA阴性者在接种疫苗时,疫苗既能诱导抗体滴度又能产生远期保护作用。Gardasil四价疫苗诱导的回忆反应至少在36个月里高于HPV阴性女性诱导的抗HPV16滴度。 另一方面,HPV18血清反应阳性但DNA阴性的女性产生与血清反应阴性者相当的抗体应答。 Cervarix二价疫苗诱导非常高的抗HPV16 / 18抗体,在血清反应阳性和血清阴性妇女的峰值和稳定期均相当。这表明,对HPV已经暴露的女性,未来相同感染类型的预防接种是可能的。
在中东欧,HPV疫苗大面积使用,建议在接受HPV筛查的同时进行分流并在必要时进行治疗。30岁以上的妇女中进行疫苗接种,作为一项计划进行实施,以期降低宫颈癌发病率。
4.2. 异常筛查及其后遗症的预防
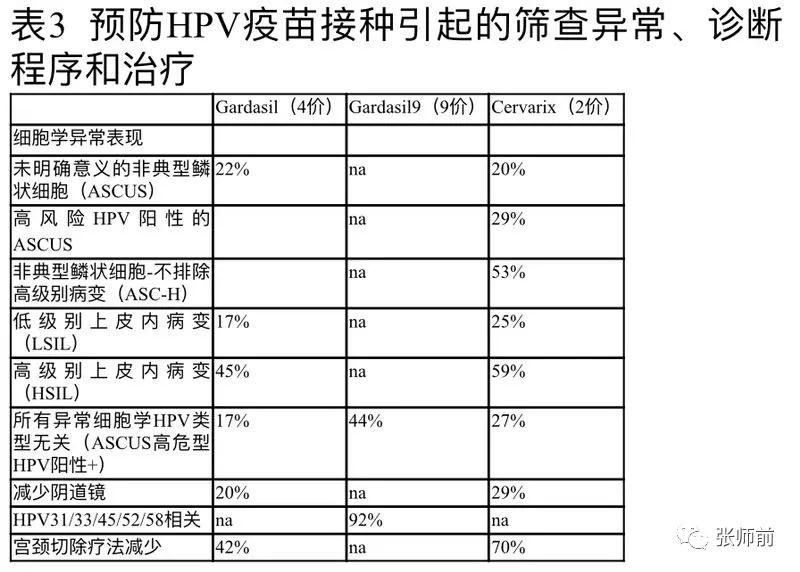
表3列出了由HPV疫苗试验中计算得到的可用数据,显示异常筛查试验女性所占比例有所下降。随后对诊断性阴道镜的需求与筛查结果成比例地降低(例如,ASCUS HR HPV阳性筛选的绝对数量大于HSIL筛选的绝对数量,因此ASCUS HR HPV阳性筛选的诊断阴道镜绝对数量的减少高于HSIL筛查的诊断阴道镜的绝对数量)。
表3 预防HPV疫苗接种引起的筛查异常、诊断程序和治疗
4.3. 非宫颈疾病的疗效
非宫颈疾病的临床方案的证据仅针对Gardasil四价疫苗和Gardasil9九价疫苗。Gardasil四价疫苗对WHO定义的阴道和外阴疾病如VaIN(阴道上皮内瘤变)2或3和VIN(外阴上皮内瘤变)2或3,分别与HPV16相关的有效率100%(95%置信区间:50-100);与HPV18相关的有效率100%(56-100),Gardasil9九价疫苗未报道对这种终点或HPV31、33、45、52、58相关的VaIN或VIN2或3有任何疗效。对目标人群的分析显示对HPV16的VIN1(未报道更高级别结局)95%置信区间的有效率接近100%;HPV相关的VaIN 3的95%置信区间的有效率接近86%;对于HPV18相关的VaIN或VIN 1无效。Gardasil四价疫苗和Gardasil9九价疫苗人群不包括有肛周疾病的女性和HPV16/18感染相关的口腔疾病。
虽然Cervarix二价疫苗没有非宫颈疾病的临床实验数据,但是NCI对目标人群在接种疫苗后4年对预防口腔、外阴和肛周持续的HPV 16/18感染进行了研究。HPV疫苗在接种后的4年对HPV16/18感染的外阴疾病有效率为54%(95%置信区间:5,79)和对HPV 16/18感染的口腔疾病的有效率为93%(95%置信区间)。近全部目标人群全面分析,在接种疫苗4年后对HPV 16/18感染的肛周疾病有效性为62%(95%CI:47,73);对与无疫苗相关的HPV 31/33/45感染的肛周疾病的有效率是49%(95%CI:30,64)。队列研究中,对HPV 16/18感染的不管宫颈、肛周或口腔部位的感染,在4年内的有效率为71%(95%CI:63,78)。这些分析表明,不管HPV16/18感染的解剖部位,Cervarix二价疫苗都能预防HPV 16/18感染。
5.过去十年全球对HPV疫苗接种的反应
从2006年6月第一批HPV疫苗的监管批准开始,到2014年10月,共有68个国家和12个地区通过了HPV疫苗实施方案。“Gardasil9九价疫苗”直到2014年12月才获得批准,因此没有被纳入在本次历史回顾中。世卫组织的两次剂量计划直到2014年年底才被推荐,也没有反映在这一历史性的审查中。
美国、澳大利亚、英国、苏格兰、新西兰、瑞典、丹麦、加拿大和德国等9个高收入国家继续跟进女性三剂HPV疫苗系列的研发。人群疫苗接种率超过50%情况下,2007-2014年7年的随访表明,女性接种疫苗后的人群水平的影响。在20岁以下的女孩的HPV疫苗注射计划开始后,HPV 16/18感染的发病率下降了64%。HPV 16/18发病率的下降与三剂疫苗接种的人群比例成正比,覆盖率越高,hpv16/18的感染率就越低。此外,在同一群女孩中,HPV 31、33和45的发病率下降了28%,表明了在Cervarix二价疫苗试验中发现了的交叉保护的证据。20 - 24岁的女性,HPV 16/18的发病率在同一时间段内下降31%,而且也与每个国家追赶疫苗接种计划实现的疫苗覆盖率呈正比(例如,接受三剂HPV疫苗的20 - 24岁女性的比例越大,HPV 16/18的感染率越低)。在20-24岁的人群中,非疫苗高危人群的HPV感染有小幅增加(RR=1.09,95%CI:0.98-1.22)但在流行率高的人群中却没有增加。只有一项研究表明,在15-19岁的女孩接种了三剂HPV疫苗后七年后CIN2+病变减少了21%。
虽然这些在高收入国家取得的成功有希望降低当地宫颈癌的发病率,但从全球的角度来看,并不乐观。在这7年的时间里,通过9-15岁的“主要的目标”和15到45年的“追赶目标”,将有1.18亿年龄在9-45岁的妇女接受HPV疫苗接种。这1.18亿人在宫颈癌的高危人群中占了相当小的比例,仅占全球女性人口的3.5%,占15-26岁女性的8.7%,占10-14岁女性的12%。在目标人群中,有4700万人接种了完整的三剂疫苗接种系列,这仅占全球女性人口的1.4%,占所有10-20岁女性的6.1%。另有1200万人接受三剂以下的疫苗,使全球接种疫苗的女性人口达到1.7%;在1.18亿的目标人群中,接受至少一剂的比例达到50%。
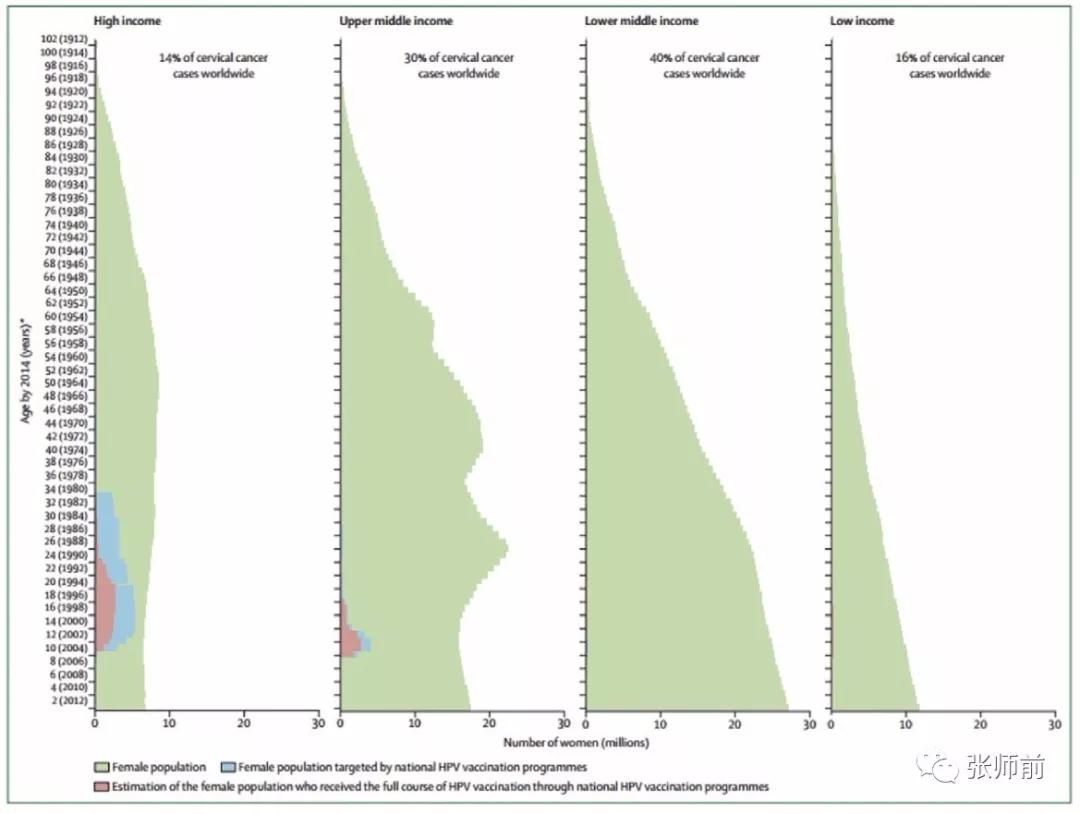
将世界划分为4个经济阶层,并通过出生队列覆盖每个阶层的人口。图3显示了全球4个经济阶层的宫颈癌负担的比例;它显示了针对当前人群的HPV疫苗接种运动的小目标人群;并且显示了HPV疫苗接种的完成情况。全球最高的宫颈癌负担发生在40%的中低收入阶层,没有证据表明有针对性的HPV疫苗接种。中高收入阶层占全球宫颈癌负担的30%,而其10岁至20岁的女性人口中,有7.2%的人完全接种了三剂疫苗。虽然高收入阶层有34%的目标人群完全接种了疫苗,但全世界只有14%的宫颈癌发生在这些有筛查条件的妇女身上。
在65年的时间框架内,本次评估推测全球宫颈癌发病率下降。接种疫苗的人数相对较少,有1.18亿人是接种疫苗的基础人群;研究表明,通过接种疫苗可以避免444627例宫颈癌,其中15%被认为只有一个疫苗剂量。虽然这是积极的,但仍将有675571例宫颈癌在全球范围内发生。
对这些数据的敏感性分析表明,即使在高收入国家将其疫苗接种率提高到100%的情况下,由于对宫颈癌的全球发病率的影响相对较小,因此对于预防宫颈癌的影响可以忽略不计。预防宫颈癌的重点必须放在中低收入阶层,接种疫苗和筛查在一生中至少进行一次。
6 HPV疫苗接种对筛查模式的改变
与降低宫颈癌发病率相关的是中高收入国家的筛查项目的质量。如果不继续参与这些筛查项目,宫颈癌的发病率将增加。早期的研究报告显示,HPV疫苗接种对宫颈癌筛查项目有持续的影响。
在美国,一项针对高风险、低收入女性的研究表明,在任何年龄,只接受一剂HPV疫苗的人,在21岁或更年长的人群中,最有可能参加筛查,远远超过那些接受2、3剂或不注射的人。大多数情况下,这些妇女在接种疫苗后的15天内首次接受筛查。但长期来看,在接受三剂疫苗的人群中,持续的筛查依从性更好;这些高度依从的女性比那些接受少于三次或没有接受注射的女性更有可能在7年内每3年进行一次筛查。尽管如此,参与筛查对妇女接种疫苗的年龄还是有影响的。在21岁以上的妇女中,完全接受3次接种的妇女,其初始筛查率明显高于21岁以下接种过3次疫苗的妇女,分别为:84%和24%。在疫苗注射的目标年龄内启动子宫颈癌筛查的低比率应该引起癌症控制官员的警觉。
保险状况是参与美国癌症筛查项目的一个重要预测因素。结果与高危人群的情况相反,在私人保险的女性中发现;那些在19岁以上接种疫苗并接受3次HPV疫苗接种的人更有可能在未来3年内进行初步筛选;不幸的是,这项研究并没有遵循连续性筛选。这项研究展示了“忧患”者在患病风险最低的情况下继续消耗更多的健康资源:接受三剂疫苗的人也是最有可能接受筛查的。
在澳大利亚,情况正好相反。女性在国家资助的目标年龄段接种了疫苗,赶上了HPV疫苗接种项目,并进入了澳大利亚的筛查项目。与相同年龄的未接种疫苗的女性相比,20-24岁和25-29岁年龄组的接种女性参与宫颈癌筛查的比例明显降低。此外,在30-34岁的女性中,选择接种HPV疫苗的只有28%参加了筛查,而未接种疫苗的30-34岁女性中有61%参加了筛查。
在苏格兰,1988年至1993年期间出生的女性参加筛查的比率呈普遍下降趋势。参与了HPV疫苗接种在某种程度上缓解了这种下降趋势,因为与接种不到三剂或未接种疫苗的妇女相比,接受三剂疫苗更有可能进行筛查;但接种疫苗人数也呈下降趋势。与未接种疫苗相比,接种三剂疫苗对筛查参与率的预测作用强于经济状况。在经济地位最高的女性中,未接种疫苗者的筛检率最低,为40%,而在接受三次接种的女性中,这一比例为54%(略高于一或两针后参与筛查的47%的比率)。在最贫困的苏格兰妇女中,如果她们没有接种疫苗或仅一次接种,其筛查率为44%,如果接种两次,则为48%,如果接种三次,则为53%。总的来说,无论是否接种疫苗,HPV疫苗引入后的筛查率都低于降低宫颈癌人群发病率所必须的水平。这是一个公共卫生问题。
在威尔士,从国家数据库中追踪了HPV疫苗接种后的筛查项目。与完全接种过疫苗的妇女相比,未接种疫苗的妇女筛查率更低(39%比55%)。尽管接种疫苗似乎与未接种疫苗的妇女相比有更高的筛查率,但筛查率仍然很低,只有大约一半的妇女。
瑞典人口健康登记的妇女参与了对19岁以上人群的筛查和机会性HPV疫苗接种。宫颈癌筛查率与美国的情况相似,在完全接种疫苗的妇女中,这一比例为86%,远远高于未接种疫苗的妇女(75%)。同样类似于美国人口,完全接种疫苗的女性比未接种疫苗的女性返回第二轮筛查的频率要高得多。
7 结论
预防性HPV疫苗是许多高收入国家免疫计划的一部分。虽然Cervarix二价疫苗仍然是最有效的疫苗,一剂疫苗中已证明有效。基于第七个月“Cardasil”四价疫苗和“Gardasil9”九价疫苗诱导的抗体效价、Cervarix二价疫苗免疫原性数据之外的疗效数据,世卫组织建议,Gardasil9九价疫苗或Cervarix二价疫苗在年龄达到15岁的人群使用两剂疫苗,而15岁或以上的女性接种三剂疫苗。因为目前还没有针对这类疫苗少于三剂的有效性数据。
Cervarix二价疫苗和Gardsail9九价疫苗,三剂疫苗预防cin2或任何HPV类型的效果都在62%左右;对于Cervarix二价疫苗而言,任何HPV类型预防CIN3或更高级别病变的效力是93%,Cardasil四价疫苗是43%,没有Gardsail9九价疫苗的数据。这三种疫苗都导致了阴道镜和宫颈切除术数量的减少。随机对照试验表明,与Cardasil四价疫苗相比,Cervarix二价疫苗对于HPV16和18的T细胞和B细胞功能具有较高的免疫原性;没有关于Gardsail9九价疫苗的可比较的免疫原性数据已经接种了HPV疫苗的女性进行再次接种,没有任何证据表明对HPV病毒感染的预防有任何改善。Cardasil四价疫苗和Cervarix二价疫苗在预防25岁以上妇女的HPV 16/18感染或疾病方面的有效性达到90%;在老年人群中,Cervarix二价疫苗对HPV 31和45感染有近70%的功效。结合筛查,可以为这些接种疫苗的女性提供在资源有限和疾病负担沉重的国家减少宫颈癌发病率。
在世界范围内,在9-45岁的女性中,HPV疫苗接种的比例不到2%,而且宫颈癌发病率最高的国家并未有效实施接种计划。疫苗接种并不能替代筛查。预防宫颈癌仍然依赖于参与正在进行的筛查项目。
Harper DM, DeMars LR.HPV vaccines – A review of the first decade .Gynecol Oncol,2017;Apr
 妇产科在线APP下载
妇产科在线APP下载













