基于性染色体定量检测的伴性遗传病无创性产前筛查方法的研究
遗传性疾病,是指因受精卵中的遗传物质异常或生殖细胞所携带的遗传信息异常所引起的子代的性状异常[1]。其中,伴性遗传病在整个遗传病中占有较大比例,如血友病、色盲和肾性糖尿病[2]。因此,胎儿性别的早期识别对于伴性遗传病的预防及出生人口整体素质的提高具有重要意义。然而,目前现存的一些胎儿性别识别技术存在诸多不足之处,如有创性操作可能致胎儿流产等[3]。鉴于此,本文拟构建一种基于x、Y 染色体用于胎儿性别早期识别的技术,并对50例孕妇妊娠期胎儿的无创性产前性别进行筛查,以期为伴性遗传性疾病的早期诊断提供参考。
1 材料与方法
1.1 标本来源选择 2012~2013年第三军医大学西南医院产科住院的孕妇静脉血。孕妇年龄20~35岁,平均27岁;孕周16~20周,平均18周。胎儿性别以出生性别为标准。同时随机选取本院体检中心进行体检的24例未孕健康女性静脉血标本作为对照。研究内容均得到了研究对象知情同意。
1.2 血浆DNA的提取 取孕妇外周肘静脉血2 ml为1个标本,4℃,1 600×g,离心10 min。收集上层血浆(约900 ml至1 L)转移至1支新的1.5 ml无菌Ep管中。再将所得血浆于4℃,18 000×g离心10 min,吸取上层血浆(约800 mL)转移至新的无菌Ep管中。之后,采用Qiagene公司的QIAamp DNA Blood试剂盒提取基因组DNA,50 μl洗脱液溶解,置于-2O℃低温冰箱保存备用。
1.3 Real—time荧光定量聚合酶链反应(PCR)反应条件的优化 引物和探针序列参照文献[4],分别由上海生工和上海基康合成,其中FAM 荧光探针主要针对x染色体,VIC荧光主要针对Y染色体。利用x、Y染色体特异性引物和探针构建20 μ的实时荧光定量PCR反应体系,体系包括尿嘧啶DNA糖苷酶(UDG)10 μl,X、Y染色体引物各1 μl,探针各1 μl,基因组模板2 μl,将其置于BIO-RAD CFX96TM Real—Time System设备进行分析。利用上述反应体系,分别对引物浓度、探针浓度和PCR的退火温度等反应条件进行优化。引物浓度分别设置为0.2、0.4、0.6 mol/L;探针浓度分别设置为0.1、0.2、0.3 mol/L,排列组合后共12组试验,退火温度均设置为6O ℃。然后利用1例女性及1例男性标本最佳的反应条件进行验证,并将其用于后续的临床孕妇标本的检测中,每个标本设置一个重复管,整体试验设置两个空白管。
1.4 判断方法 重复管中有2管均为阳性者为男性,2管均为阴性者为女性。如2管中仅有1管为阳性结果,则对此标本进行重复检测,重复结果如仍为阴性结果,则为女性,若有阳性结果,则为男性。此外,如空白对照中出现阳性条带,表明PCR受污染,则该次试验结果应从整个试验中剔除。反之,则试验结果可信。
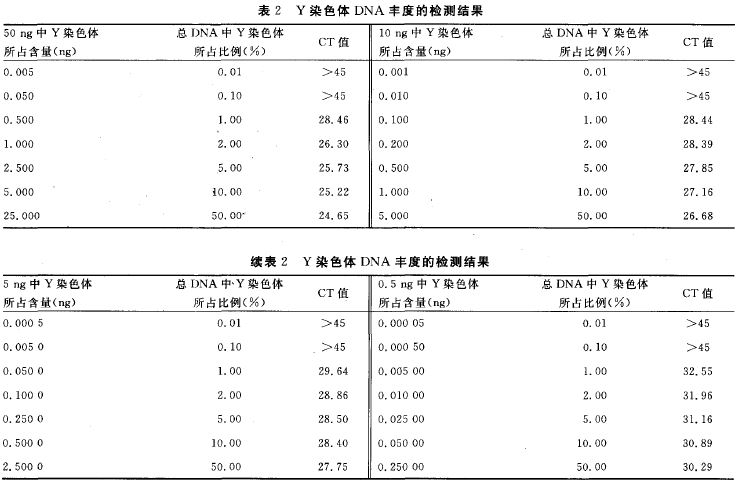
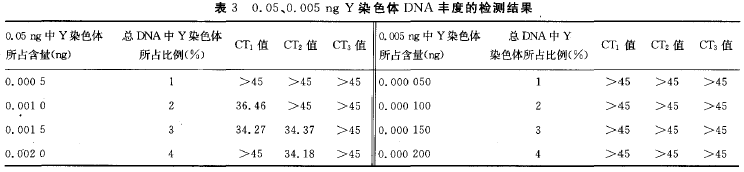
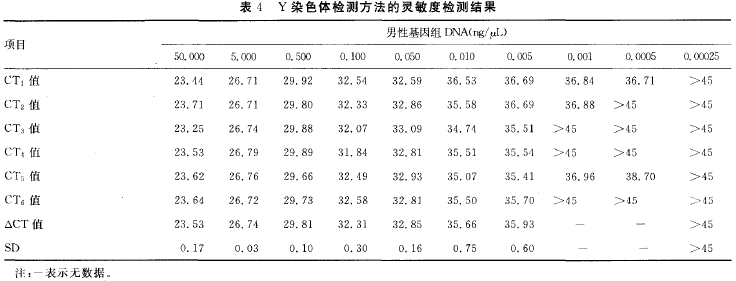
1.5 PCR方法的灵敏度检测 将2O μl反应体系中母体DNA模板量分别设置为5O、10、5、0.5、0.05 ng,最终使Y染色体DNA丰度分别为0.O1%、0.1%、1%、2%、3%、4%、5%、1O%、5O%,通过Y染色体及胎儿DNA 丰度的分析对本检测方法的灵敏度进行检测。同时,将男性基因组DNA进行倍比稀释,依次为5O、5、0.5、0.1、0.05、0.01、0.005、0.O01、0.000 5
ng/μl,对无母体DNA时Y染色体的灵敏度进行检测。
1.6 临床标本血浆游离DNA 的检测 根据上述建立及优化好的反应体系和条件,对临床5O例妊娠女性标本进行了胎儿性别的检测。
1.7 统计学处理 采用SPSS13.0软件进行统计学分析,以P 2 结果 2.1 Real—time荧光定量PCR反应条件的确定 通过对引物、探针浓度及退火温度等条件的优化,综合x、Y染色体扩增的CT值与x、Y染色体CT值差值的绝对值这两项指标,最终确定第11组为最佳条件,即引物浓度为0.4 mol/L,探针浓度为0.1 mol/L ,PCR反应参数:50 ℃ 2 min,95 ℃ 2 min,95 ℃ 15 s,60 ℃ 1 min,50个循环。见表1。将此条件确定为x、Y染色体检测方法的最佳反应条件,并且用于后续的临床标本检测中。 2.2 x、Y染色体检测方法的验证 两重复管中,女性标本只有FAM荧光通道检测到扩增产物,见图1(A)。男性标本中 FAM 与VIC荧光通道均检测到扩增产物,见图1(B)。空白对照管均未检测到扩增产物。 2.3 PCR方法的灵敏度检测 2.3.1 母体DNA量和胎儿DNA 丰度对检测结果的影响 给定胎儿DNA 丰度3%~6%时,将母体DNA 模板量设为5O、10、5、0.5 ng,此时,Y染色体检测方法的灵敏度检测结果显示:Y染色体的丰度小于1% 时,CT值大于45个循环,超出检测范围;而丰度为1% 时,以上不同母体DNA模板量的CT值依次为28.46、28.44、29.64、32.55,表明Y染色体DNA丰度的最低检测限为1%,低于此丰度则难以检测到,相当于胎儿DNA丰度最低为2 (表2)。 2.3.2 给定丰度时DNA模板量的检测下限 给定胎儿DNA丰度在3%~6%时,将母体DNA模板量设为0.05、0.005 ng。此时,当DNA量为0.05 ng时,3次重复Y染色体检测方法的灵敏度检测结果显示:Y染色体的丰度小于2%时,CT值均大于45个循环,超出检测范围;而丰度为2%时,CT值为36.46;丰度为3%时,CT值为34.27;丰度为4%时,CT值为34.18。由于检测下限存在概率问题,3次试验并不是每次都能检测出结果,故表明Y染色体DNA丰度的最低检测限为2%~4%,低于此丰度则难以检测到,相当于胎儿DNA 丰度最低为4%~8%。根据文献报道胎儿DNA丰度在3%~6%,因此,可以确定母体DNA模板量的下限为0.05 ng。当DNA量为0.005 ng时,Y染色体检测方法的灵敏度检测结果显示:Y染色体的丰度小于4%时,CT值大于45个循环,超出检测范围。故此试验可作为阴性对照,进一步说明该检测方法所需要的最低母体DNA模板量为0.05 ng(表3)。 2.3.3 无母体DNA时Y染色体的检测下限 男性基因组DNA进行倍比稀释后其结果显示:Y染色体模板量下限是0.5 pg,而 i,Y染色休DNA浓度是0.25 pg时,其CT>45个循环,作者判断它为阴性,超出检测范围(表4)。 2.4 49例妊娠女性胎儿性别的检测 除1例不合格标本未纳入研究外,在进行定性榆测的49例妊娠女性中,初次试验结果显示男性胎儿为17例,女性胎儿为32例。与出生后性别相比,有6例不符,均为如下情况:胎儿出生后性别为男性,本试验结果为女性。经分析,发现此6例标本的DNA模板起始用量均小于50 pg,未达到胎儿性别检测所需要母体血浆DNA的 (50 Pg)。为进一步检测此6例标本,作者将DNA模板的起始加入量增大(>5()Pg)进行重复试验,绎验证,发现检测结果均为男性,与出生后性别一致,准确性达到100%。 2.5 健康未孕女性与妊娠女性血浆游离DNA 的定量检测 在同定的阈值下,定量结果显示,健康未孕女性的血浆DNA浓度值最高为1.75 ng/mI ,最低为0.50 ng/mI ,平均值为1.1 3 ng/ml ;妊娠女性的血浆DNA浓度值最高为6.50 ng/mI ,最低为0.25 ng/mI ,平均值为3.38 ng/mI。妊娠女性比健康未孕女性的浓度值 2.25 ng/mI ,差异有统计学意义(P< 0.05)。ROC 曲线结果显示AUC 值为0.711(图2)。DNA浓度的截点ff[为1.38 ng/mI ,所以当浓度值大于1.38 ng/mI 时,确定为孕如,此时灵敏度为0.551,特异性为0.833。 3 讨论 伴性遗传性疾病是由位于性染色体上的致病基因所引起的疾病。此病分为x伴性遗传病和Y伴性遗传病两大类,发病率均较高,且疾病的种类较多,如遗传性肾炎、血友病、假性肥大性肌营养不良症等[5-7]。伴性遗传性疾病给家庭及社会带来沉重的负担,严重影响社会人口素质的提高。因此,胎儿性别的产前诊断对这类遗传病的预防具有重要意义。 目前,胎儿性别产前诊断的取材技术主要有羊水穿刺、绒毛膜活检和脐静脉穿刺术等,这些技术均对胎儿和孕妇健康具有较大影响。此外,胎儿性别鉴定的方法还有超声影像B超技术,这种技术较为安全,但要求胎儿发育程度较高,生殖器基本形成,妊娠达4个月以上,如果中晚孕期终止妊娠会给孕妇身心健康影响较大。近年来,有研究发现,孕妇外周血中存在游离胎儿DN A[8],并有学者已经将其用于府氏胎儿的无创性产前诊断[9]。因此,作者尝试利刚x、Y染色体的特异性引物及探针构建一种基于母体血浆游离DNA 的胎儿早期性别以别无创性产前筛杏技术。 本试验结果显示,给定胎儿DNA半度在3%~6%时,当母体DNA模板量为0.5~5O ng且要检测到胎儿DNA时,Y染色体DNA丰度最低达到1%,相当于胎儿DNA丰度最低达到2%,即当母体DNA>98%时,将无法检测到胎儿DNA。此时,检测下限不受胎儿DNA 绝对值的影响,主要受母体背景DNA的干扰,故此灵敏度检测试验主要揭示了母体DNA对胎儿DNA检测的于扰程度。同时,文献[1o]报道胎儿DNA占母体总DNA的3%~6%,而本试验检测到胎儿DNA 丰度下限为2%,进一步说明该检测方法能够准确检测出母体血浆中的胎儿DNA。 此外,当母体DNA在0.05~0.5 ng时,胎儿DNA 丰度下限足4%~8%,低于此丰度则难以检测到。而文献报道胎儿DNA丰度为3%~6%,其丰度值不可能无限制升高,因此母体DNA低于0.05 ng的情况不值得继续探索,0.05 ng即为母体DNA可以检测到胎儿DNA的下限值,此时说叫检测下限主要受胎儿DNA绝对值的影响。此外,当母休DNA为0.05 ng时,胎儿DNA 的丰度至少要达到4%,即为2 pg,仍高于无母体DNA干扰时Y染色体的检测下限0.5 pg(胎儿DNA 丰度下限为1 pg),说明此时胎儿DNA 丰度不但受胎儿绝对值的影响,同时也受母体DNA 的干扰。总之,Y染色体灵敏度检测试验说明只要母体DNA模板量大于5O pg,其检测灵敏度均可达到1%,相当于胎儿为2%;而当母体DNA模板量为5o pg时,则为检测胎儿DNA所需母体血浆I)NA模板量的下限值。 成功构建本检测方法后,作者将其应用于临床标本的检测中。初次试验在未考虑母体血浆DNA模板起始用量时,有6例标本检测结果与胎儿出生后性别不一致,且均为女性。探索其原因,胎儿DNA含量占母体DNA 含量的3%~6%[11 12],且单拷贝DNA所能检测出的量值为3.63 pg,故检测胎儿性别所需要母体血浆DNA 的量至少为60 pg左右,而本试验也进一步检测出母体血浆DNA量的检测下限为5O pg。因此,上述不一致的结果可能是因为PCR 的初始DNA未达到胎儿性别检测所需要的量所致。为进一步明确结果,作者加大了初始DNA 的含量(均大于50 Pg),重复进行本试验,结果显示均为男性,与出生后性别完全一致,49例妊娠女性标本的最终定性检测结果准确率为100%。本试验结果提示进行PCR时所用的DNA 模板量对于正确检测出胎儿性别非常关键。此外,有1例孕妇外周血中未检测到胎儿x、Y染色体,主要原因可能是DNA提取不当所致,其次也可能与孕妇外周血中胎儿DNA浓度波动幅度较大有关。 本试验除对49例妊娠女性DNA 进行定量检测之外,同时对24例健康未孕女性DNA进行了定量检测。两组数据比较发现妊娠女性比未孕健康女性的DNA 值高2.25 ng/mI(P<0.05),其高出的含量除部分为妊娠女性与未孕健康女性的生理差异外,其余可能主要为胎儿的DNA。此外,统计学结果显示ROC曲线的AUC 值为0.711,表明本方法用于鉴别妊娠与非妊娠女性具有一定的准确性。 综上所述,本试验成功构建了于性染色体定量检测的无创性产前筛查方法,其灵敏度及准确性均较高,可以用于临床孕妇产前筛查,对出生缺陷疾病的预防具有重要的意义。 参考文献 [1] 刘权章.遗传性疾病的产前诊断与防治[J].中国实用妇科与产科杂志,2002,18(9):514-517. [2] 裴开颜.性连锁遗传[J].国际生殖健康/计划生育杂志,2O10,29(4):309-311. [3] 陈彩艳,陈汉平.用孕妇血中胎儿细胞行无创性产前诊断的研究进展[J].中国优生与遗传杂志,2006,14(6):5-6. [4] Tong YK,Jin S,Chiu RW,et al.Noninvasive prenatal detection of trisomy 2 1 by an epigenetic—。genetic chromo—some—dosage approach[J].Clin Chem,2010,56(1):90—98. [5] 刘玉玲,吕峻峰,潘晓芬,等.遗传性肾炎一家系临床病理及候选基因突变分析[J].中国优生与遗传杂志,2009,17(12):22—23. [6] 周敏,徐鸣.血友病的治疗进展[J].华西医学,2012,27(2):206—209. [7] 郭雅洁,王咏红,佟月娟,等.疑似假性肥大性肌营养不良症患儿Dystophin基因缺失突变分析[J].标记免疫分析 与临床,2013,20(3):172—175. [8] Lo YM,Corbetta N,Chamberlain PF,et al.Presence of fetal DNA in maternal plasma and serum[ J].Lancet,1997,350(976):485—487. [9] Chim SS,Jin S,Lee TY,et al.Systematic search for ptacental DNA-methylation markers on chromosome 2 1:toward a maternal plasma—based epigenetic test for fetal trisomy 21[J].Clin Chem,2O08,54(3):500—511. [10]Lo YM,Tein MS,Lau TK,et al.Quantitative analysis of fetal DNA in maternal plasma and serum :implications for noninvasive prenatal diagnosis[J].Am J Hum Genet,1998,62(4):768—775. [ 11] Bustamante—Aragones A,Gonzalez-Gonzalez C,de Alba M R,et a1.Noninvasive prenatal diagnosis using ccffDNA in maternal blood:state of the art[J].Expert Rev Mol Diagn,2010,10(2):197-205. [12] Papageorgiou EA,Karagrigoriou A,Tsaliki E,et a1.Fetalspecific DNA methylation ratio permits noninvasive prenatal diagnosis of trisomy 21[J].Nat Med,2011,17(4):51O一513. [13] Hahn S,Zhong XY,Bt~rk MR,et a1.Both maternal andfetal cell—free DNA in plasma fluctuate[J].Ann N Y Acad Sci,2001,945(1):141—144. 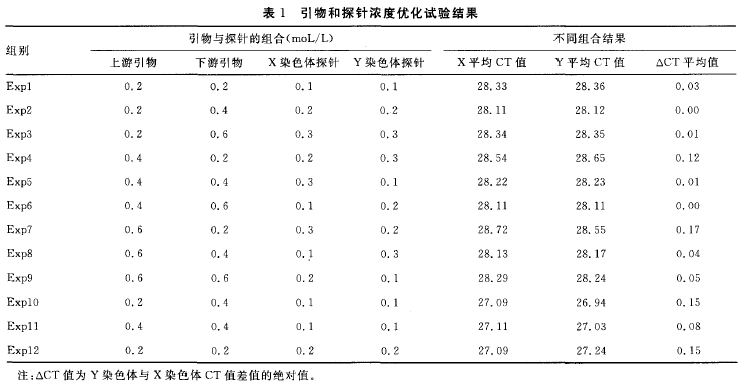


 妇产科在线APP下载
妇产科在线APP下载













