宫颈癌是女性生殖系统中最常见的恶性肿瘤,它严重威胁着妇女的健康和生命。宫颈癌的诊断主要依靠妇科检查行临床分期、细胞学和组织学检查行病理分级,确诊后根据情况进行胸部 X线摄片、膀胱镜及直肠镜等检查,以协助转移及临床预后的分析判断。 然而这种传统的方法难以客观准确的明确宫颈癌的侵犯范围。2009年国际妇产科联盟(FIGO)和国际妇科肿瘤协会(IGCS) 新版的各类妇癌的临床分期、手术病理分期及TNM(国际抗癌联盟)分期相结合的指南,越来越注重更精准的临床分期、病理分级及手术-病理分期,以能更好的计划手术范围及预测预后,减少治疗不足或过度治疗,提高生存率。MRI具有较高的软组织分辨率和多方位、多序列成像的优势,逐渐受到临床医生的重视。有研究表明MRI在宫颈癌的诊断及分期中有明显优势,能够弥补临床分期中检查的不足。但有关MRI分期与临床分期的准确率各家报道不一[1 ,2]。本研究对62例术前诊断为宫颈癌患者的MRI检查资料进行分析,与临床分期对比,探讨 MRI在宫颈癌诊断及其分期中的应用价值,
1 资料与方法
1.1临床资料 收集我院2003年8月至2009年12月间临床诊断为宫颈癌的患者62例。患者年龄最小为27岁,最大为75岁,平均年龄为45.8岁。临床症状主要表现为阴道不规则流血、流液,接触性出血,白带增多、有臭味。部分病例并无临床症状,为宫颈癌筛查时或体检时发现。所有病例均经手术病理证实并按照2003年FIGO(internationalfederation of gynecology and obstetrics)会议修订的标准进行分期[3],62例中原位癌 7例,Ⅰa 期 6例 ,Ⅰb期 23例,Ⅱa期6例 ,Ⅱb期 14例,Ⅲa期 2例,Ⅲb期1例,Ⅳa期1例,Ⅳb期2例。其病理类型包括:宫颈鳞癌55例,其中低分化鳞癌18例,中分化鳞癌25例,高分化鳞癌12例;宫颈腺癌7例,其中中分化腺癌5例,高分化腺癌2例。
1.2检查方法 所有病例取仰卧位,固定由一名高级职称的影像学医师行MRI检查。检查前嘱适量饮水(约300ml)。MRI检查采用GE Signal 1.5T MR机(Signal MR/i GE Medical systems),相控阵线圈(TORSO)。平扫采用轴位、矢状位及冠状位扫描。(视野)FOV:28~36;层厚/层间距=5mm/1mm。T1加权像(T1WI)采用自旋回波(SE)序列,扫描参数为重复时间(TR)/回波时间(TE):350~550ms/10ms,矩阵256X192~128,采集均数2。T2WI采用快速自旋回波(FSE)序列,扫描参数:TR/TE=3000~3200/110ms,矩阵320X224,采集均数4。所有病例常规应用动态增强扫描,增强前后行扰相梯度回波(SPGR)序列扫描,扫描参数为TR/TE=80~150ms/最小值(Minimun),矩阵256X192~224, 采集均数1,反转角(FA)为80˚。团注、屏气18~24秒,釓喷酸葡胺盐(Gd-DTPA,0.2ml/kg,3ml/s)后立即行SPGR轴位、矢状位及冠状位成像。其中32例加用了脂肪抑制技术。
1.3临床分期
采用2003年FIGO会议制定的宫颈癌临床分期方法[3],主要根据阴道、宫旁、盆腔壁、膀胱及直肠侵犯与否进行分期。
1.4 宫颈癌的MRI判断方法及分期
MRI轴面成像方位可确定宫颈、阴道、宫旁以及盆壁肿瘤的延伸情况;矢状面可直观显示宫颈与阴道、宫体、膀胱及直肠的解剖关系,用以观察肿瘤对子宫下段、膀胱、直肠的侵袭情况;冠状面可显示宫颈与盆隔的解剖关系,用以评估子宫旁、盆腔侧壁及子宫下段的改变。肿瘤组织T2WI上高信号局限于宫颈内,周围正常宫颈间质呈低信号环,判断为宫颈间质部分受侵;若低信号环消失或中断,在各个方位及各个成像序列上宫颈外缘光整,与宫颈旁脂肪间隙分界清晰、锐利,可判断为宫颈全层间质受侵但无宫旁侵犯;若宫颈外缘不规则、毛糙不光整或宫旁有软组织影,但未累及盆壁,应判断为宫旁受侵;如果肿瘤组织与盆壁间脂肪间隙消失,且盆壁肌肉边缘毛糙、不规则或盆壁肌肉内出现肿瘤组织信号,则判断为盆壁受侵;当肿瘤组织与直肠、膀胱间的间隙消失,相邻直肠壁或膀胱壁在 T2WI或增强后 T1WI上出现与肿瘤组织相同信号改变,则判断为直肠或膀胱受侵;肿瘤突入阴道形成肿块或在 T2WI上正常阴道壁的低信号由高信号取代,判断为阴道受侵;肿瘤超越宫颈内口突向宫腔或在 T2WI上宫体壁正常3 层结构消失,由肿瘤组织取代,则判断为宫体受侵。宫颈癌的MRI分期标准见表1[4][5]。
表1 宫颈癌的MRI分期标准
1.5 手术病理分期
手术医生详细记录送检标本来源,除按常规取材外,重点在术前临床发现的异常部位、术中所见异常以及 MRI异常信号处额外取材,病理评价应详细包括宫旁及子宫周围脏器浸润和淋巴结的转移。手术病理分期参考2003年FIGO分期.
1.6 统计学方法
采用诊断试验的方法,以准确率、敏感度等指标评价两种分期方法在宫颈癌分期及淋巴结转移中的价值。
2.结果
2.1 宫颈癌的MR表现
正常宫颈在平扫MRI T1WI上呈均匀性低信号,周围是高信号的脂肪组织,常可见呈低信号的子宫圆韧带和子宫骶骨韧带及具有流空效应的盆腔蔓状血管网。T2WI上,宫颈自内向外呈4 层信号表现:即高信号的宫颈管内黏液、中等信号的宫颈黏膜皱襞、低信号的宫颈纤维基质(其与宫体联合带相延续,为宫颈纤维肌肉性基质)和中等信号的宫颈肌层(与宫体肌外层相续,为较疏松的纤维肌肉性基质)[6](图1)。
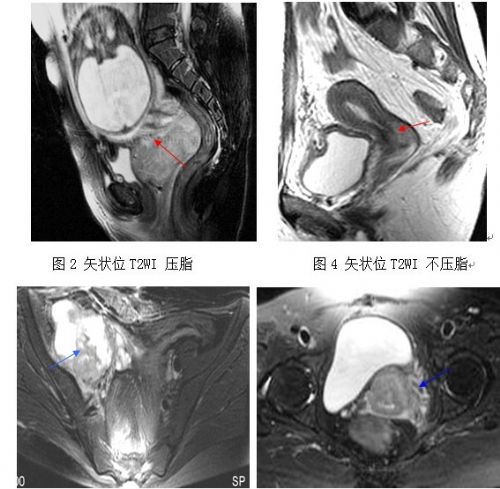
本文62例宫颈癌患者中,13例无阳性发现,其余49例表现为类圆形或不规则形肿块影,在 T1WI表现为等信号,与盆腔脂肪高信号形成鲜明对比;在 T2WI呈较高信号,与宫颈基质,子宫及阴道壁信号有明显差异。增强后均有不同程度的强化。其诊断宫颈癌的敏感度为79.0%(49/62),MRI检查无阳性发现的13例均为原位癌和Ia期患者。49例患者中小于30岁的年轻患者有4例,其中2例为宫颈癌合并妊娠。49例MRI表现中,宫颈部分间质受侵22例,呈类圆形;侵犯宫颈全层,无宫旁侵犯 9例;宫旁侵犯 13例;盆壁侵犯 2例 ,直肠侵犯 2例 ,膀胱侵犯 1例;49中例见28例侵犯阴道,肝脏转移1例,淋巴结转移12例(图2~4) 。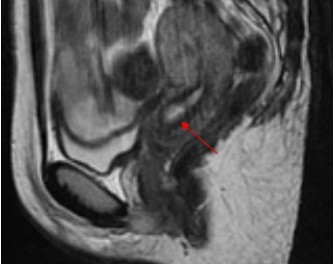
图1 矢状位T2WI 不压脂
图4 轴位T2WI 压脂 图5 轴位T2WI 压脂
图1为正常宫颈。图2宫颈癌合并妊娠,宫颈处菜花状实性肿块病灶,宫颈管变长,宫腔内见胎头影。图3宫颈癌矢状位T2WI显示癌组织局限于宫颈后唇,呈相对高信号,宫颈中间带消失,外膜光整,膀胱子宫间隙及子宫直肠间隙清晰。图4 显示右侧髂血管周围明显肿大淋巴结,融合、坏死明显。图5 显示为宫颈外膜不光整,软组织影突破外膜,左侧宫旁静脉丛的模糊、迂曲及增多。
2.2 宫颈癌手术病理分期、临床分期及MRI分期
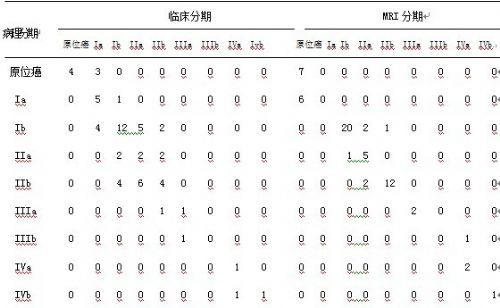
本文经临床分期诊断为原位癌 4例,Ⅰa期 12例,Ⅰb 期 19 例, Ⅱa 期 13 例, Ⅱb 期 9例,IIIa期2例,IIIb期0例,IVa期2例,IVb期1例。与病理分期对比,本文临床分期的总准确率为48.4%(30/62),原位癌~IIa期病例中约31.0%(13/42)被高估,Ib~IVb期病例中约38.8%(19/49)被低估。根据宫颈癌的MRI分期标准,本文MRI分期结果为原位癌13例,Ⅰb 期 21 例, Ⅱa 期9例, Ⅱb 期 13例,IIIa期2例,IVa期3例,IVb期1例。与病理分期对比,本文MRI分期的总准确率为79.0%(49/62),Ib期以上的MRI分期准确率约为85.7%(42/49),明显高于临床分期的准确率(48.4%)。详见表2。
表2 手术病理分期与临床分期、MRI分期的对比 (例)
2.3 MRI对宫颈癌淋巴结转移的预测
MR I检查示 12例淋巴结转移,其中Ⅱa期1例,Ⅱb期 7例 ,IIIa期1例, Ⅲb期 1例, Ⅳa 期 1例,IVb期1例。其中2例为误诊,病理证实为炎性增生肿大;另有2例漏诊,MRI上淋巴结虽然不大,但是取样活检发现已经发生转移。病理证实有12例发生淋巴结转移,MRI对淋巴结转移预测的准确性为83.3%(10/12)。
3.讨论
3.1 MRI对宫颈癌分期的评价
宫颈癌MRI分期的准确性有赖于其具有很高的解剖和组织分辨率,可多方位、多序列成像,能直观显示盆腔内各器官的解剖结构、各组织间的层次及肿瘤与正常组织的差异,为宫颈癌侵犯范围的判断提供了直观的解剖基础。宫颈癌的分期与治疗方案的制定与预后密切相关,术前判定宫颈癌宫旁有无浸润是制定治疗计划的关键所在。然而目前多数宫颈癌的术前分期主要是依靠临床评估,以 FIGO分期为标准。文献报道宫颈癌临床分期的准确率为61%~66%[7] 。本文临床分期的准确性仅为48.4%,其中13例存在着分期过高,19例则分期过低。造成其假阳性或假阴性的原因有:①双合诊和三合诊有主观性,炎性组织或部分为炎性组织有时感觉较硬时则以为癌性成分而至假阳性;②早期分期依赖妇科检查肉眼观察宫颈活检标本或阴道镜下取活检,这样就无法取得宫颈管内病变组织,尽管点状活检仍不能全面获取较深的浸润,造成分期过高或过低;③少量的宫旁浸润以及内生性宫颈癌,尤其绝经较长时间的老年妇女生殖器官萎缩,甚至阴道闭锁宫颈不易暴露而至假阴性;④手诊不易准确了解盆腔及主动脉周围有无淋巴结转移情况,而使分期降低。术前分期过高或过低,将会导致过度治疗或治疗不足。
MRI 因其较高的软组织分辨率、多方位为成像、无辐射等优点而在宫颈癌的诊断及分期中的作用越来越受重视。有文献报道宫颈癌MRI的分期准确性为75.1%,对宫颈癌侵犯部位和范围判断的准确率达 88.5%[8]。本文MRI分期的敏感度为90.3%,总准确率为79.0%,Ib期以上的MRI分期准确率约为85.7%。MRI分期明显优于临床分期(79.0%和48.4%),尤其是在宫旁浸润方面. 对于中晚期宫颈癌 MRI检查不仅能清楚的显示宫颈肿块的大小、范围、密度和轮廓,还可观察有无侵犯宫旁,有无浸润膀胱、直肠,有无输尿管、肾盂积液,而且还可以了解盆壁及腹膜后有无淋巴结或其他器官的转移,有利于分期,指导治疗方案的选择。而这些优势是临床的三合诊、细胞学或组织学等检查所不能代替的。尽管MRI在宫颈癌的分期中比临床分期有优势,但其存在一定的局限性,从而导致漏诊、分期过高或过低。造成其分期不准确的原因主要有:① MRI最大的不足是不能发现显微镜下证实的癌浸,但是这超过了MRI的空间构像及识别的能力;②MRI不易区分活检部位或宫颈部分切除后周围组织的水肿而导致分期过高;③年轻病人子宫明显前屈时,常规 MRI横断位与子宫长轴不垂直,不利于宫旁浸润的准确识别,易造成假阴性诊断;④对于较大的肿瘤,由于容易发生坏死,因而不易准确确定肿瘤的范围。随着MRI技术的不断发展,将逐步完善其在分期中的不足之处。如采用与子宫腔垂直的斜横断位 MR 成像可以提高判断宫旁侵犯的准确性。对宫旁浸润的高估,且较大的肿瘤常发生坏死,因而不易确定肿瘤的范围,采用MRI动态增强扫描和有助于解决较大肿瘤因坏死而不易确定肿瘤范围的问题,不但能进一步提高肿瘤的检出率,且能更好地评估宫旁组织的浸润和范围。阴道内线圈的应用进一步提高了 MRI发现较小肿瘤的敏感性,为早期发现病变提供了可能,特别是为那些需要保留生育能力而欲行宫颈锥形切除术的年轻病人赢得了手术时机[9]。
3.2 MRI对宫颈癌淋巴结转移的评价
淋巴结大小是目前 MRI 诊断淋巴结转移的主要依据,本文以10 mm为诊断阈值。淋巴结转移可作为术后肿瘤复发和患者生存率的重要的预测因素,如能及时、准确地发现盆腔淋巴结转移,采取积极的综合治疗,则有可能提高生存率[10]。因此,淋巴结转移虽然并不包括在FIGO分期内,如果术前就能对其准确地评价是十分重要的,临床检查预测淋巴结转移非常局限,多数研究者认为,当增大淋巴结短径>1cm时可视为转移,其准确度为 75%~ 85%[11] 。本文中MRI对淋巴结转移预测的准确性为83.3%,2例为误诊,2例漏诊。分析其原因主要为有些增大的淋巴结是反应性淋巴结增生而不是真正的淋巴结转移或淋巴结短径虽然小于10 mm ,但病理组织检查证实已有转移而导致假阴性。
总之,MRI对宫颈癌分期的准确性优于临床(79.0%和48.4%),MRI诊断宫旁浸润和淋巴结转移也有较高的准确性。术前行MRI检查可大大提高宫颈癌分期的准确性以及了解盆腔淋巴结转移的情况,有利于指导治疗和估计预后。
 妇产科在线APP下载
妇产科在线APP下载