评估与手术分期原则
宫颈癌切除的类型和治疗适用性
·宫颈癌的治疗按照《指南》中所划分的分期进行分层
·微浸润病变被定义为无淋巴脉管间隙浸润的 FIGO IA-1期。其发生淋巴转移的机率<1%,可进行锥切活检进行保守治疗,以保留生育能力((切缘阴性),不用保留生育能力或无关生育能力时也可进行单纯子宫切除术。锥切活检的目的是使用手术刀整体切除外宫颈和宫颈管。可为病理医生提供一个完整、未被切割的标本,没有电环切除的人工痕迹,有助于评估切缘状况。如果选择环形电切术进行治疗,标本不应该被切割,且必须小心,最小化电环切除在切缘处的人工痕迹。锥切活检的形状和深度可以设计成与肿瘤病灶的大小和类型、部位相互适应。如:若可能为颈管内浸润腺癌或原位腺癌,那么锥切活检将被设计为一个窄长可伸入内口的锥形体,以免漏诊宫颈管内可能存在的浸润组织。锥切活检使用与小型肿瘤的分诊、治疗。这种情况下不会出现且过可见肿瘤的可能性,伴 LVSI的 IA1期患者,采用锥切活检(切缘阴性)加腹腔镜下盆腔 SLN定位(对 SLN为 2B类)/淋巴结切除术是合理策略。
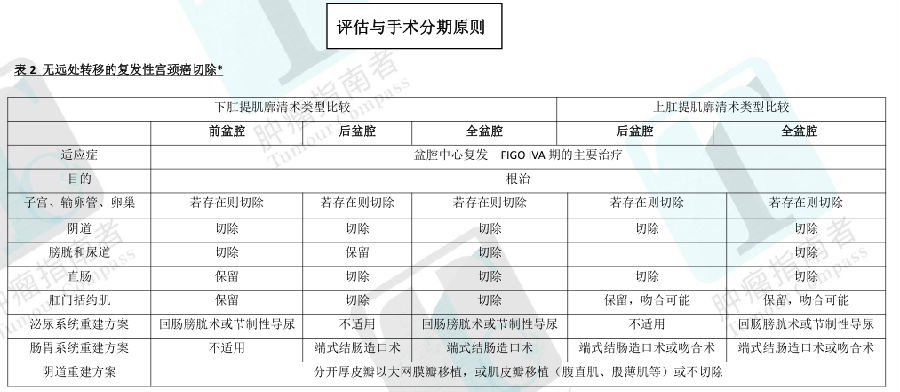
·如果不用保留生育能力,根治性子宫切除术加双侧盆腔淋巴结切除术对于 FIGO IA2 ,IB,IIA期是首选的,与单纯子宫切除术相比,根治性子宫切除术切缘更大,包括切除部分主韧带、宫骶韧带、和阴道上部 1-2cm,另外,骨盆(优势主动脉旁)淋巴结也会被切除。根治性子宫切除术可通过开腹手术或腹腔镜进行,而腹腔镜可用常规或机器人技术完成。Querleu和 Morrow分类系统是一个现代化的手术分类方法,其描述了三维切除平面中切除和神经保留的程度。最常用的子宫切除术类型见表 1(见 CERV-B 5/7)
·对于经严格挑选病灶直径≤2cm的 IA-2或 IB-1患者而言,经阴道根治性宫颈切除术加腹腔镜下淋巴结切除术(有或没有 SLN定位)提供了一种可保留生育能力的治疗方案。B型根治性子宫切除术切除宫颈、阴道上部、支持韧带,但宫体保留。目前报告的 300多例随后妊娠中,孕中流产可能性为 10%,但是 72%的患者妊娠达 37周或更长。腹式根治术宫颈切除术已经成为一个合理的保留生育能力的策略。与经阴道相比,这种术式的宫旁可切除范围更大,适用于选择的 IB1期病例,并且已经用在病灶直径达 4cm的病例。该手术类似 C型根治术。
宫颈癌的切除类型和治疗适用性
·如同指南介绍的一样,晚期病例,包括 FIGO IIB期及以上,通常不采用子宫切除术治疗。美国大多数晚期病例用过根治性化放疗来治疗。在一些国家,IIB期的选定病例可以通过前期根治性子宫切除术来治疗或通过新辅助化疗继以根治性子宫切除术来治疗。
·盆腔廓清术可能有潜力治疗放疗后盆腔中心残留或持续的病灶。廓清术的术前评估旨在用于确定或排除远处转移。如果复发限于盆腔,则进行手术探查。如果术中癌灶边缘和淋巴结评估为阴性。表 2汇总了采用不同类型盆腔廓清术中通常会切除的组织。(见 CERV-B 6/7)这些都是复杂的术式,应该在具有相应水平的医疗中心进行。初始盆腔廓清术仅限于罕见病例:骨盆放疗是禁忌,或之前因其他指证接受或盆腔放疗后发展为异时性、局部晚期宫颈癌并不适合进一步放疗的患者。
宫颈癌的前哨淋巴结定位
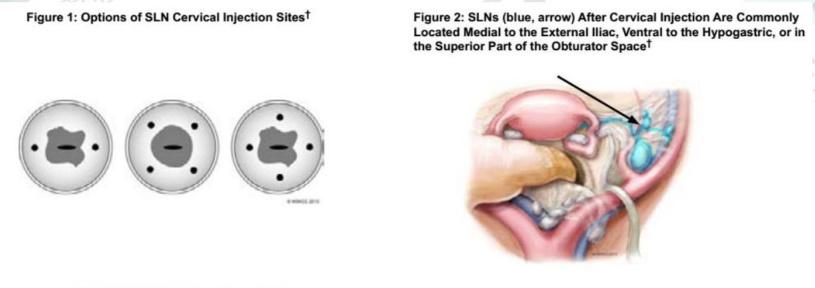
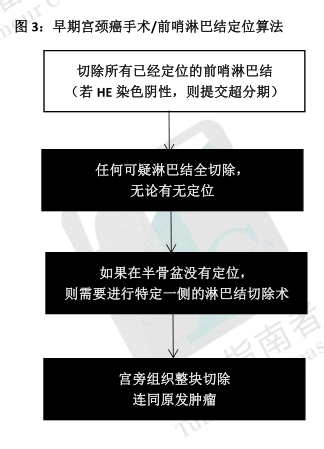
·SLN的定位作为对选定 I期宫颈癌患者手术处理的一部分在全世界妇科肿瘤实践中得到考虑。虽然这项技术已被用于直径达 4cm的肿瘤,但在直径<2cm的肿瘤方面检出率和定位效果最好。这项简单的技术利用直接注射到宫颈的染料或放射性胶体锝-99(99Tc),通常是 2点或 4点注射,如图 1。通过术中直观的观察有色染料来进行 SLN定位,如果使用吲哚菁绿(ICG)则采用荧光摄像头、若使用 99Tc则采用γ探测仪。注射后,SLN通常会被定位在髂外血管内测中部、侧脐韧带外侧或闭孔窝上方(图 2)SLN经病理学医生超分期,可实现对微转移的更高检测,进而可能会改变术后管理。
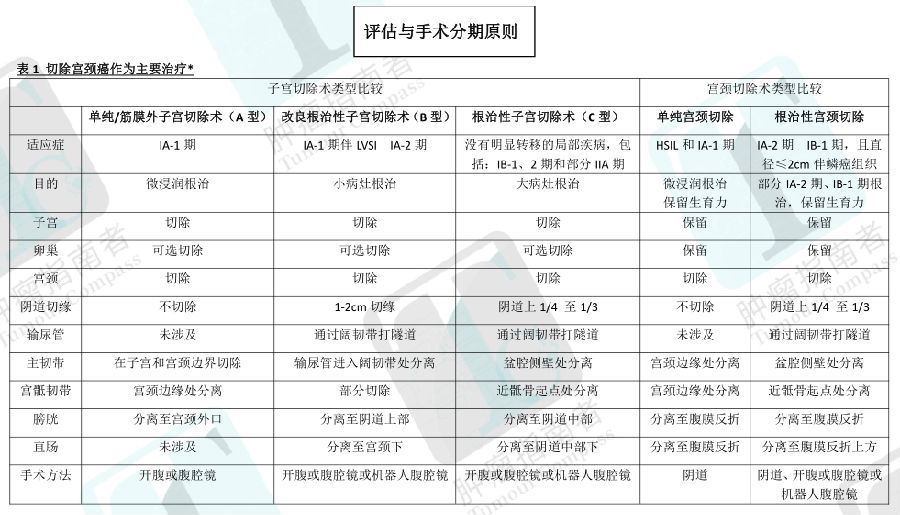
前哨淋巴结 (SLN )成功定位的关键在于严格遵守 SLN 算法,这需要定位失败时执行特定一侧淋巴结切除,以及不论有无定位切除任何可疑或可见扩大的淋巴结(图 3 )

放疗原则
外放射治疗(ERBT)
·CT为基础的治疗计划和适形设野是 EBRT治疗的标准治疗。MRI检查时区分正常软组织或宫旁浸润癌的最佳方式。对于未进行手术分期的患者,PET检查可用于辅助确定淋巴照射体积,还可考虑用于术后来证实排除了异常淋巴结
·外放射治疗应覆盖可见病灶(如果存在)、宫旁组织、宫骶韧带、距离可见病灶足够长的阴道边缘(至少 3cm)、骶前淋巴结以及存在风险的其他淋巴结体积。对于手术或影像检查发现没有淋巴及诶转移的患者,放疗应该包括整个髂外、髂内、闭孔淋巴结区。对于认为有较高的淋巴结转移风险的病人(如大肿瘤、证实或怀疑有低骨盆淋巴结转移),放疗应该还要再覆盖髂总动脉淋巴结。对于己证实髂总和/或主动脉旁淋巴结受累者,则建议盆腔和主动脉旁延伸野的放疗,上达肾血管水平(甚或更高,视受累淋巴结分布而定)对于累及下 1/3阴道的患者,应覆盖双侧腹股沟。
·对于镜下淋巴受累的治疗需要 EBRT的剂量约为 45Gy(剂量分割为 1.8-2.0Gy/日),对于小体积可见未切除淋巴区域可考虑额外高适形下增加 10-15Gy。患者在进行 ERBT治疗时,应该同步进项卡铂为基础的化疗(单独使用卡铂或卡铂+5-氟尿嘧啶)
·在子宫切除后调强放疗或治疗主动脉旁淋巴结转移时,IMRT和相似的高适形放疗方法可能对最小化肠道或其他临界组织的照射剂量有用。还可用于进行区域淋巴结转移较重的疾病需要进行大剂量放疗时。然而在治疗有完整的宫颈患者的中心病变,适形外照射(如 IMRT)不应该做为常规方案来替代近距离放疗。在进行 IMRT和相关高保形治疗前应该十分注重细节和再现性(包括考虑如何区分靶组织和正常组织、病人和内部器官的运动、软组织的变形、和严格的剂量测定和物理质量的保证)。规律的影像学指导,如 CBCT,可能对于确认每日软组织位置有帮助。
·GTV,CTV,PTV,OARs,DVH可用于保形放疗,尤其是 IMRT。
·SBRT是一种可被用于孤立性转移灶,并于 1-5分允许使用高放射剂量的体外放射技术且应该用于局部转移疾病且可考虑用于对于限制性疾病的再照射
部位。
近距离放疗
·对于所有患有原发性宫颈癌且不适合手术的患者来说,近距离放疗是根治性疗法中至关重要的组成部分这通常通过腔内途径进行,采用宫腔内管和阴道施源器实施。根据患者和肿瘤的解剖情况,子宫颈完好的宫颈癌患者近距离放疗的阴道放射源可采用卵圆体、环或者圆柱体(与宫腔内管联合使用)在紧接近距离放疗前进行 MRI影像可帮助划定残留肿瘤形状。当与 EBRT联合时,近距离放疗通常于治疗后期阶段启用,此时原发肿瘤己发生充分消退,可以满足近距离放疗仪器几何外形要求。对于早期病变(如 IA2期),单独使用近距离放疗(不联合 EBRT)是一种治疗方法。
·对于极少数的情况,解剖结构或肿瘤的几何形状导致腔内近距离放疗不可行的患者可能最佳的治疗时使用一种组织间的近距离放疗治疗方法。然而,这种组织间的近距离放疗需要特定的某个有经验和实验的医生或组织来进行,且应该批判性的参考各方意见。
·对于经选择的子宫切除术后患者(尤其是阴道粘膜手术切缘阳性或近切缘者),可采用阴道圆柱体近距离放疗作为 EBRT的辅助。惯例为阴道表面或其下 5mm。标准的分次计划包括对 5mm,5.5Gy×2分次;阴道表面为,6Gy×3分次。
·SBRT不是一种合适的来替代近距离放疗的常规方法。
·点 A,宫颈旁的参考点,被大量广泛的使用,可靠,是可再生的数据定量参数。但是点 A剂量系统的的限制使用原因包括不能将三维形态的肿瘤进行运算、不能个体化肿瘤和正常组织的关联。点 A的常用剂量对早期疾病 5.5Gy×5分次;较大肿瘤或疗效较差的肿瘤 6Gy×5分次。现有证据影像学短程疗法可提高疗效和降低毒性。MRI对于残留疾病的软组织显影较好且在适当的情况下进行 MRI检查可指导指南。当缺少 MRI时,也可选择 CT检查明确残余疾病但准确性较低。治疗的目标:实现对于≥80Gy的残余疾病 CTV2Gy的等效剂量,对于较大肿瘤或较差疗效的肿瘤治疗目标应该≥87Gy。正常组织剂量应依据指南被限制直肠剂量 2CC≤65-75Gy,乙状结肠 2CC≤70-75Gy,膀胱 2CC≤80-90Gy.若无法满足上述参数可考虑进行间质部穿刺补充放疗剂量。
放疗剂量考虑
·最常用的近距离放疗传统剂量参数及所采用的系统包括了明确指出的 A点剂量,并整合了基于解剖学考虑的子宫和阴道的“放射源的装置和剂量分布”的具体指南。同时计算标准化点 B,膀胱。直肠位点的剂量。目前的三维影像技术指导下的近距离挡料致力于寻求对肿瘤的最佳植入剂量覆盖,同时有可能减少对邻近膀胱、直肠、和肠道脏器的剂量。然而,大量的经验和肿瘤控制结果,以及大部分临床试验,基于点 A的剂量系统。相对于点 A剂量系统的推荐剂量,通过影像学检查下的近距离放疗来改进剂量的尝试需要谨慎,不要造成肿瘤受量不足。
·《NCCN指南》对于点 A的剂量推荐是基于传统且被广泛证实的剂量分割和低剂量率近距离治疗依据之上的。在所提供的意见中,对于 EBRT,剂量分割为 1.8-2.0Gy/日,对于近距离放疗,点 A的剂量谁当为一个 40-70cGy/h的 LDR。应用高剂量率的近距离放疗的临床医生应该依据线性二次方程来吧 HDR点 A的名义剂量转化为生物等效的 LDR点 A剂量。当与 ERBT联合时,有多种近距离治疗方案可用。更常用 HDR方法之一为 5次插入宫腔内管和阴道施
源器,每次给出 6Gy的名义剂量到点 A。所以,30Gy的 HDR点 A的名义剂量被分割为 5次照射。这被普遍认可为等同于采取低剂量率近距离放疗时点 A(代表肿瘤所受剂量)40Gy的剂量。在欧洲临床试验中证实,28Gy可分为 4次,对于高危 CTV的一个可能的腔内治疗剂量。较小的肿瘤或疗效较好的肿瘤可考虑较低剂量也会有足够的治疗。
完整宫颈的根治性放疗
·对于子宫完整的宫颈癌患者(即未接受过手术的患者)来说,针对原发肿瘤和有风险的区域淋巴系统的典型治疗方案为根治性 EBRT,剂量约为45Gy(40-50Gy)。EBRT的体积需依照由手术或放射影像学确定的淋巴结状态而定。原发宫颈肿瘤采用近距离放疗加量照射,对 A点行 30-40Gy (LDR的等效剂量)的额外照射,A点总剂量(如指南所推荐)达 80Gy(小体积宫颈肿瘤)至 85Gy或更高(大体积宫颈肿瘤)。可对可见的受侵未切除淋巴结进行评估,看能否追加 10-15Gy的高度适形(缩野)EBRT。采用更高剂量,尤其是 EBRT时,必须要注意排除或严格限制被纳入高剂量区域中的正常组织体积。
子宫切除术后的辅助放疗
·初始子宫切除术后,如存在 1个或更多得病理风险因素则提示需要进行辅助放疗。放疗至少要包括如下范围:3-4cm的上阴道残端,宫旁组织,最近的淋巴结区(例如髂外和髂内淋巴结),对于确定为淋巴转移的区域,放射野的上界需要适当延伸,通常推荐为标准分割的 45-50Gy的剂量。可对可见的受侵未切除淋巴结进行评估,看能否追加 10-15Gy的高度适形(缩野)EBRT。采用更高剂量,尤其是 EBRT时,必须要注意排除或严格限制被纳入高剂量区域中的正常组织体积。
术中放疗
·IORT是术中放疗时一项在开放性手术过程中,针对高危瘤床或鼓励无法切除残余灶给以单次,精确定位放疗的专业技术。尤其是在既往放疗体积内发生复发病灶的患者。在 IORT中,可以把所覆盖的正常组织(如肠或其他内脏)人工移离有风险区域。IORT通常通过不同尺寸(匹配手术确定的风险区)的限光筒引入的电子束完成,这样就进一步限制了放射接触的范围和深度,以避开周围正常组织。

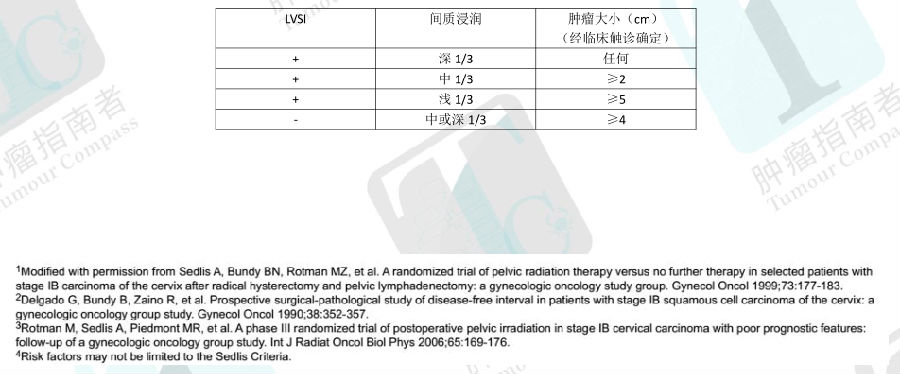
SEDLIS标准:淋巴结阴性、切缘阴性和宫旁阴性病例行根治性子宫切除术后考虑盆腔外放疗的资格
宫颈癌全身治疗方案
化放疗(首选药物)
·顺铂
·顺铂/氟尿嘧啶
复发或转移疾病
一线联合治疗
·顺铂/紫杉醇/贝伐株单抗(1 类)
·顺铂/紫杉醇(1 类)
·拓扑替康/紫杉醇/贝伐株单抗(1 类)
·卡铂/紫杉醇(已接受过患者为 1 类)
·卡铂/紫杉醇/贝伐株单抗
·顺铂/拓扑替康
·拓扑替康/紫杉醇
·顺铂/吉西他滨(3 类)
一线单药治疗
·顺铂(单药治疗首选)
·卡铂
·紫杉醇
二线治疗(除非有所说明。所列均为 2B 类)
·贝伐珠单抗
·白蛋白结合紫杉醇
·多西他赛
·5-FU
·吉西他滨
·异环磷酰胺
·伊立替康
·丝裂霉素
·培美曲塞
·拓扑替康
·长春瑞滨

 妇产科在线APP下载
妇产科在线APP下载













