一、概述
子宫内膜癌(endometrial cancer,EC)是女性生殖道常见恶性肿瘤,多发生于绝经后的老年女性,中位发病年龄63岁。约25%病例发生在绝经前,10%的患者年龄<40岁,并且近年来年轻子宫内膜癌患者发病率呈上升趋势。约80%年轻子宫内膜癌为Ⅰ型子宫内膜癌,与无对抗雌激素持续过高有关,分化良好。
年轻子宫内膜癌患者的临床及病理特征为:①月经不规律,或不规则阴道出血,少数患者月经无异常;病史中经常合并肥胖、多囊卵巢综合征、不孕不育等。②组织类型为子宫内膜样腺癌(endometrioid adenocarcinoma,EA),通常由子宫内膜不典型增生发展而来。雌激素受体(estrogen receptor,ER)和孕激素受体(progestrogen receptor,PR)表达阳性;肿瘤细胞多为高分化(G1),病变进展缓慢,预后好。③子宫内膜样腺癌Ⅰ期高分化时,盆腔或腹主动脉旁淋巴结转移风险为1%~5%,合并卵巢恶性肿瘤或者转移到卵巢的风险约为1%。
基于以上特点,对于有生育要求的年轻早期子宫内膜癌患者,可以保留生育功能。但应重视治疗前及治疗中的综合评估、治疗方案的选择和治疗中的随访,根据病情变化,及时调整治疗策略,保障患者生命安全。
二、适应证
早期子宫内膜癌保留生育功能需要完全满足以下条件:①年龄≤40岁,有强烈的生育愿望;②病理组织类型为子宫内膜样腺癌,高分化(G1);③影像学检查证实肿瘤局限在子宫内膜;④ER、PR均阳性表达;⑤血清CA125正常;⑥无孕激素治疗禁忌证;⑦治疗前评估生育功能,无其他生育障碍因素;⑧签署知情同意书,并有较好的随访条件。
几点说明
1. 年龄:对于40~45岁患者,如其强烈要求保留生育功能,在有经验的医师团队充分评估和患者充分知情下,可考虑给予保留生育功能治疗。
2. 影像学检查:首选盆腔磁共振成像(magnetic resonance imaging,MRI),高分辨MRI未见子宫肌层浸润及子宫外盆腔内肿瘤浸润或转移;如超声怀疑腹腔转移,需行腹盆腔CT检查;低剂量胸部CT排除双肺转移或原发性肺癌。
3. 肌层浸润:高分化子宫内膜样腺癌如仅浸润子宫浅肌层,应系统评估淋巴结转移,在不合并其他高危因素时,可以考虑保留生育功能。
4. PR表达:尽管有报道PR阴性病例经保守治疗后可获得完全缓解,欧洲妇科肿瘤学会(ESGO)提出50%PR阴性患者对孕激素治疗有效。但是大多数学者仍然认为PR阳性是保留生育功能的前提条件,并认为PR阴性是预后不良的因素。因此,建议监测患者PR受体情况,对于PR弱表达或阴性患者采取谨慎的态度,不推荐进行保守治疗。
5. 血清CA125:CA125升高提示可能发生远处转移,但在炎症、子宫腺肌病、子宫内膜异位症等疾病中也可升高。如能除外肿瘤转移,不应成为子宫内膜癌保留生育功能治疗的禁忌证,但应密切注意其动态变化。
6. 治疗前生育功能评估:①卵巢储备功能良好:月经第2~3天血卵泡刺激素(follicle stimulating hormone,FSH)<12IU/L,抗苗勒氏管激素(anti-Mullerian hormone,AMH)>1.1ng/ml,基础窦卵泡数(antral follicle count,AFC)>7个;②精液常规或睾丸、附睾穿刺结果提示有精子,即使合并男性因素不育症,也可实施保留生育功能治疗;③治疗前咨询生殖医学专家,对合适的患者进行遗传咨询或基因检测。
7. 知情同意书:患者应被告知保留生育功能治疗存在风险,需要严密随访,治疗可能失败,有切除子宫的风险,治疗药物存在副作用,治疗期间需密切监测评估。
三、评估及随访
1. 治疗前病情评估
1.1病史采集:详细询问月经婚育史;既往治疗过程及治疗反应;并发症及家族病史,如多囊卵巢综合征(polycystic ovarian syndrome,PCOS)、不孕症、Lynch综合征、糖尿病、高血脂等。
1.2查体及全身状况评估:包括身高、体质量、体质指数(body mass index,BMI)、腰围、腰/臀围比等;妇科检查;全血细胞计数;肝、肾功能;空腹血糖、胰岛素;出凝血时间;心电图。
1.3病理诊断:推荐宫腔镜直视下活检获取子宫内膜标本。由具有经验的妇产科病理医生进行阅片诊断,诊断内容包括病理类型、肿瘤分级及ER、PR表达情况,有条件者建议进行子宫内膜癌分子分型:可采用免疫组化染色检测标本中p53基因突变及错配修复(mis match repair,MMR)蛋白的表达情况;采用测序法检测POLE基因突变情况。一旦具有MMR蛋白缺失,可进一步完成Lynch综合征的筛查。
1.4彩色多普勒超声和盆腔MRI检查:评估有无子宫深肌层浸润和子宫外病灶(卵巢转移,淋巴结转移等)。
1.5合并症病情评估:治疗前要评估相关合并症,例如糖尿病、高血压、肥胖症、激素代谢紊乱及糖脂代谢异常等,必要时行75g糖耐量试验。
2. 治疗期间病情评估:每治疗12周为一个疗程。开始治疗时,可每4~6周随诊一次,应用经阴道彩色多普勒超声观察子宫内膜厚度及侵肌情况;以后每疗程后1周内行经阴道彩色多普勒超声和(或)MRI评估子宫大小、子宫内膜厚度及有无肌层浸润,了解盆腹腔脏器情况;每疗程结束时,推荐宫腔镜下采集内膜组织标本,进行子宫内膜病理检查。
2.1副反应评估:包括体质量增加、不规则阴道出血、乳房胀痛、食欲下降、恶心、呕吐、皮疹、血栓栓塞性疾病等。测量体质量、腰围、腰/臀围比等,检测肝、肾功能等。
2.2疗效评估及处理
2.2.1疗效判定标准——病理学及影像学(1)完全缓解(complete response,CR):组织病理中未见子宫内膜非典型增生和子宫内膜样腺癌的病灶;腺体完全萎缩退化,间质疏松水肿,甚至蜕膜样变;影像学检查未见胸、腹、盆腔内存在肿瘤的证据。(2)部分缓解(partial response,PR):子宫内膜腺体拥挤程度降低,但是乳头、筛状等结构仍可存在;腺上皮的异型性减低。表现为上皮复层消失、密度减低、核染色质变细,也可以表现为腺体呈现明显分泌反应或是化生性表现,包括鳞状化生、嗜酸性化生及黏液化生;影像学检查提示子宫内膜癌的病灶有缩小征象。(3)无反应(no response,NR或no change,NC):与治疗前病理结果比较,癌组织无改变;或仍有明确的残余癌灶,癌灶内的子宫内膜无退化和萎缩,无孕激素治疗后的相应变化;影像学检查提示子宫内膜癌的病灶无变化。(4)疾病进展(disease progression,DP):肿瘤组织病理学分级上升,细胞异型性增加;获取的组织病理中提示新出现明确的肌层浸润、脉管或(及)神经侵犯;或影像学显示子宫肌层浸润、子宫外病变,或远处转移,或淋巴结转移。(5)复发(recurrence):完全缓解后,标本中再次出现治疗前病灶(子宫内膜非典型增生或子宫内膜样腺癌);或影像学提示子宫内膜和/或肌层再次出现病灶。
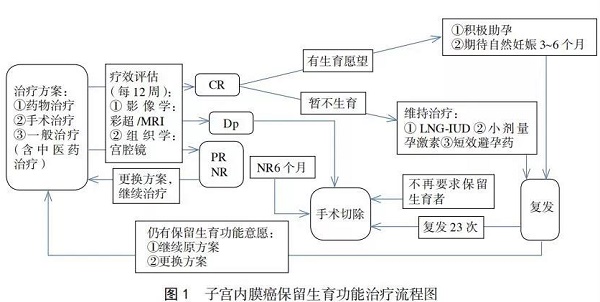
2.2.2评估后处理治疗12周评估为CR时,建议继续巩固治疗12周。连续两次病理学达到CR时,按照患者意愿分为尽快生育和暂不生育两种情况,希望尽快生育者可开始准备妊娠,推荐辅助生殖技术(assisted reproductive technology,ART),也可以期待自然妊娠;暂不生育者,推荐维持治疗。
(1)完全缓解后的临床处理
1)助孕:完全缓解后,推荐积极助孕。体外受精-胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)是相对高效的助孕治疗措施,但其促排卵治疗中高雌、孕激素状态对子宫内膜癌的影响,尚无明确结论,患者需对此充分知情同意,同时在治疗过程中需选择适当治疗措施控制雌、孕激素水平。
2)自然妊娠:期待自然妊娠3~6个月。期待妊娠时间不宜过长,3个月后仍未妊娠时,应及时予以相应的检查及采用辅助生殖技术治疗。由于肥胖症患者自然妊娠率较非肥胖症患者明显降低,建议肥胖症患者积极减重,调整饮食和生活习惯,病情完全缓解后尽早ART助孕。
3)维持治疗:患者在完全缓解后,等待生育或暂时不生育期间,应给予维持治疗,使月经规律,同时预防疾病复发。常用的维持治疗方式有:宫腔内放置左炔诺孕酮宫内节育器(levonorgestrel releasing intrauterine system,LNG-IUS),周期性口服小剂量孕激素(例如地屈孕酮20~40mg/d,每月≥10~12d),或口服短效避孕药,可以降低病变复发风险。维持治疗期间每3~6个月进行超声检查,必要时行子宫内膜病理学检查。
(2)部分缓解及无反应或进展患者的处理,参见下文。
四、治疗方案
1. 药物治疗:首选大剂量孕激素
1.1目前最常用的孕激素是醋酸甲羟孕酮(medroxyprogesterone,MPA)和醋酸甲地孕酮(megestrol acetate,MA)。
1.2常用剂量:MPA每日250~500mg或MA每日160~320mg,口服,可分2~3次。治疗期间可根据有无阴道出血、子宫内膜厚度的变化在上述剂量范围内增减剂量。
1.3效果:一般在孕激素用药后12周起效,多数病例在用药3~6个月后病变部位内膜病变逆转,达到完全缓解。一般有效率为68%~85%,复发率为30%~40%。其中体质指数与有效率和复发率相关,当BMI>35kg/m2时,容易导致治疗失败和复发。目前有报道治疗时间延长,可提高治疗有效率。并未发现使用更大剂量孕激素可以取得更好的治疗效果。
1.4副作用:大剂量孕激素治疗时的常见副作用为阴道出血、体质量增加及肝酶升高,较少患者出现过敏反应如皮疹等。无法耐受大剂量高效孕激素治疗的患者,可以选择其他方式治疗。
1.5首选药物治疗未获完全缓解时,应当重新评估风险,可选用或联合应用下列药物继续治疗:①促性腺激素释放激素激动剂(GnRH-a),3.6mg/3.75mg,每28天皮下注射一次;②左炔诺酮宫内缓释系统(LNG-IUS),对于不能耐受大剂量孕激素全身治疗的患者,可采用LNG-IUS及GnRH-a联合使用;③芳香化酶抑制剂,例如来曲唑,2.5mg,一日1次口服。④中药治疗:部分患者辅助中药治疗,可提升疗效。
1.6合并2型糖尿病或胰岛素抵抗的患者,可考虑同时使用二甲双胍,一日750~2000mg,分3次服用,可增加治疗有效率。
2. 手术治疗:宫腔镜下电切病灶组织,手术前后可使用大剂量孕激素口服或LNG-IUS及GnRH-a联合使用。目的是尽量减少肿瘤负荷,提高疗效,缩短达到完全缓解(CR)所需时间。注意:操作时间不宜过长,膨宫压力适当调低,防止医源性肿瘤扩散,并注意预防宫腔粘连。
3. 一般治疗:子宫内膜癌通常合并2型糖尿病、高血压和肥胖症。年轻患者中主要以肥胖症和2型糖尿病为主。BMI>35kg/m2时,子宫内膜癌的发生风险将显著增加。控制体重,使BMI≤25kg/m2,并控制和稳定血糖,有助于提升疗效。部分患者辅助中药治疗可以改善疗效。
4. 终止保留生育功能治疗
适应证:符合下列任何情况之一者,应停止保留生育功能的治疗,并行手术治疗,是否保留卵巢取决于患者年龄和病变风险。①有确切证据证实疾病进展者;②持续治疗6个月,疾病无反应者;③反复复发者;④不再要求保留生育功能或不能耐受保留生育功能治疗者。
完成生育的患者和复发患者,应切除子宫。其原因是子宫内膜癌的发生原因尚不明确。尽管经过治疗病情完全缓解,并完成生育功能,但病因尚未除去,仍存在肿瘤复发转移,甚至死亡的风险。但是也有患者生育后要求保留子宫,应在充分告知疾病的复杂性和风险性,在医务人员严密观察下,对无复发高危因素或高危因素较少的患者,可以尝试保留子宫,终身严密随访。
子宫内膜癌保留生育功能治疗流程见图1。
五、子宫内膜癌保留生育功能后助孕策略
子宫内膜癌孕激素治疗多在2年内复发,建议子宫内膜癌保留生育功能治疗完全缓解后,尽快行孕前检查,明确是否存在影响妊娠的因素。根据不同情况实施个体化助孕方案。如监测排卵、诱导排卵,考虑到年龄对生育功能的影响,建议尽早采用ART助孕治疗,详见图2。
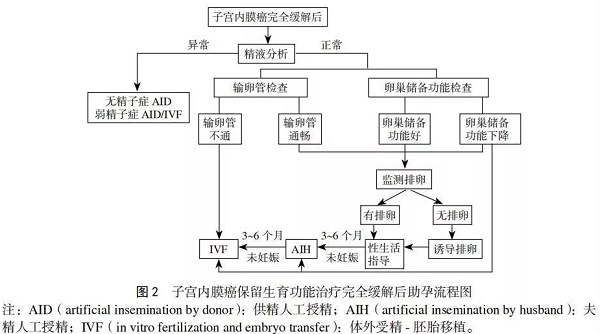
助孕策略选择
1.1针对卵巢储备功能良好、有排卵、输卵管通畅、精液基本正常的夫妇建议自然妊娠。监测排卵、指导性生活,期待3~6个月。如仍未孕,建议采用ART助孕。该情况也可直接采用ART助孕治疗。
1.2针对卵巢储备功能良好、无排卵、输卵管通畅、精液基本正常的夫妇建议诱导排卵、指导性生活。鉴于子宫内膜癌是雌激素依赖性肿瘤,建议使用芳香化酶抑制剂如来曲唑诱导排卵。如3~6个月仍未孕,建议采用ART助孕。也可直接采用ART助孕治疗。
1.3针对合并肥胖症、多囊卵巢综合征、无排卵、卵巢储备功能下降等的患者由于此类患者自然妊娠较为困难,建议尽早采用ART助孕治疗。
2.辅助生殖技术助孕
2.1人工授精(intrauterineinsemination,IUI):如输卵管通畅,精液常规提示弱精子症或具备人工授精指征者,可以采用IUI助孕。
2.2IVF-ET:如IUI后未孕或合并IVF-ET的指征,建议采用IVF-ET助孕。为了降低促排卵期间血雌激素水平,建议联合使用芳香化酶抑制剂如来曲唑进行促排卵治疗。根据精液的情况行IVF-ET或卵细胞质内单精子注射(intra cytopla smicsperm injection,ICSI)实施授精、胚胎移植。
注意事项:
(1)促排卵治疗可能会增加子宫内膜癌复发风险,建议在促排卵治疗过程中,使用低剂量促排卵治疗,推荐使用来曲唑等药物进行高雌激素控制,同时要注意保护内膜。
(2)对于促排卵治疗中,高雌孕激素状态患者建议进行全胚冷冻,降低卵巢过度刺激综合征(ovarianhyperstimulationsyndrome,OHSS)风险,若胚胎未移植或移植后未孕,建议尽早将患者转诊至妇科肿瘤医生,评价促排卵治疗后子宫内膜的情况。
(3)未成熟卵体外成熟技术无需使用促排卵治疗,对于合并多囊卵巢综合征等或卵巢储备功能良好的患者可作为辅助生殖治疗方法。
(4)部分患者采用针灸治疗,可能改善子宫内膜容受性。
2.3卵母细胞冷冻保存
卵母细胞冷冻保存也是可选择的治疗方案之一,尤其适用于未婚患者或因个人意愿或伦理考虑选择卵母细胞冻存的患者。
特别提示:已冻存卵母细胞或胚胎的患者,如在获得妊娠前因疾病复发、进展行子宫切除术,助孕治疗需严格遵照国家法律进行。
六、子宫内膜癌保留生育功能患者的围产期管理
1. 妊娠期监测:整个孕期需做好营养及体质量管理,监测患者妊娠期代谢系统相关并发症,例如:妊娠期糖尿病(gestational diabetes mellitus,GDM)、妊娠期高血压疾病(hypertensive disordersin pregnancy,HDP)、高血脂、甲状腺功能异常等;评估血栓风险;超声监测胎盘位置,警惕前置胎盘或胎盘植入发生的可能性。一旦临床诊断妊娠期糖尿病、妊娠期高血压疾病或前置胎盘、胎盘植入,可参照相应的临床指南进行管理。
2. 分娩期处理
妊娠顺利,可于妊娠41周前终止妊娠,如果出现相应的并发症,则根据具体病情选择终止妊娠的孕周。子宫内膜癌不是剖宫产的手术指征,可依据产科指征选择分娩方式,珍贵儿可适当放宽手术指征。
由于多次宫腔操作史,存在胎盘因素导致的产后出血风险,注意积极预防并处理。建议剖宫产术中对子宫内膜多点活检(尤其根据妊娠前诊刮或宫腔镜结果进行活检)。胎盘组织、胎盘母面组织、胎盘附着面蜕膜及浅肌层送病理。术前需要充分知情同意,沟通剖宫产术中同时切除子宫的利弊。这类患者在终止妊娠后,均应按常规进行随访。子宫内膜癌患者成功妊娠后的孕期管理流程见图3。
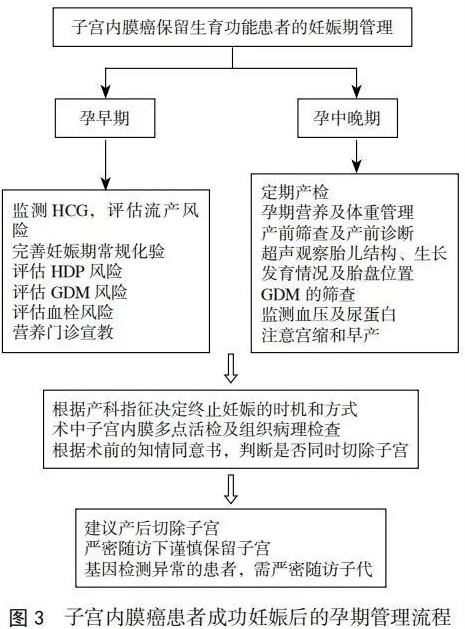
3. 分娩后处理:完成生育后,产后的子宫仍然面临肿瘤复发的风险,建议产后切除子宫,特别是伴有复发高危因素,如子宫内膜样腺癌中分化(G2)、病灶有侵肌、BMI>30kg/m2等,应切除子宫,可以考虑不行双侧卵巢切除术及系统的腹膜后淋巴结切除术。对于没有复发高危因素的患者,如希望能够继续保留生育功能,应充分告知其复发及疾病进展风险,严密随访下谨慎地保留子宫。随访期间,推荐维持治疗,可选用适当方式维持规律月经,保护分娩后的子宫内膜。
由于子宫内膜癌的发病可能与某些遗传因素有关,患者子代遗传情况尚不明了。目前已知Lynch综合征与年轻子宫内膜癌相关,近半数将于45岁之前发生本病。因此,当基因检测发现存在MMR,尤其出现在MLH1、MSH2、MSH6和PMS2时,应严密随访患者的女性子代。
七、存在问题及展望
本共识希望能对各级医疗机构和医师的临床工作提供参考。由于子宫内膜癌病因尚不明确,保留生育功能的临床研究,尚缺大样本和(或)随机对照的临床试验。现有数据多来自于队列研究、病例系列分析、小型非随机临床试验,循证医学的证据尚不充分。已知的多中心临床研究尚在进行中,目前采用的干预手段是否恰当、现有治疗方案是否综合考虑了子宫内膜癌控制、子宫内膜保护、治疗后疾病复发与以往手术切除后的复发意义是否不同、治疗对生育结局及社会心理等方面的影响,以及对患者后代成长、健康问题的认识等方面仍缺乏充分数据证实。因此,迫切需要多中心、大样本和(或)随机对照临床试验,为临床工作提供更多、更可靠的循证医学证据。
执笔人:周蓉、鹿群、刘国莉、王益勤、王建六(北京大学人民医院)
参与讨论专家(按汉语姓氏拼音字母顺序排列):陈春林(南方医科大学南方医院)、陈晓军(复旦大学附属妇产科医院)、何勉(中山医科大学第一附属医院)、孔北华(山东大学齐鲁医院)、李蓉(北京大学第三医院)、凌斌(北京中日友好医院)、刘从容(北京大学第三医院)、刘继红(中山大学附属肿瘤医院)、马丁(华中科技大学同济医院)、乔杰(北京大学第三医院)、曲芃芃(天津市中心妇产科医院)、沈丹华(北京大学人民医院)、汤惠茹(北京大学深圳医院)、万小平(同济大学第一妇婴医院)、王刚(广东省佛山市第一人民医院)、王屹(北京大学人民医院)、魏丽惠(北京大学人民医院)、向阳(中国医学科学院北京协和医院)、谢幸(浙江大学妇产医院)、薛凤霞(天津医科大学总医院)、徐礼江(广东省佛山第一人民医院)、杨慧霞(北京大学第一医院)、姚元庆(解放军总医院)、张瑜(中南大学湘雅医院)。
参考文献略
 妇产科在线APP下载
妇产科在线APP下载













