卵巢恶性肿瘤为妇科恶性肿瘤发病的第3位,尚未找到有效的早期筛查方法,治疗后复发率高。近年来,聚腺苷二磷酸-核酸聚合酶(PARP)抑制剂治疗上皮性卵巢癌取得显著进展。
1、筛查、遗传倾向与干预
大部分卵巢癌是散发性的,遗传性卵巢癌约占所有卵巢癌患者的15%。遗传性卵巢癌患者平均发病年龄较散发性卵巢癌患者早,多携带BRCA基因(breast cancer susceptibility gene)的突变,罹患其他恶性肿瘤的风险增加。病理类型主要为浆液性乳头状囊腺癌,预后较好。
流行病学资料显示,无胚系BRCA基因突变的女性一生中患卵巢癌的几率为1%~2%,而有BRCA1突变的女性一生的患病风险为21%~51%,有BRCA2突变的女性一生的患病风险为11%~17%。因此,有必要对高危人群进行BRCA基因的检测。高危人群包括:近亲有人患乳腺癌、卵巢癌或其他相关癌症;或绝经前患乳腺癌;或同时患多个相关的肿瘤,如乳腺癌、卵巢癌;或家族中有男性乳腺癌;或有德系犹太人血统等。
与卵巢癌相关的遗传性肿瘤综合征主要有:遗传性乳腺癌/卵巢癌综合征(hereditary breast and ovarian cancer syndrome,HBOC)、林奇综合征(Lynch Syndrome,LS)、黑斑息肉综合征(Peutz-Jeghers Syndrome,PJS)等。这些综合征的共同特点为:常染色体显性遗传,平均发病年龄较散发性患者早,对侧卵巢发病风险高,患多种原发肿瘤的风险增加,可表现为一人罹患多种原发肿瘤,和(或)家族中多人罹患同种或多种原发肿瘤。
1.1 筛查 由于目前没有有效的筛查手段,也不支持对一般人群进行常规的卵巢癌筛查。但应重视一些卵巢癌相关的临床症状,如腹胀、盆腔或腹部疼痛、腹围增加、易饱感,或尿频尿急,特别是这些症状新发,或经常出现,应及时进一步检查。对于高风险人群(如BRCA突变携带者,有家族史)用阴道超声联合血清CA125检测进行监测的价值仍有待验证。应加强女性对可能与卵巢癌相关症状的教育,如盆腹腔疼痛、腹胀、尿频尿急等,如持续数周应及时进一步评估。
1.2 基因检测 符合以下情况一项或多项的个体,建议进行相关的基因检测:(1)家族中存在已知的BRCA1/2突变的。(2)卵巢癌个人史,或患其他HBOC相关肿瘤,且确诊年龄≤50岁。(3)患HBOC相关肿瘤,且确诊年龄≤60岁,并且有第2个原发肿瘤,或三阴性乳腺癌,或≥1个近亲属患HBOC相关肿瘤。(4)近亲属中≥2人患HBOC相关肿瘤。(5)男性乳腺癌患者,或有男性近亲属患乳腺癌;肿瘤组织检测到BRCA1/2突变,但未行胚系分析。(6)林奇综合征、黑斑息肉综合征的筛查参见美国国家综合癌症网络(NCCN)临床实践指南:遗传/家族高风险评估-结直肠癌。
对家族中存在已知基因突变个体,建议首先针对该特定基因突变进行检测。对于家族中没有已知基因突变个体,应首先对肿瘤患者进行检测,无法对患者进行检测时,才考虑直接对非患者进行检测。当患者个人史或家族史指向某个特定综合征时,针对该综合征的基因检测更合适。如果针对性的基因检测未发现有害突变,但患者个人或家族史证据很强时,可考虑多基因检测。进行多基因检测前后提供专业遗传学咨询非常重要。
1.3 基因突变携带者的风险管理 (1)对BRCA1/2突变携带者,建议在35~40岁或完成生育后进行预防性输卵管和卵巢切除。BRCA2相关卵巢癌的确诊年龄通常较BRCA1相关卵巢癌晚8~10年,故BRCA2突变携带者可考虑延迟至40~45岁进行预防性附件切除。在考虑预防性手术时,应与基因突变携带者详细讨论手术的风险与获益。仅行输卵管切除不是降低患癌风险的标准手术,输卵管切除的女性仍有患卵巢癌和腹膜癌的风险。在绝经前进行预防性卵巢切除可能降低乳腺癌风险,但降低的程度不确定。(2)对林奇综合征、黑斑息肉综合征相关基因突变携带者,进行双侧输卵管卵巢的切除和子宫的切除应基于个体情况,如是否生育、绝经情况、合并症、家族史等因素。(3)口服避孕药物可以降低发生卵巢癌的风险,风险降低的程度与服用药物的时间呈正相关。口服避孕药物是否会增加乳腺癌的患病风险一直存在争议,故口服避孕药物预防卵巢癌特别适用于已行预防性乳腺切除术的BRCA突变携带者。
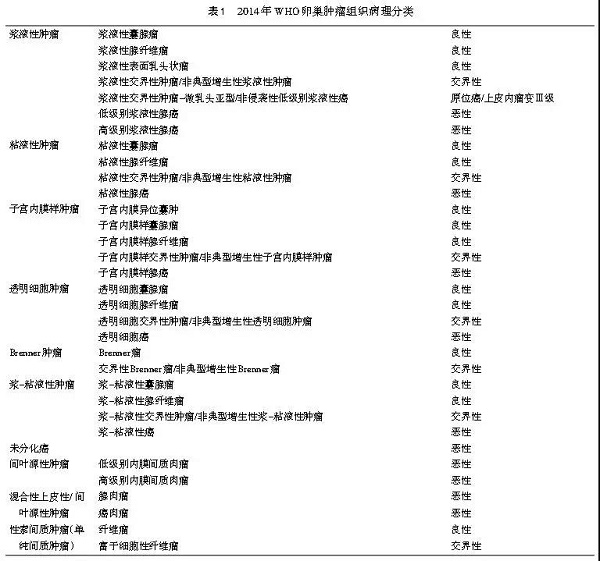
2、组织病理分类
上皮性肿瘤最为常见,约占90%以上。性索间质肿瘤占5%~6%,生殖细胞肿瘤占2%~3%。在上皮性卵巢癌中,高级别浆液性癌(high grade serous carcinoma,HGSC)占70%,子宫内膜样癌占10%,透明细胞癌占10%,粘液性癌占3%,低级别浆液性癌(low grade serous carcinoma,LGSC)< 5%。交界性肿瘤不再沿用低度恶性潜能肿瘤的名称,其浸润性种植从组织形态学和生物学行为上更相似于LGSC。见表1。


3、分期
采用国际妇产科联盟(FIGO)的手术病理分期,2013年进行了最新修订。其分期标准见表2。

4、诊断原则和依据
(1)详细的病史采集(强调家族遗传史询问)。(2)全面的体格检查(包括妇科检查)。(3)影像学检查:计算机断层扫描(CT)/磁共振成像(MRI)/超声(US),必要时正电子发射计算机断层显像(PET/CT)检查。(4)胸部X线或CT检查,若有胸腔积液需穿刺抽水做细胞学检查。(5)肿瘤标志物检测:包括癌抗原125(CA125)、人附睾蛋白4(HE4)、CA153、CA199、甲胎蛋白(AFP)、β-人绒毛膜促性腺激素(β-hCG)、雌二醇(E2)、孕酮(P)、鳞状上皮细胞癌抗原(SCC)、神经元特异性烯醇化酶(NSE)、癌胚抗原(CEA)等;基于CA125和HE4检测的卵巢癌风险预测值(risk of ovarian malignancy algorithm,ROMA)对鉴别盆腔肿物的良恶性有帮助。(6)注意排除胃肠道原发肿瘤,当盆腔肿物为实性时,胃肠道检查(胃镜、肠镜)尤为必要。(7)注意乳腺检查,特别是有肿瘤家族史时,应考虑行乳腺超声和(或)钼靶检查。(8)根据情况可选择的检查:胃肠钡餐、钡灌肠、静脉肾盂造影、盆腹X线等检查。酌情进行腹腔镜、膀胱镜等检查。(9)对接受保留生育功能手术的患者,如果卵巢肿瘤的病理类型为子宫内膜样癌,需行诊断性刮宫或宫腔镜检查。(10)确诊需病理组织学检查。对不能直接行减瘤手术患者,应进行肿物穿刺活检或腹腔镜探查取活检(囊性肿瘤不宜穿刺)。不建议以腹水细胞学检查结果作为确诊依据。
5、初始治疗
治疗原则:以手术为主,辅助化疗,强调综合治疗。
5.1 手术治疗
5.1.1 全面分期手术 (1)指征:适用于临床早期的卵巢恶性肿瘤患者。腹腔镜手术仅适用于肿瘤体积小,可以完整装入取物袋中经穿刺孔取出的病例。建议由有经验的妇科肿瘤医师施行腹腔镜手术。(2)分期手术原则及内容。见表3。

5.1.2 再次全面分期手术 (1)指征:因各种原因在首次手术时未能行全面分期手术,术后尚未进行抗肿瘤化疗的,应考虑再次手术,完成全面探查和分期的手术。尤其是对早期低危(即可能为ⅠA期G1或ⅠB期G1)术后无需化疗的患者。如果可能是早期高危患者(如ⅠA期G2/ G3或ⅠB期G2/ G3,ⅠC,Ⅱ期或透明细胞癌),可先行CT或MRI等影像学检查。有残留灶也应再次手术分期;如影像学检查无残留灶,且患者对再次手术有顾虑时,可给予铂类联合化疗6个疗程。手术分期不完全包括如下情形:①子宫未切除。②附件未切除。③大网膜未切除。④分期记录不完整。⑤有残留灶并可能再切除。⑥淋巴结未切除。⑦预防性切除手术时发现附件隐匿性浸润癌等。(2)手术原则及内容:①如果首次手术时已完整切除肿瘤,无明显肿瘤残留,可考虑经腹腔镜行再次分期手术。②手术方式和内容与全面分期手术相同。
5.1.3 保留生育功能的全面分期手术 (1)指征:① 对卵巢恶性生殖细胞肿瘤患者,不论临床期别早晚,均可考虑实施保守性手术,包括仔细全面的探查、所有可疑部位的活检、局部的细胞减灭术等。只要患者有生育要求,并且子宫和一侧卵巢外观无肿瘤,可行保留生育功能的全面分期手术。② 对上皮性卵巢癌患者,则要求严格满足下列条件才能保留生育功能:患者年轻,渴望生育,无不孕不育因素分化好的ⅠA期或ⅠC期、非透明细胞癌;子宫和对侧卵巢外观正常;有随诊条件。完成生育后视情况可能需再次手术切除子宫及对侧附件。(2)手术原则及内容:保留子宫和正常一侧的附件。若对侧卵巢外观正常,不必常规做活检,以免引起继发性不孕;盆腔和腹主动脉旁淋巴结切除;其余同全面分期手术。
5.1.4 肿瘤细胞减灭术 (1)指征:①初始肿瘤细胞减灭术(primary debulking surgery,PDS),适用于临床拟诊为中晚期(部分Ⅱ期、Ⅲ期和Ⅳ期)的卵巢恶性肿瘤患者。②中间性肿瘤细胞减灭术(interval debulking surgery,IDS),适用于新辅助化疗(neoadjuvant chemotherapy,NACT)后肿瘤缩小,达到部分缓解(PR)或稳定(SD),经评估有可能满意减灭的晚期病例;或首次减灭手术时残留肿瘤较多较大,经2~3个疗程化疗后再次手术的病例。③最大程度的PDS应在患者可以耐受手术或无严重内科合并症的前提下进行。(2)手术原则及内容:见表4。(3)手术满意度评价(必须在手术记录中说明):①满意肿瘤细胞减灭术:单个残留肿瘤病灶最大径≤1 cm记录为R1,完全切净肿瘤记录为R0。②不满意肿瘤细胞减灭术:单个残留肿瘤病灶最大径 >1 cm。(4)强调晚期卵巢癌手术应由妇科肿瘤医师评估并实施。研究数据显示,由妇科肿瘤医师实施的卵巢癌手术,其疗效优于普通妇科医师和外科医师。

5.2 辅助化疗
5.2.1 新辅助化疗(neoadjuvant chemotherapy,NACT) (1)共识:对卵巢癌进行NACT一直存有争议。目前的共识是,晚期卵巢癌NACT后再施行IDS,其疗效不劣于PDS治疗模式。必须由妇科肿瘤医师进行评估,决定是否先行NACT。对于一些虽然机体状态适合于PDS,但如果妇科肿瘤医师认定达到满意减瘤可能性不大的患者,更推荐NACT,而不是PDS。先接受NACT患者的围手术期和术后并发症,以及病死率更低,住院时间更短。(2)指征、方案和疗程:①适用于Ⅲ/Ⅳ 期患者,特别是大量胸腹水者,不适用于早期病例。②经体检和影像学检查评估,或手术探查(包括腹腔镜探查)评估,难以达到满意减瘤。③围手术期高危患者,如高龄、有内科合并症或无法耐受PDS者。④对特殊病例,临床高度怀疑卵巢癌,但无法取得组织病理活检者,则必须有腹水细胞学诊断,且血清CA125/CEA(比值)大于25。⑤在3~4个疗程NACT后,应考虑IDS。⑥NACT的方案与术后辅助化疗的一线方案相同,一般用静脉化疗。⑦NACT时需慎用贝伐单抗。
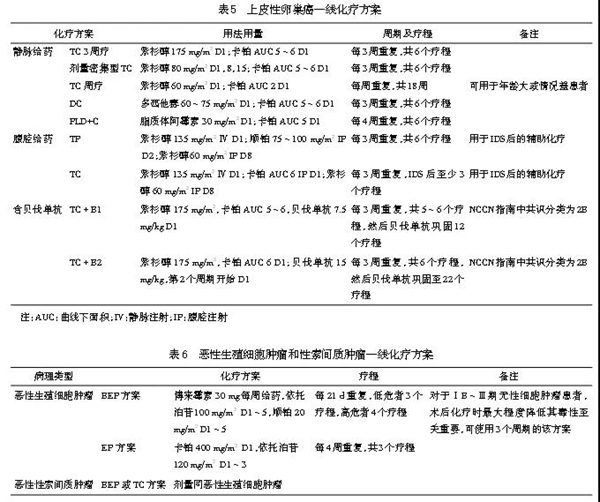
5.2.2 术后辅助化疗 (1)上皮性卵巢癌和卵巢性索间质恶性肿瘤化疗指征和疗程:①ⅠA和ⅠB期,G1分化,全面分期手术后,无需辅助化疗。②ⅠA和ⅠB期,G2分化,可观察或酌情给予化疗3~6个疗程。③其他Ⅰ期,全面分期手术后,化疗3~6个疗程。④Ⅱ~Ⅳ期:术后视手术满意度决定化疗疗程数及是否行再次细胞减灭术。接受满意细胞减灭术的患者共化疗6个疗程(包括新辅助化疗的疗程数),或在血清肿瘤标志物正常后应至少化疗2个疗程。⑤对达到满意减灭术的晚期患者,可给予腹腔灌注化疗。⑥Ⅰ期成年型颗粒细胞瘤可不接受化疗,但ⅠA期以上幼稚型颗粒细胞瘤需给予化疗。⑦紫杉醇联合卡铂仍是上皮性卵巢癌一线化疗的标准方案和首选方案。在此方案中,加入第3种化疗药或其他三药联合的化疗方案,不仅不能提高疗效,而且还会增加毒性。⑧其他可以替代的一线化疗的方案见表5。多西他赛联合卡铂和脂质体多柔比星(PLD)联合卡铂,主要优点是神经毒性低,脱发较轻,可用于不能耐受紫杉醇毒性的患者。剂量密集型紫杉醇周疗联合卡铂3周给药可改善晚期卵巢癌患者的总生存和无进展生存,缺点是贫血和生活质量略有下降。对于高龄、体力状况评分差的患者,小剂量紫杉醇周疗和卡铂周疗也是一种选择。(2)恶性生殖细胞肿瘤化疗指征和疗程:①对ⅠA期无性细胞瘤和ⅠA期肿瘤细胞分化好的未成熟畸胎瘤,在全面分期手术后,可随访观察,不需化疗。②所有其他临床期别者在分期手术或满意的肿瘤细胞减灭术后,都应接受3~4个疗程化疗,或在血清学肿瘤标志物检测正常后再化疗2个疗程。③首选BEP/EP方案。(3)交界性肿瘤的化疗指征和疗程:①所有期别的交界性卵巢肿瘤患者,在进行满意的减灭术后,如果转移灶也是交界性肿瘤,术后可以不进行辅助化疗。②腹盆腔播散病灶的病理检查为浸润性种植时,术后应进行化疗。③短期内腹腔复发的患者,应考虑给予化疗。④方案和疗程参见上皮性卵巢癌。
5.2.3 一线化疗方案
5.2.3.1 上皮性卵巢癌一线化疗方案 见表5。
5.2.3.2 恶性生殖细胞肿瘤和性索间质肿瘤一线化疗方案 见表6。
5.2.3.3 少见卵巢恶性肿瘤的一线化疗方案 见表7。

5.3 初治卵巢癌的靶向药物治疗
5.3.1 贝伐单抗(bevacizumab) 研究表明,在卵巢癌一线化疗的同时加入抗血管生成的靶向药物贝伐单抗,并且在完成化疗后继续用贝伐单抗维持治疗,可以使晚期患者的无进展生存期(PFS)提高2~4个月,尤其是在不满意减瘤或者合并腹水的晚期卵巢癌。其主要毒副反应是出血、高血压和肠穿孔。
5.3.2 帕唑帕尼(pazopanib) 是一种血管内皮生长因子(VEGF)及血小板衍生生长因子受体抑制剂。前瞻性随机对照研究发现,帕唑帕尼用于一线治疗后未进展的晚期卵巢癌的维持治疗,与安慰剂组相比,使PFS提高了5.6个月,但总生存期(OS)无差异。此外,相同设计的亚洲临床研究结果却显示,帕唑帕尼没有改善亚洲晚期卵巢癌患者的PFS。
5.3.3 奥拉帕利(olaparib) 是一种DNA修复酶(PARP)抑制剂。SOLO1研究是奥拉帕利用于一线治疗后未进展晚期卵巢癌的维持治疗的研究,研究结果将陆续报道。
6、复发后的治疗
6.1 复发性卵巢癌的分型
6.1.1 铂类敏感型 指对初期以铂类药物为基础的治疗有明确反应,且已经达到临床缓解,停用化疗后12个月以上出现进展或复发。
6.1.2 铂类部分敏感型 指对初期以铂类药物为基础的治疗有明确反应,且已经达到临床缓解,停用化疗后在6~12个月内出现进展或复发。
6.1.3 铂类耐药型 指对初期的化疗有反应,但在完成化疗后6个月内进展或复发。
6.1.4 难治型 指对初始化疗无反应,如肿瘤稳定或肿瘤进展。包括在化疗后4周内进展者。
6.2 复发性卵巢癌的处理原则
6.2.1 局部复发病灶经评估能再次切除者 应考虑行再次细胞减灭术。术后按复发类型,并参考既往化疗史选择二线或三线化疗方案,可考虑选用备选药物,根据再次细胞减灭术的满意度决定化疗疗程数。
6.2.2 以下情况不适合行再次肿瘤细胞减灭术 (1)病灶无法满意切除者。(2)已用过多个方案化疗、多药耐药者。
6.2.3 不能再次手术切除病灶的患者 根据复发类型选择二线化疗方案。如果化疗后肿瘤缩小或局限,可考虑行再次细胞减灭术。
6.2.4 放射治疗 仅在局灶性复发、且对多种化疗方案耐药的病例考虑使用,多为姑息性治疗,应经过多学科会诊讨论决定。放疗方式(外照射、腔内后装放疗或放射性粒子植入)及剂量个体化制定。
6.2.5 鼓励复发患者参加临床试验。
6.3 二线化疗和靶向治疗
6.3.1 复发上皮性卵巢癌 对复发的上皮性卵巢癌,应首先进行分型。上述分型中的铂类耐药型、难治型均属于耐药型复发。对铂类敏感型复发,首选铂类为基础的联合化疗或铂类单药化疗方案。对铂耐药型复发,则首选非铂类单药化疗或加抗血管生成靶向药物的联合化疗。
PARP抑制剂明显改善复发卵巢癌患者的疗效,奥拉帕利维持治疗对有BRCA基因突变的复发患者PFS的提高尤其显著。鲁卡帕利(rucaparib)除了在BRCA基因突变的铂敏感复发患者中明显改善了PFS,在野生型BRCA基因杂合性缺失(loss of heterozygosity,LOH)比率高的患者中也有很好的疗效。尼拉帕尼(niraparib)则对BRCA基因突变和有同源重组缺陷(HRD)的复发患者均有较好的疗效。此外,化疗联合VEGF受体抑制剂(贝伐单抗、西地尼布等)有一定的疗效。见表8。
6.3.2 复发恶性生殖细胞和性索间质肿瘤 对复发的卵巢生殖细胞恶性肿瘤,如果仍有治愈可能,应该首先推荐在有条件做骨髓移植的单位进行大剂量化疗(high-dose chemotherapy)。放射治疗仅用于局部复发的姑息治疗。见表9~10。

6.4 单纯CA125升高的处理 对完成初始手术和辅助化疗后,达到临床完全缓解的患者,在常规的随访和监测中发现CA125水平上升,但没有肿瘤复发的症状、体征和影像学证据。处理可选择以下方法之一:使用他莫昔芬(Tamoxifen)或其他激素类药物;参加临床试验;观察随诊直至临床复发;立即按复发肿瘤进行化疗。
7、随访
7.1 随访间隔 (1)第1~2年,每2~3月1次。(2)第3~5年,每4~6个月1次。(3)5年后,每6~12个月1次。
7.2 随访内容 (1)每次询问症状、进行体检。(2)每2~3个月检测肿瘤标志物。(3)每3~6个月复查胸片、超声1次。(4)每年复查盆腔和腹腔CT、或MRI、或PET/CT 1次。
执笔者:周琦(重庆市肿瘤医院/重庆大学附属肿瘤医院)、吴小华(复旦大学肿瘤医院)、刘继红(中山大学附属肿瘤医院)、李力(广西医科大学附属肿瘤医院)、朱笕青(浙江省肿瘤医院)、白萍(中国医学科学院肿瘤医院)、盛修贵(山东省肿瘤医院)
指南编写专家(排名不分先后):蔡红兵(武汉大学中南医院)、高国兰(北京航空总医院)、高雨农(北京大学肿瘤医院)、郝敏(山西医科大学附属第二医院)、黄曼尼(中国医学科学院肿瘤医院)、柯桂好(复旦大学附属肿瘤医院)、孔为民(首都医科大学附属北京妇产医院)、李广太(北京煤炭总医院)、李隆玉(江西省妇幼保健院)、林仲秋(中山大学孙逸仙纪念医院)、娄阁(哈尔滨医科大学肿瘤医院)、曲芃芃(天津市中心妇产科医院)、王珂(天津市肿瘤医院)、王莉(河南省肿瘤医院)、王丹波(辽宁省肿瘤医院)、王建六(北京大学人民医院)、王淑珍(首都医科大学附属北京朝阳医院)、吴强(江苏省肿瘤医院)、吴令英(中国医学科学院肿瘤医院)、吴绪峰(湖北省妇幼保健院)、向阳(中国医学科学院北京协和医院)、谢幸(浙江大学医学院附属妇产科医院)、杨宏英(云南省肿瘤医院)、张国楠(四川省肿瘤医院)、张师前(山东大学齐鲁医院)
秘书:邹冬玲(重庆市肿瘤医院/重庆大学附属肿瘤医院)、刘芳容(重庆市肿瘤医院/重庆大学附属肿瘤医院)
(参考文献略)
 妇产科在线APP下载
妇产科在线APP下载













