患者31岁,孕3产1,因"停经32+1周,发现血压升高1周余"于2011年6月2日自外院转入广州医科大学附属第三医院妇产科。患者平素月经规律,孕4个月自觉胎动至今,孕27周于外院产前检查行口服葡萄糖耐量试验,结果显示空腹血糖5.97 mol/L,餐后1 h、2 h血糖正常,予饮食、运动后血糖控制尚可(具体不详)。5月25日(孕31周)于外院产前检查时发现血压升高,达168/120 mmHg(1 mmHg=0.133 kPa),尿蛋白(+),下肢轻度水肿。予口服盐酸拉贝洛尔100 mg,3次/d,血压控制欠佳,遂转入我院。患者既往无高血压、糖尿病病史。2006年顺产一健康女婴。曾人工流产1次,具体时间不详。入院检查:头晕头痛,有眼花,无呕吐,无呼吸困难,无抽搐等不适。血压160/110 mmHg,心率82次/min,双下肢水肿(+)。产科检查:腹隆,宫高24 cm,腹围97 cm,胎方位为枕左前,胎心143次/min,规则,胎头未入盆,跨耻征(-),未扪及宫缩。入院诊断:(1)重度子痫前期,(2)妊娠期糖尿病,(3)孕3产1孕32+1周单活胎。入院后完善相关检查:血压波动在150~178/100~112 mmHg。实验室检查:24 h尿蛋白为2.52 g,24 h尿3-甲氧基-4-羟基扁桃酸(vanillylmandelic acid, VMA)为34.3 mg(正常值:0~3.6 mg)。胎儿B超:双顶径为74 mm,股骨长为58 mm,脐动脉收缩期/舒张期速度比(S/D)为2.40,大脑中动脉(S/D)为5.70。子宫内妊娠,如孕30+周,单活胎。超声检查提示右肾上腺区高回声团,大小为58 mm×47 mm,周边可见环状、内部可见条状血流信号。磁共振成像(magnetic resonance imaging,MRI)检查提示右侧肾上腺肿块影58 mm×56 mm×54 mm(图1)。醛固酮立卧位试验阳性。心脏彩色多普勒超声示:左室增大,轻度主动脉瓣关闭不全,二尖瓣前叶脱垂并部分腱索断裂,轻中度关闭不全,左室收缩舒张功能明显减退,考虑嗜铬细胞瘤性心肌病变。
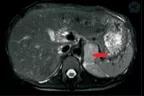
图1 妊娠合并嗜铬细胞瘤MRI影像(箭头所示为嗜铬细胞瘤)
入院后按子痫前期处理,给予安定镇静,硫酸镁解痉,硝苯地平、酚妥拉明和硝酸甘油降压等治疗。治疗效果欠佳,血压波动范围150~178/100~112 mmHg。请内分泌科、泌尿外科会诊,建议适时终止妊娠,于2011年6月21日孕34+6周因"胎儿窘迫"行子宫下段剖宫产术,顺利娩出一活男婴,外观未见畸形,羊水清,1 min、5 min、10 min Apgar评分分别为9分、9分和10分,新生儿体重2 250 g,拟早产儿转新生儿科进行吸氧、营养心肌、抗感染等对症支持治疗。患者产后血压波动在130~209/90~159 mmHg,24 h尿蛋白为0.17 g,尿蛋白(+)。术后第6天,患者无诉发热、咳嗽、胀奶等不适,子宫收缩好,质硬,切口愈合良好,阴道恶露少,无异味,术后恢复好。于2011年7月8日母儿平安出院。出院诊断:(1)重度子痫前期;(2)肾上腺肿瘤(嗜铬细胞瘤);(3)妊娠期糖尿病;(4)子宫肌瘤;(5)脐带绕颈;(6)早产;(7)孕3产2,孕34+6周剖宫产。
患者产后4个月就诊我院泌尿外科,予口服长效α受体阻断-酚苄明10 mg,每天1次及扩容1周后行右侧肾上腺嗜铬细胞瘤切除术,手术过程顺利。组织病理结果提示嗜铬细胞瘤(图2)。术后复查血压、醛固酮、VMA等恢复正常。
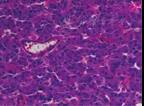
图2 嗜铬细胞瘤镜下病理图(×200) 嗜铬细胞瘤表现为瘤细胞较大,多数为多角形,少数为梭形或柱状;瘤细胞核深染,成圆形或卵圆形,胞浆丰富
讨论
妊娠合并嗜铬细胞瘤罕见,发生率为0.007%[1]。妊娠期间嗜铬细胞瘤的临床表现缺乏特异性,因此,早期诊断并不容易,也容易被误诊为妊娠剧吐、甲亢危象、妊娠期糖尿病、先兆流产或子痫前期等疾病[2]。Oliva等[3]报道,如果孕妇合并嗜铬细胞瘤不能在分娩前明确诊断,母儿死亡率高达58%。
1.嗜铬细胞瘤的诊断及鉴别诊断:
嗜铬细胞瘤主要起源于肾上腺髓质及交感神经节和其他部位的嗜铬组织,多位于肾上腺髓质、10%为双侧性,肾上腺外如腹主动脉旁、肾门或其他部位占28.3%[4]。嗜铬细胞瘤可持续性或间断释放大量内源性儿茶酚胺(去甲肾上腺素、肾上腺素和多巴胺)导致交感神经活动和功能增强,造成持续性或者阵发性的高血压、多种器官功能及代谢紊乱等一系列症状[5]。
嗜铬细胞瘤的诊断主要依靠病史、体征及辅助检查。妊娠合并嗜铬细胞瘤的临床表现有阵发性高血压或体位改变性高血压、脸红、头痛、心悸、心肌病和最具有鉴别诊断意义的高血糖[6],其中发作性头痛、心悸、大汗是嗜铬细胞瘤的典型三联征。本例患者为妊娠期发现的高血压、糖尿病,且既往无高血压、糖尿病病史。入院后按子痫前期处理,但效果欠佳,血压一直控制不良。完善肾脏B超及MRI提示:右侧肾上腺肿块影,考虑嗜铬细胞瘤。实验室检查:24 h尿VMA 34.3 mg,血管紧张素Ⅰ(37 ℃)3.91 U/L,血管紧张素Ⅰ(4 ℃)2.14 U/L,肾素活性3.54 ng/(ml·h),醛固酮336.56 pg/ml。结合血压波动大,且压迫右侧肾上腺后血压明显升高的体征。最终考虑为嗜铬细胞瘤。本例的突出问题是妊娠期首次发现血压升高,表现有尿蛋白,主要症状为头晕、头痛,容易误诊为妊娠期高血压疾病,可从以下几个方面相互鉴别(表1)。
表1 妊娠合并嗜铬细胞瘤与妊娠期高血压疾病的鉴别诊断要点(修改自[3])

嗜铬细胞瘤的主要实验室检查为儿茶酚胺及其代谢产物,包括VMA、甲氧基肾上腺素(MN)、甲氧基去甲肾上腺素(NMN),其中VMA常作为筛选指标,如果正常,可排除诊断,如果异常,应进一步行腹部B超或MRI等影像学检查。MRI检查虽昂贵、耗时,但可提供更好的腹部和盆腔肿块的可视化图像。多发性内分泌腺瘤、von Hippel-Lindau病等遗传疾病占嗜铬细胞瘤病因的20%~30%,必要时应鉴别诊断[7]。
2.嗜铬细胞瘤的治疗:
手术切除是嗜铬细胞瘤最有效的治疗手段。充分的术前准备,合适的麻醉方式,在恰当的时机终止妊娠或者手术切除肿瘤是保证母婴安全的关键。α-肾上腺能受体阻滞剂的应用可使孕妇死亡率从40%降至1%,胎儿死亡率从50%降至30%[8]。充分的术前准备包括:术前5~7 d充分扩容、10~14 d使用α-肾上腺素受体阻滞剂。手术切除后,肾上腺嗜铬细胞瘤的复发率大约为14%,而其他部位的嗜铬细胞瘤复发率可高达30%[9]。术后的随访,单侧病灶切除者每年1次,随访至少10年,高危人群和遗传性嗜铬细胞瘤者每0.5~1年复查1次,终身随访[10]。本例患者产后反复出现头晕、头痛,血压最高达209/159 mmHg,经内分泌科降压治疗1周后带药出院。于产后5个月在泌尿外科行右侧肾上腺嗜铬细胞瘤切除术,术后复查皮质醇、尿VMA测定、醛固酮均已恢复正常。
3.嗜铬细胞瘤对母婴的影响:
嗜铬细胞瘤主要影响孕妇的心血管系统和代谢功能。儿茶酚胺内源性升高,作用于外周血管,全身小血管收缩,引起脑血管缺血、视网膜病变、心律失常、心肌肥厚等。胎盘灌注不足,容易造成早产、胎盘早剥、胎儿宫内生长受限、胎儿窘迫严重时胎死宫内。大量儿茶酚胺促进糖原、脂肪、蛋白质分解,肠道吸收葡萄糖增多,胰岛素分泌减少或胰岛素抵抗增强等均导致血糖升高[11]。
嗜铬细胞瘤危象可在药物、麻醉、分娩、手术、体位改变等情况下诱发[12],包括高血压危象、休克危象、严重心律失常等。表现为血压骤然上升或下降,剧烈头痛、大汗淋漓、面色苍白、抽搐、意识障碍等。突发低血压应考虑嗜铬细胞瘤坏死破裂的可能。阴道分娩较之剖宫产死亡率更高(31%与19%),故终止妊娠方式尽可能选择剖宫产术[13]。
对于早、中孕期病例,如患者要求终止妊娠,可在药物治疗控制血压后进行引产。中、晚孕期病例,予药物控制血压,如血压控制良好,可至足月后终止妊娠;如血压控制不佳,则于孕34周后或完成促胎肺成熟和胎儿脑保护等治疗后终止妊娠,出现危及生命的严重并发症则随时终止妊娠。终止妊娠方式以剖宫产为宜。
孕期嗜铬细胞瘤切除的时机可选择在孕23周前,或剖宫产的同时,也可选择在剖宫产术后待血压、血糖控制平稳后二期手术。产后由于子宫复旧,手术操作空间增大,手术难度降低。本例患者剖宫产术后于门诊随访,4个月后行二期手术取得较好的疗效。术后7~10 d,尿VMA、MN、NMN等可恢复正常,术后4~6周可更准确的评估治疗效果。
妊娠合并嗜铬细胞瘤临床表现多样,易与子痫前期混淆。如果产前未能明确诊断,会增加母儿的发病率和死亡率。早期诊断可显著降低母儿发病率及死亡率。妊娠合并嗜铬细胞瘤目前没有临床处理指南,需要依据妊娠所处的阶段及嗜铬细胞瘤的功能状态选择个体化治疗方案,应联合包括产科、内分泌科、泌尿外科、麻醉科和新生儿科在内的多学科共同诊治,改善妊娠结局。
参 考 文 献(略)
贺芳, 唐小林. 妊娠合并嗜铬细胞瘤一例[J/CD]. 中华产科急救电子杂志, 2016, 5(4): 254-256.
 妇产科在线APP下载
妇产科在线APP下载













