
妇科肿瘤学硕士、临床解剖学博士,南方医科大学南方医院妇产科教研室主任、妇科主任,主任医师、教授、博士生导师。国家重点临床专科(妇科)带头人,国家四级妇科内镜手术培训基地主任,国家卫生和计划生育委员会妇科内镜诊疗技术临床应用规范化管理专家组成员。中国医师协会微无创医学专业委员会副主任委员,全国妇产科介入治疗学组副组长,广东省医学会数字医学分会主任委员。《中国实用妇科与产科杂志》 副主编。承担并主持十二五国家科技支撑计划、国家自然科学基金、广东省自然科学基金重点项目等科研课题20余项。在国内外重要期刊发表论文200余篇,SCI文章20余篇。主编、副主编妇产科专著4部,参编10余部,出版各种手术DVD教学片6部。获国家专利18项。研究方向:宫颈癌微创治疗、妇产科数字医学、妇产科介入治疗。
启动于2015年3月8日的 “中国宫颈癌临床诊疗大数据”,又称1538项目,是在郎景和院士的领导下,由南方医科大学南方医院具体负责的项目。目前共有全国9个省市24家医院参加,其中综合性三甲医院18所、妇幼专科三甲医院3所、肿瘤专科三甲医院3所,统计2005—2014年10年宫颈癌患者住院期间的临床数据,目前已收集22890例,其中手术病例16847例,获得了一批真实的临床数据。本文根据该大数据中的宫颈癌手术状况的调查情况,对中国宫颈癌手术的未来方向进行思考。
1.1中国宫颈癌10年手术术式的变化
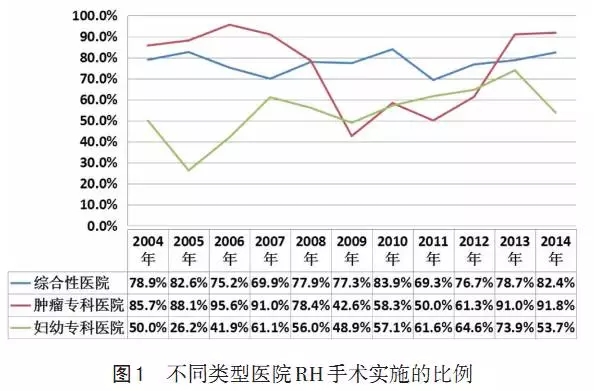
在中国宫颈癌10年临床诊疗大数据资料中,宫颈癌患者子宫切除的范围是以广泛性子宫切除术(RH)为主,无论是肿瘤专科医院还是综合医院,亦或妇幼专科医院,而且呈逐年递增的趋势 (图1)。由数据中可以看到我国广大妇科医生在心理上已经接受了宫颈癌患者应该实施广泛性子宫切除术的理念,但在我们的进一步调查中发现,大部分病例实施的不是标准的RH手术,而是改良型广泛性子宫切除术(mRH)、甚至有些病例是扩大的子宫切除术。再进一步的调查我们发现出现这种状况的原因有如下几点:(1)RH手术的解剖学切除标准不清,或解剖学标志不清。(2)我国在20世纪80年代是以mRH为主流手术,目前活跃在手术台上的医生均是在那个时候受训的,并进一步传授给他们的学生。(3)部分会做RH手术的医生,由于受RH术后严重膀胱障碍的影响而有意或无意中缩小了手术范围。因此,出现了手术记录上是RH而实际是mRH这一有中国特色的现象。
1.2RH与mRH手术范围的解剖学区别
在这里我们主要谈谈RH与mRH的解剖学上的区别。RH手术,传统上是指广泛性子宫切除术,在Piver分型中为Ⅲ型子宫切除术,在Q-M分型中为C型;mRH手术,传统上使指改良型广泛性子宫切除术,在Piver分型中为Ⅱ型子宫切除术,在Q-M分型中为B型。为了描述上的统一以及尊重大家由来已久的习惯,本文还是以RH和mRH相称。
实际上关于RH和mRH的手术切除范围一直是模糊的或者是混乱的,即使2008年提出的所谓以解剖学语言解释的Q-M分型,在解剖学上的描述也不是非常到位或准确的。我们从头讲起,实际上中国在19世纪五六十年代老一辈妇科肿瘤专家实施的是标准的RH手术,不知道从何时起,有人将切除主骶韧带2cm定义为mRH,将切除主骶韧带3cm定义为RH;又有人将游离输尿管后在输尿管的下方切除主韧带就是mRH,沿盆壁切除主韧带就是RH;1974年的Piver分型中Ⅲ型定义为切除全部的主骶韧带,2008年的Q-M分型中C型定义为髂血管旁横断宫颈旁组织(切除至输尿管外侧、直肠旁) 。
上述观点有的不正确、有的不完全正确。这里我们以切除主韧带的范围为例,首先明确的是RH手术中关于主韧带切除的定义是切除全部的主韧带.再看一下主韧带的起止部定义:主韧带的起始部有2型:宫颈型和宫颈阴道型;主韧带的止点也有2型:分为髂内动脉型和髂内静脉型,髂内动脉型是指主韧带止于坐骨大孔上缘水平髂内动脉发出第一支分支血管附近,而髂内静脉型是指子宫深静脉汇入髂内静脉的汇合处;那么主韧带的长度如果从止点上算就有2种计算方法。因此,切除全部主韧带的定义是模糊的;同时上文所述沿盆壁切除主韧带的概念在解剖学上是错误的,因为第一主韧带不附着于盆壁;第二在临床上如果沿盆壁切除,切除的就不仅仅是主韧带,最少还包括髂内动静脉及其分支,那就不是RH手术了。至于Piver分型Ⅲ型中切除全部的主韧带就更为笼统,而Q-M分型中的C型关于主韧带切除在髂血管旁横断宫颈旁组织(切除至输尿管外侧),也是没有达到解剖学上的精确描述的境界。
我们再看看主韧带的长度,国内外文献报道主韧带的长度不一,如2011年,刘世凯对8具女性尸体的子宫主韧带的测量结果显示,右侧主韧带长4.6~6.6 cm,平均5.4 cm;左侧主韧带长4.3~6.4 cm,平均5.5 cm。2013年,吴小华等对10具女性尸体的子宫主韧带测量结果显示,左侧主韧带的平均长度为(5.31±0.74)cm,右侧为(5.48±0.68)cm。2014年,Samaan等通过对38例尸体标本的子宫主韧带进行精细解剖后发现,子宫主韧带的平均长度为10.01 cm。2013年,Chen等 对基于静态MRI原始数据集构建的20例正常女性子宫主韧带的三维模型的测量结果显示,左侧主韧带长度为(55±12)mm,右侧为(58±10)mm。2014年,Luo等对10例正常女性子宫主韧带三维模型的测量结果显示,主韧带长度为(59±9)mm,在最大受力状态下,主韧带长度增加(15±9) mm。而黄璐等报道的在体主韧带长度范围为:右侧2.65~6.74 cm、左侧3.49~6.84 cm,平均右侧(5.51±0.82)mm,左侧(5.46±0.85)cm;输尿管与主韧带交界处到宫颈附着点主韧带的长度范围为:右侧1.41~6.74 cm、左侧1.01~6.84 cm,平均右侧(2.62±0.59)cm、左侧 (2.21±0.51)cm。因此,在输尿管下方切除主韧带是<1/2长度的。故无论是切除主韧带2cm的概念、还是Piver分型中的Ⅱ型、Q-M分型中的B型都在描述切除范围上存在不足之处。
1.3如何达到传统RH/mRH的手术切除范围
那么传统的RH手术、mRH手术的切除范围在解剖学上的手术步骤如何?这里还是以切除主韧带为例:第一步,打开膀胱宫颈间隙和膀胱阴道间隙,并向两侧充分游离;第二步,在子宫动脉起始部切断子宫动脉;第三步, 打开膀胱宫颈、 膀胱阴道间隙,打开膀胱侧间隙和直肠侧间隙(要分别打开直肠和输尿管之间的欧氏间隙、 输尿管和髂内血管之间的冈林氏间隙,注意直肠侧间隙是由两个间隙组成, 中间以输尿管及其输尿管系膜为界);第四步,打开输尿管隧道,切除其上方的膀胱宫颈阴道韧带前叶 (浅层),将输尿管从膀胱宫颈阴道韧带后叶上完全游离并切除后叶 (深层);第五步,在膀胱侧间隙和冈林氏间隙之间紧贴髂内血管(髂内动静脉)切除主韧带。这样才能达到RH主韧带切除的标准。
传统的mRH手术相对比较简单:第一步,打开膀胱宫颈间隙和膀胱阴道间隙,并向两侧充分游离;第二步,打开直肠侧间隙的欧氏间隙,注意不需要打开膀胱侧间隙和直肠侧间隙的冈林氏间隙;第三步,打开输尿管隧道切除其上方的膀胱宫颈阴道韧带前叶,将输尿管自膀胱宫颈阴道韧带后叶上向外游离(注意不是完全游离);第四步,在输尿管的外侧方、主韧带1/2处切除主韧带,同时切除部分膀胱宫颈阴道韧带后叶(注意不是全部)。RH/mRH术中骶子宫韧带的切除就不再赘述。
2.1中国宫颈癌患者盆腔淋巴结转移状况
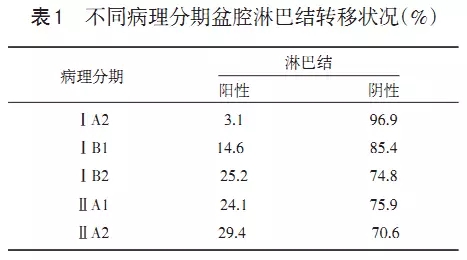
调查盆腔淋巴结切除术是宫颈癌手术治疗的标准术式之一,当然有时还需要行腹主动脉旁淋巴结切除术。表1是我们在中国宫颈癌临床诊疗大数据中获得宫颈癌ⅠA2~ⅡA2期10 130 例直接手术病例中术后盆腔淋巴结病理学的数据。从数据中我们清楚地看到ⅠA2~ⅡA2期的盆腔淋巴结转移阳性率为 3.1%~29.4%,阴性者占 96.0%~70.6%。但是,根据NCCN的标准,这些病例均要行盆腔淋巴结切除术,这一点中国医生执行的非常好。无数的证据显示盆腔淋巴结的状况与预后密切相关,同一期别的患者盆腔淋巴结阳性者预后差,而阴性者预后好,那就意味着70%以上的患者经历了不必要的盆腔淋巴结切除术。这里不谈盆腔淋巴结切除术时,术中的严重并发症,也不谈术后淋巴水肿对患者带来的不便和痛苦。我们能不能在术前就能够预测盆腔淋巴结的状况(指有无转移),从而筛查出有淋巴结转移的阳性病例予以手术切除,而对淋巴结没有转移的阴性患者免于手术,从而达到一系列有益的效果。
2.2盆腔淋巴结数字化三维评估系统多层螺旋CT和MRI作为无创性影像学检查方法,常被临床医生应用于对宫颈癌盆腔淋巴结转移的诊断。国内外文献报道,以淋巴结最短径≥10 mm作为淋巴结转移的诊断标准,可使 CT 的诊断敏感度达64.7%,特异度96.6%,准确率89.5%。2002年Grubnic等利用MRI评估正常的腹膜后和盆腔淋巴结,并与CT和淋巴造影技术相对比,MRI能识别出更多淋巴结。MRI的诊断敏感度达70.6%,特异度89.8%,准确率85.5%。按照此标准诊断各盆腔区域的淋巴结转移率分别为闭孔区91%,髂外区域27%,髂内区域14%,髂总区域19%,骶前区域5%。PET-CT是功能影像学的一种,在对盆腔淋巴结转移的诊断方面,敏感度达57.6%,特异度达92.6%,准确为85.1%,但其价格昂贵,耗费时间,而且分辨率低,目前暂不作为早期肿瘤常规检查的推荐项目。由于大部分的转移淋巴结并不表现为淋巴结肿大,但目前影像学通过比较淋巴结最短径线>1 cm的淋巴结与术后病理阳性的相关性,得出结论认为以淋巴结的最短径线≥1 cm为参考标准的准确性较高,但是按照此标准,其并未对<1 cm的淋巴结进行评估,研究结果不能全面反映影像学对盆腔淋巴结转移评估的实用性。而研究发现,部分淋巴结即使存在转移,肿大也不是特别明显,虽然可能大于正常大小的淋巴结,但径线增大也常常不超过1 cm。因此,传统的诊断标准尚不能完全满足指导临床。针对此种情况,如何进一步分辨正常大小或稍大的淋巴结是否存在肿瘤转移是目前迫切需要解决的难题。根据本团队研究数据, 我们以淋巴结的最短径线≥0.5 cm,最长径线与最短径线比值范围在1.0<R≤1.7来判断淋巴结存在转移,经验证发现其敏感度为52.38%,特异度为95.22%,准确率为 89.37%,漏诊率为47.62%,误诊率为4.78%,阳性预测值为63.46%,阴性预测值为92.67%。换而言之,用该标准判断阴性淋巴结的准确率非常高,有助于临床诊断的判断。
2.3 前哨淋巴结(sentinel lymph node,SLN)的应用和意义
SLN是指引流原发肿瘤的第一站淋巴结,是肿瘤转移最先累及的淋巴结。理论上,如果SLN阳性,则预示该淋巴区域已发生肿瘤转移,需行淋巴结切除术;若SLN阴性,则可视为该淋巴区域无肿瘤转移,可避免行淋巴结切除术。SLN的概念最早是1977年由美国学者Cabanas等在阴茎癌的治疗中所提出,1992年对黑色素瘤的研究为前哨淋巴结带来了里程碑式的发展,SLN开始作为局部淋巴结分期得到广泛应用。目前SLN的概念应用于一些类型的肿瘤中,如乳腺癌,恶性黑色素瘤.在外阴癌、宫颈癌中SLN已有一定范围的应用,目前已有部分学者将宫颈癌的前哨淋巴结应用于临床以指导术中是否需行盆腔淋巴结清扫,在术中对前哨淋巴结进行识别,在腹腔镜或开腹直视下对SLN进行切除快速病理检查,HE染色或结合免疫组化对淋巴结转移状态进行判断。
SLN的识别方法主要有3种:生物活性染料示踪法、放射性元素示踪法及生物活性染料-放射性核素联合示踪法。3种方法SLN的检出率不同,生物活性染料-放射性核素联合示踪法大大提高了SLN的检出率,文献报道的前哨淋巴结检出率在70%~93%之间,但该方法的双侧检出率仍不满意,且手术操作过程复杂,手术费用较高。因此,近年来腹腔镜下前哨淋巴结荧光靛青绿示踪法逐渐得到应用,该方法由Furukawa等在2010年最先报道于对宫颈癌患者的治疗中,目前已经有数个研究团队在前哨淋巴结的整体检出率及双侧检出率方面证实了该方法的有效性.与以往生物活性染料-放射性核素联合示踪法相比,荧光腹腔镜具有如下优点:(1)使得前哨淋巴结活检术可在手术操作过程中一次性完成.(2)由于荧光靛青绿可对整个淋巴结引流区域进行染色,因此可达到手术过程中对淋巴结引流通道的实时可视化,即使对于形态不典型的淋巴管,手术医生也较易辨认。(3)荧光靛青绿的使用安全性更高。(4)荧光靛青绿在达到其高效性的同时,可避免使患者暴露于射线之中。(5)对于肥胖,腹膜后脂肪丰富的病人,该方法尤为重要。然而,该方法仍然存在一些问题,如目前缺少一些前瞻性的研究保证该方法下实施手术的切实有效性,且选用的荧光染料种类主要取决于腹腔镜设备,具有一定的选择偏倚。
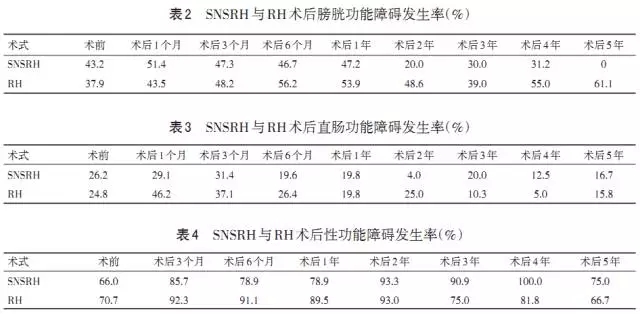
RH术后存在明显的脏器功能障碍并发症,笔者团队对RH及SNSRH术后2年盆腔脏器功能障碍的动态研究结果显示(表2~4),就膀胱功能而言, NSRH能明显改善患者术后的膀胱功能。但对于SNSRH手术,需要注意几个问题:(1)盆腔自主神经片状分布,保留神经手术并不是保留所有的神经,而是保留神经主干或部分神经,对盆腔自主神经仍然存在损伤,研究表明,神经损伤在1年左右可逐渐进行功能重塑。(2)保留盆腔自主神经并不是改善术后脏器功能障碍的惟一方法, mRH术后脏器功能障碍远远少于SNSRH及RH,因此缩小手术切除范围也是一种方法。(3)SNSRH术后肿瘤学结果及病理学结果并未受到影响。笔者团队的研究资料显示:平均随访76个月发现,SNSRH术后总体生存率达86.84%,与RH术后90.28%无明显差异,分析原因发现SNSRH术后切除宫颈周围韧带组织中的血管、淋巴管组织与RH无差异。(4)SNSRH手术复杂,盆腔自主神经术中解剖困难,认为SNSRH难以推广;但是目前笔者团队利用数字化三维重建技术对盆腔自主神经进行了个体化三维重建,用于指导术中神经的保留,同时在研究神经分布规律的基础上,改良简化的SNSRH手术步骤,使SNSRH能以逐步推广。(5无论是SN·SRH术式还是RH术式,均需切除子宫,而子宫在排尿过程中对膀胱是一个有利的支撑,失去子宫的支撑也是影响膀胱功能的重要因素。
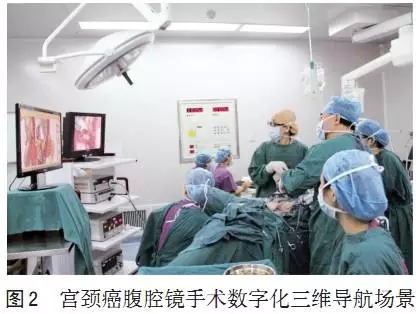
宫颈癌手术数字化导航技术是利用患者术前影像数据构建三维模型并与患者解剖结构准确对应,以实时反映患者的自体解剖情况,使手术更精确、更安全。手术导航技术可以极大地提高外科医生的手术精确度,从而为患者提供更好的医疗服务。目前手术导航系统已在欧美等发达国家的医疗机构中的脑科、骨科等专业应用,但尚未在妇产科领域开展。目前该技术大多数是在二维图像配准基础上实现,仅有少部分学者通过构建三维模型进行手术导航;而且目前该技术尚未能完全实现实时配准定位,具有较大的发展空间。再者,目前市面手术导航系统多为国外进口,设备昂贵,难以推广。
笔者团队在妇科手术导航的方面做了一些有益的探讨(图2),解决了部分技术难题,目前已经应用到临床诊疗中。
数字化导航的意义:(1可使复杂妇科手术,在术前重建患者的在体解剖,术中操作时实现 “个体化”及“精准化” ,减少手术中的失误,降低手术并发症,保证手术安全。(2)该技术能在术前确定病灶的三维位置,指明手术路径,制定手术计划,术前进行模拟手术,从而缩短手术时间,节约医疗成本。(3)还可用于培训年轻妇产科医生及进行课堂教学等,实现高层次人才培养的目的。例如对于晚期宫颈癌,有研究结果显示,直径>2 cm转移淋巴结对放化疗并不十分敏感,未切除肿大淋巴结而直接行放化疗的患者疗效不及切除肿大淋巴结的患者。
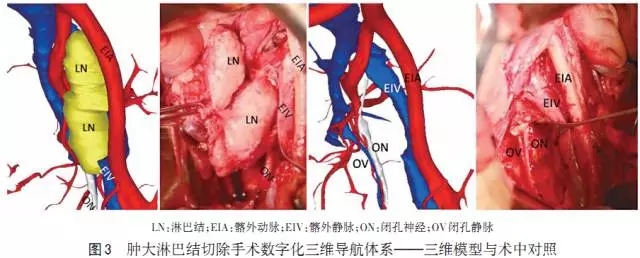
NCCN指南建议,在放疗前切除肿大淋巴结可提高疗效,但由于转移灶刺激淋巴结增生,分泌炎性物质,使其周围脂肪组织粘连变硬,与周围血管神经关系更加密切,尤其当淋巴结与静脉粘连致密时,甚至包绕血管神经,更加难以剥离,手术难度大,稍有不慎即可损伤血管,导致致命性的出血。若术时损伤闭孔神经,则可能导致患者术后出现患侧大腿不能内收、内旋,并出现股内侧皮肤感觉障碍等并发症。在切除盆腔肿大淋巴结时,不仅要求术者要有高超的技术,还要对患者盆腔结构有深入的了解,才能做到下刀如有神。因此,利用数字化三维重建技术构建肿大的淋巴结和盆腔血管神经,从三维立体的角度明确肿大淋巴结的具体位置,测量其与周围血管的距离,以在手术当中实时指导肿大淋巴结切除,避免了盲目手术,进腹探查后无信心手术而关腹的尴尬。不仅保证了患者的安全、避免不必要的手术,而且也使术者在做手术规划时更加全面而不盲目(图3)。(参考文献略)
 妇产科在线APP下载
妇产科在线APP下载













