子宫畸形的发生机制
子宫畸形的发生和隔膜有密不可分的关系,临床上常见的子宫畸形是纵隔,斜隔子宫较少见,横隔子宫极少见,主要分为对称性和不对称性子宫畸形两大类,由于正常女性生殖道发生从胚胎第6-14周,因此孕早期接触致畸因素,可导致生殖道畸形。
美国医学会与欧洲人类生殖及胚胎学会/欧洲医学会的分类区别
清楚明白子宫畸形的分类,有助于正确的临床诊断,才能选择更好的治疗方法,获得良好的预后。目前国际上主要应用的有美国医学会和欧洲医学会两大分类。
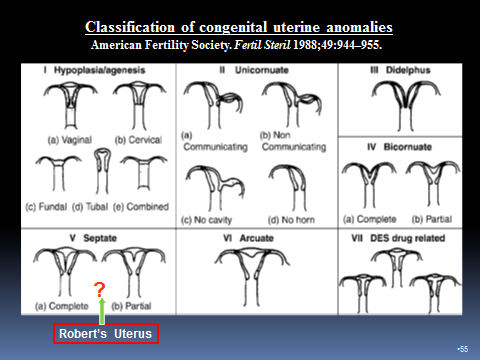
△美国医学会

△欧洲人类生殖及胚胎学会/欧洲医学会
欧洲人类生殖及胚胎学会/欧洲妇科内镜学会与美国妇科内镜学会分类的主要不同之处在于以下3点:①ESHRE/ESGE分类采取UCV分类将子宫、宫颈、阴道的畸形同时展现,一目了然。②ESGE分类取消了弓形子宫,此点的争议非常大,包括我国也并不赞同此点,因为研究显示弓形子宫对生殖确有影响,矫形治疗后可改善生殖预后。③ESHRE/欧洲分类增加了双角纵隔子宫,即双角、纵隔同时存在,这点曾以“混杂型纵隔子宫”在美国分类中增设。
子宫畸形(隔膜)治疗
手术治疗主要改善子宫畸形患者的阻塞症状和生殖预后。下面主要介绍以下3种手术方法的生殖预后疗效:①TCRS:纵隔切除术,该手术主要适用于完全纵隔、不全纵隔、不全双角、弓形子宫等畸形子宫的矫正,研究显示,纵隔术后足月分娩率约62.8%-87%。②TCUI:扩大子宫容积的一种手术,主要用于纠正单角子宫、T型子宫、宫腔粘连畸形。复兴医院的临床数据研究显示,单角子宫术后足月分娩率66.7%。③双角成形:由于手术例数少,现有的数据研究显示该术后的获婴率约60%-100%。
常见子宫畸形
1.弓形子宫
弓形子宫的发生率约占畸形子宫的10%,分类、诊断和治疗在国际上存在争议,腹腔镜探查可无明显异常,宫腔镜下见宫底略向下凹陷,三维超声检查诊断时以两侧输卵管开口的连线为底线,测量隔板凸向宫腔的长度,正常0.5cm,>0.5cm、<1.5cm为弓形子宫,≥1.5cm为子宫纵膈,也可测量纵隔两侧子宫内膜的夹角,夹角锐利,64°-90°为纵隔子宫,夹角钝圆,103°-152°为弓形子宫。矫形手术较为简单,在宫腔镜下以针状电极自右向左分割纵隔。分割后肌肉回缩,形成一个正常的宫底。注意术中腹腔镜或超声监护,避免穿孔,术中纵隔完全切除,且没有形成残隔说明手术成功了。
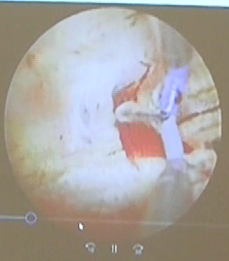
2.不全纵隔、完全纵隔
不全纵隔、完全纵隔因为改变了子宫腔的对称形态,常引起不孕和反复流产、早产和胎位异常,因此有症状的纵隔子宫需要治疗。
①不全纵隔:隔板下极在子宫颈的内口水平,手术时需用电切环,左右对称电切隔板,否则可造成术后宫腔形态欠佳。
②完全纵隔:隔板达到宫颈内口内甚至达到宫颈外口。目前国内外学者对宫颈内隔板的保留与否存在争议,主张保留者认为保留宫颈纵隔可预防术后妊娠期宫颈机能不全的发生。主张不保留者则认为手术过程中剪刀剪开,操作简单,后续手术操作方便,且至今为止,临床研究尚未发现术后宫颈机能不全。该手术的操作要点包括:术前一侧宫腔放置球囊(选用10号或8号的儿童型有导丝导尿管),球囊内注入约3ml美兰生理盐水,向下牵拉,使球囊下端处于宫颈内口水平,电切环于另一侧宫腔电切凸起隔板,形成不全纵隔状态后,去除球囊,后续手术方法同不全纵隔。
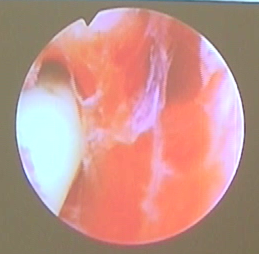
△一侧宫腔放置球囊
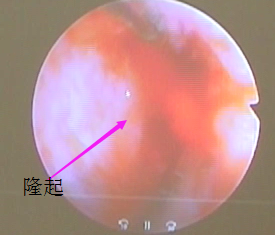
△隔板隆起
3.不全双角子宫
不全双角子宫的发生率约占子宫畸形的13.6%,其中40%可引起流产、早产、分娩异常或不孕不育症等。下宫底略有凹陷,形态各异,手术时用针状电极自左向右或自右向左电切隔板,相比不全纵隔而言,手术深度更深,手术范围更大,术中的难点是隔板是否切干净的评判和手术止血,因为局部止血过度,将导致术后妊娠期子宫张力不够,而发生子宫破裂,以透光试验判断手术是否成功。
罕见子宫畸形
本文主要介绍以下4种罕见子宫畸形的诊治及生殖预后疗效:完全双角、斜隔子宫、单角子宫、T形子宫,以上四种子宫畸形都有一定的自然妊娠率,因此,对于这类不孕患者,需排除所有的不孕因素后才可以建议其进行纠正子宫畸形的手术,但必须告知患者不能保证其术后一定能够妊娠,因为这并非治疗不孕症的手术。
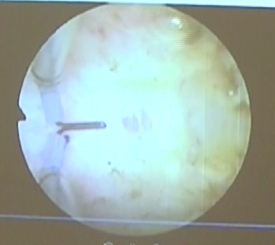
1.斜隔子宫:该畸形子宫罕见,首先由Robert于1970年报道,其宫腔隔膜起源于宫底,斜行附着于一侧子宫壁,导致隔膜两侧宫腔大小不对称,或出现阻塞型完全纵隔子宫畸形,因子宫壁附着点高低不同,导致症状不同,多在青春期,因宫腔积血、腹痛难忍就诊而被发现。
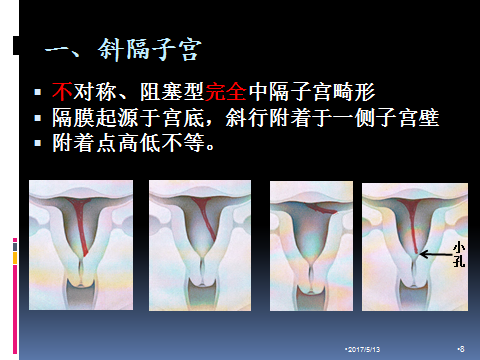
症状:青春期以原发性痛经居多,性成熟期主要为不孕、复发性流产,且因隔后宫腔积血或宫腔积血排除不畅、宫腔粘连、EMS、子宫腺肌病、感染等引发腹痛,“闭锁”腔妊娠是较少出现的症状。
诊治现状:该病的临床表现与有功能的残角子宫(积血)极为相似,因此,鉴别诊断是其难点。过去经常行开腹手术,手术前百思不得其解,手术台上剖视子宫发现一侧小宫腔方能明了,现在,对于闭锁腔积血明显者,采用宫腔镜下隔板电切或剪除大大减少了手术的创伤。只是目前的术前辅助诊断技术,二维超声、三维超声、HSG、MRI,甚至单纯腹腔镜或宫腔镜难以明确诊断。因此,宫腹腔镜联合手术是其诊断治疗的金标准,但仍需要警惕,必要时可行宫腹腔镜联合+B超监护,主要适用于闭锁腔狭小者。宫腹腔镜联合诊断鉴别斜隔子宫与残角子宫的要点在于残角子宫与单角子宫的宫底分开,似双角状,斜隔子宫的宫底正常或一侧子宫膨隆。
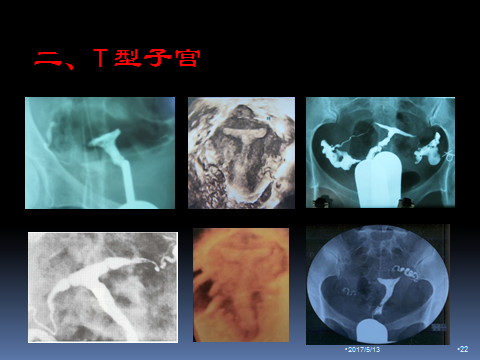
2.T型子宫
T型子宫的特点是子宫腔的近心端狭窄,宫腔呈T型,子宫底部呈弓型,该疾病女性怀孕后的自然妊娠率高,现有数据显示约47%,足月妊娠率低,约21%。改畸形子宫治疗时采用宫腔镜子宫壁切除术(TCUI),切除过多肌肉组织,使宫腔扩大为三角形,术后足月妊娠率约66.7%,仅次于纵隔子宫手术成功率,但需注意该病病人有30%宫颈机能不全发生率,可在术后半年到一年之间行腹腔镜下宫颈环扎术。
3.单角子宫
据统计,单角子宫的发生率约1/1000-4020,占先天性子宫畸形的4.4%,36%-40%的患者合并泌尿道畸形,偶有同侧卵巢发育不良,这类患者的原发不孕发生率15%,流产率37.1%,宫颈机能不全的发生率30%。由于其子宫畸形不对称性、多类型性和症状的不典型性,其诊断十分复杂和困难,手术主要以宫腔镜下子宫壁肌肉切除和肌肉分割为主,注意术后行宫颈环扎术。
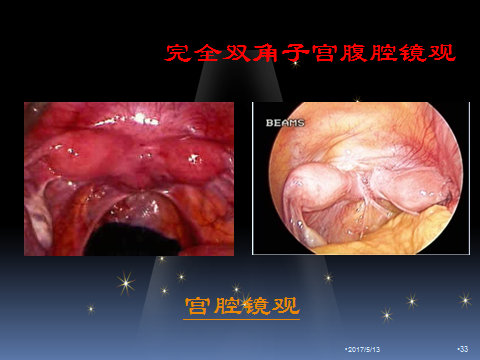
4.完全双角子宫
据统计,完全双角子宫的发生率约占子宫畸形的13.6%,40%的双角子宫可引起流产、早产、分娩异常或不孕不育等。隔板达宫颈内口,其手术适应症为两次以上自然流产史,或原因不明不孕及需ART的原发不孕症患者,传统行开腹子宫矫形术,手术成功率达50%,随着宫腔镜手术的应用和发展,现今多采用宫腹腔镜联合手术,手术成功率与开腹手术相当,术中注意切除双角子宫隔板并切开子宫底后,逐层、纵向、对合缝合子宫,术后半年到一年之间行腹腔镜下宫颈环扎术,治疗宫颈机能不全。
子宫畸形、TCRS对生殖预后的影响机制
畸形子宫受隔膜的影响,导致子宫容积缩小,矫形术后改善生殖预后的机制是什么呢?以下图为例:
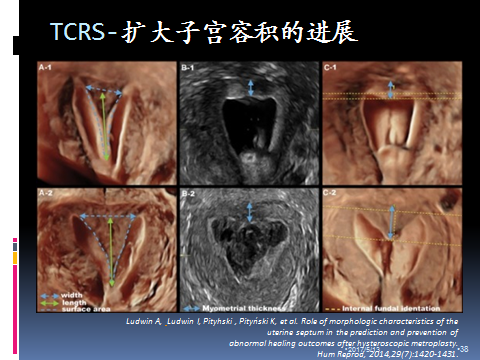
这是一个最新的报道,从图中我们可以看出,术前患者宫腔窄小,术后即时经直肠超声显示宫腔明显扩大,但术后两个月再次复查三维彩超显示宫腔较前略有缩小(瘢痕挛缩所致)甚至出现隔板。这给了我们一个很大的启示,组织个体是有差异的,术后宫腔缩小、出现隔板等情况,不能说明手术医生当时手术没有做彻底。
因此,子宫畸形对生殖预后的影响机制可能为隔膜处结缔组织减少,引起蜕膜化不良和阻碍胎盘形成,同时肌肉组织成分的增加,可引发过强的宫缩,从而造成流产、早产等。行子宫畸形TCRS术后,可能因为子宫容积的扩大,使孕卵有适合的种植部位,和子宫体组织血管重建,改善了子宫内膜功能,使这类不孕患者的生殖预后有所改善。
小结
综上所述,子宫畸形合并不孕患者,行矫形手术有效,但要明确诊断,警惕斜隔子宫,是手术有效的基础,目前主要的矫形方法有对称切除纵隔、分层切除子宫壁,并要关注宫颈机能不全,对有病史者可同时行宫颈环扎手术。
 妇产科在线APP下载
妇产科在线APP下载













