案例
患者29岁,孕1产0,因停经38+1周,阴道流血4天,于2018年8月31日由外院转诊至广州医科大学附属第三医院妇产科。患者为自然受孕,孕早期曾因阴道少量流血拟“先兆流产”予保胎治疗。孕期定期产前检查9次,未见特殊异常。2018年8月27日于外院进行产前检查,常规阴道检查后出现少量活动性阴道流血,阴道窥器下见宫颈后唇赘生物(具体不详),取活体送病理检查,病理回报为宫颈恶性肿瘤(图1)。
患者入院后检查:宫高37 cm,腹围99 cm,先露头,胎方位LOA,胎头未衔接,胎心140次/分。偶可扪及不规律宫缩,强度弱。估计胎儿体重3000 g。阴道检查:宫颈5点、12点处可见赘生物,大小约0.5 cm×0.5 cm,宫颈质软,双侧骶主韧带未扪及增粗,肛查未及异常。阴道镜检查:宫颈5~7点可见赘生物2 cm×1 cm,质地脆,少量接触性出血。
实验室检查:鳞状细胞癌抗原(squamous cell carcinoma antigen, SCCA)含量0.6 ng/ml,人乳头瘤病毒(human papilloma virus,HPV)阴性。盆腔磁共振检查(magnetic resonance, MR)显示宫颈黏膜增厚,宫颈7点方向见一点状弥散加权成像(diffusion weighted image, DWI)高信号。
病理科会诊意见为子宫颈赘生物腺癌,考虑透明细胞癌的可能性较大。充分与患者及家属沟通病情后同意剖宫产终止妊娠,但拒绝同时行根治性子宫切除术。遂于2018年9月5日行子宫下段剖宫产术,娩一活男婴,体重3000 g,Apgar评分10分-10分-10分。术中探查子宫及双侧附件未见异常。胎盘病理回报:未见肿瘤成分。剖宫产术后3天出院。出院诊断:(1)妊娠合并宫颈肿瘤(透明细胞癌);(2)妊娠期糖尿病A1级;(3)中度贫血;(4)孕1产1,孕38+6周剖宫产。
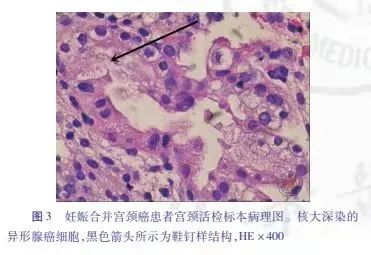
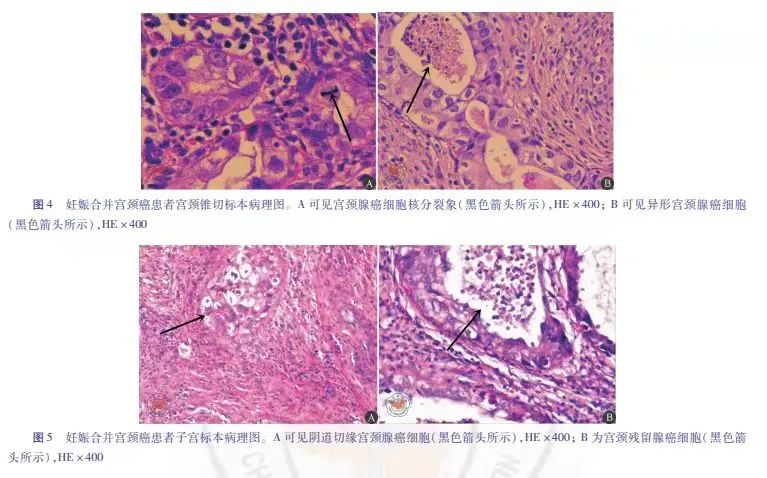
患者剖宫产术后25天再次行阴道镜检查:III型转化区,宫颈表面光滑,1点处可见粗壮异形血管,2~7点及12点处宫颈管可见醋白上皮,均取组织活检(图2)。病理结果回报:腺管结构位于黏膜层内,部分腺上皮呈空泡状,偶见鞋钉样结构,未见核分裂,形态上需要鉴别诊断透明细胞癌和宫颈腺体A-S反应(图3)。免疫组化检查示:34βE12(+),ER-α(个别+),Ki-67(热点区10%),NapSinA(+),P16(+ + +),P53(野生型),PR(-),HNF1-β(+),P504S(+)。
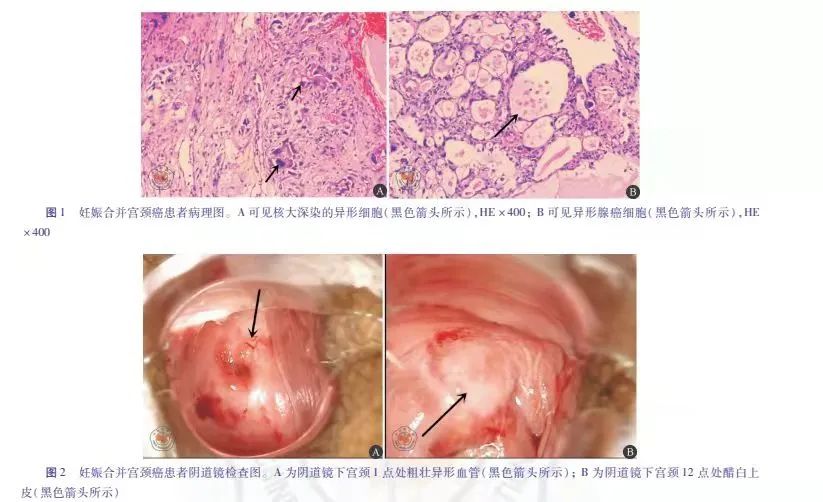
此时诊断尚不能明确,于2018年10月8日行宫颈冷刀锥切术,组织病理报告:
(1)子宫颈透明细胞癌,浸润纤维肌层,深度约7 mm;
(2)宫颈外口和侧切缘未见癌组织,局部内口切缘距癌组织约1 mm(图4)。同时将锥切后病理玻片送复旦大学附属妇产科医院会诊,会诊结果为宫颈透明细胞腺癌。
拟诊宫颈透明细胞癌IB1期,2018年10月22日行腹腔镜下广泛性子宫切除术+双侧输卵管切除+双侧盆腔淋巴结清扫术。术后病理回报:宫颈10~11点见透明细胞癌残留,浸润深度约1 mm,水平宽度约2 mm;阴道壁切缘约12点左右可见透明细胞癌累纤维肌层;余子宫内膜、双侧输卵管双侧宫旁切缘、双侧盆腔淋巴结均未见癌细胞(图5)。
患者术后8天出院。出院诊断:
(1)子宫颈透明细胞癌IB1期;
(2)剖宫产术后。出院后患者转中山大学肿瘤防治中心补充放疗,电话随访2018年11月至2019年1月共完成七次放疗,目前患者一般情况良好。
讨论
妊娠合并子宫颈癌是指妊娠期和产后6个月内诊断的子宫颈癌[1]。近年来随着辅助生殖技术的发展和应用,以及女性妊娠年龄的推迟,妊娠合并恶性肿瘤的发生率有上升趋势,文献报道为1/1000~1/1500,其中宫颈癌约占1/3 [2-3]。妊娠合并子宫颈癌大部分为鳞状细胞癌,腺癌较少。宫颈透明细胞癌是宫颈腺癌中的一种,极为罕见,Pavlidis[4]报道宫颈透明细胞癌发生率仅占同期腺癌人数的4%~9%,低于Jiang[5]报道的15.2% 。
目前有关妊娠合并子宫颈癌的治疗经验仍然较少,妊娠期宫颈癌的诊断和临床分期与非孕期一致,既往观点认为妊娠合并子宫颈癌一旦确诊应尽快终止妊娠,然后治疗宫颈癌,但随着学科发展,对不同孕周和不同临床分期妊娠合并宫颈癌的处理方案亦有不同[6]。对宫颈浸润性癌患者孕期的管理需制定个体化方案。早孕期和中孕早期诊断的宫颈癌患者,如有终止妊娠意愿或孕期肿瘤进展,应尽早终止妊娠治疗宫颈癌[7]。孕周<22周的患者如有继续妊娠意愿可行淋巴结切除,孕期腹腔镜下淋巴结切除术对胎儿影响较小[8]。IA2~IB1期宫颈癌可行宫颈锥切,对于更高级别的宫颈癌可行新辅助化疗。
欧洲妇科肿瘤学会(ESGO)认为,在患者知情同意的情况下,铂类药物新辅助化疗最早可用于妊娠14周合并宫颈癌的孕妇[9]。Khler等[10]研究发现,铂类化疗药物在脐带血和羊水中药物浓度低于母体血液中药物浓度,铂类化疗药物不增加胎儿畸形和围产期发病率,认为可能与胎盘的屏障作用有关。但孕期新辅助化疗仍有风险,De等[11]报道1例35岁、孕27周、宫颈鳞状细胞癌IB2期的患者,行铂类化疗2个周期后肿瘤体积明显减小,孕35周行剖宫产术同时行宫颈癌根治术,分娩一健康男婴,该男婴22月龄时诊断急性白血病(M7),行骨髓移植。
国际妇产科联盟 2018报告指出,妊娠合并子宫颈癌的管理遵循与非妊娠期同样的原则[12]。在妊娠16~20周前发现子宫颈癌应及时治疗,根据疾病分期采用手术或放化疗;中期妊娠之后,在维持妊娠的同时,可对知情同意的患者行手术和化疗;妊娠20周后诊断的ⅠA2~ⅠB2期患者,推迟根治性治疗是一种选择,与非妊娠患者比较并未显示不良预后[13];在有适当新生儿护理的三级医疗中心分娩时,在妊娠34周前行剖宫产同时根治性子宫切除术;推迟治疗对更晚期病例的生存影响尚不清楚,当计划推迟治疗时,采用新辅助化疗可阻止局部晚期宫颈癌的疾病进展。
本例患者孕前未行宫颈细胞学和HPV筛查,性生活史仅1年,追问患者家族史,母亲及6个姐姐均无子宫颈癌病史,母亲有乳腺癌病史,否认己烯雌酚用药史,HPV筛查未见感染。Jiang等[5]研究报道,HPV感染与无己烯雌酚暴露病史的宫颈透明细胞癌无明显相关。本例患者剖宫产术后再次做宫颈活检,病理报告示部分腺上皮呈空泡状,偶见鞋钉样结构,未见核分裂,形态上需要鉴别诊断透明细胞癌和宫颈腺体A-S反应。宫颈A-S反应表现为透明细胞和靴钉细胞,无普遍的核不典型性,极少或无核分裂象,在分娩后宫颈内口发生率约为10%,需与宫颈透明细胞癌鉴别;临床特点为年轻孕妇,临床症状缺乏或无肿块,组织学无浸润。
鉴于患者为孕期和产后高激素特殊阶段,临床检查及影像学磁共振显像未见明确肿物,且腺体改变仅限于黏膜内,综合考虑宫颈腺体A-S反应可能性大。经谨慎考虑本例患者行宫颈锥切后再次送病理科检查,同时送复旦大学附属妇产科医院行病理会诊,一致诊断宫颈透明细胞腺癌,明确诊断后行根治术,术后病理显示阴道壁切缘12点左右部位可见透明细胞癌累纤维肌层,故建议患者补充放疗。
妊娠合并子宫颈癌多在妊娠中晚期被发现,多数患者孕前和孕早期未进行子宫颈癌筛查,故在临床工作中应重视和加强孕前及孕期子宫颈癌筛查。孕期宫颈细胞学检查发现宫颈异常的,应结合病史和体征(如与产科因素无关的阴道出血或发现宫颈肿物)行阴道镜检查,对可疑宫颈高级别上皮内病变或子宫颈癌的患者,建议做宫颈活检,病理检查明确诊断[1]。孕期发现的宫颈上皮内病变应严密随访,产后6周再次行阴道镜检查。怀疑妊娠合并子宫颈癌的患者应尽快转诊至有治疗经验的上级医院诊治。由于妊娠合并子宫颈癌多为个案报道,治疗经验较少,还需要积累更多的资料进行进一步研究。
[1] 魏丽惠, 赵昀, 谢幸, 等. 妊娠合并子宫颈癌管理的专家共识,中国妇产科临床杂志[J]. 2018, 19(2): 190-192.
[2] Esposito S, Tenconi R, Preti V, et al. Chemotherapy against cancer during pregnancy: A systematic review on neonatal outcomes[J]. Medicine (Baltimore) 2016, 95: e4899.
[3] Iavazzo C, Minis EE, Gkegkes ID. Current management of gynecologic cancer in pregnancy [J]. J Turk Ger Gynecol Assoc, 2018, 19: 104-110.
[4] Pavlidis NA. Coexistence of pregnancy and malignancy[J]. Oncologist, 2002,7(2): 279-287.
[5] Jiang X, Jin Y, Li Y, et al. Clear cell caicinoma of the uterine cervix: clinical characteristic s and feasibility of fertility-preserving treatment [J]. Onco Targets and Therapy, 2014, 7: 111-116.
[6] McCormick A, Peterson E. Cancer in Pregnancy [J]. Obstet Gynecol Clin N Am, 2018, 45(2): 187-200.
[7] Amant F, Halaska MJ, Fumagalli M, et al. Gynecologic cancers in pregnancy: guidelines of a second international consensus meeting[J]. Int J Gynecol Cancer, 2014, 24(3): 394-403.
[8] Vercellino GF, Koehler C, Erdemoglu E, et al. Laparoscopic pelvic lymphadenectomy in 32 pregnant patients with cervical cancer: rationale, description of the technique, and outcome [J]. Int J Gynecol Cancer, 2014, 24(2): 364-371.
[9] Cibula D, Ptter R, Planchamp F, et al. The European Society of Gynaecological Oncology/European Society for Radiotherapy and Oncology/European Society of Pathology guidelines for the management of patients with cervical cancer [J]. Radiother Oncol, 2018, 127(3): 404-416.
[10] Khler C, Oppelt P, Favero G, et al. How much platinum passes the placental barrier? Analysis of platinum applications in 21 patients with cervical cancer during pregnancy [J]. Am J Obstet Gynecol, 2015, 213(2): 206.e1-206.e5.
[11] De Vincenzo R, Tortorella L, Ricci C,et al. Locally advanced cervical cancer complicating pregnancy: A case of competing risks from the Catholic University of the Sacred Heart in Rome [J]. Gynecol Oncol, 2018, 150(3): 398-405.
[12] Bhatla N, Aoki D, Sharma DN,et al. Cancer of the cervix uteri [J]. Int J Gynecol Obstet, 2018, 143 (Suppl. 2): 22-36.
[13] Sorosky JI, Squatrito R, Ndubisi BU, et al. Stage I squamous cell cervical carcinoma in pregnancy: Planned delay in therapy awaiting fetal maturity[J]. Gynecol Oncol, 1995, 59(2):207-210.
本文引用:
王月祉, 彭娟, 麦凤鸣. 妊娠合并子宫颈透明细胞腺癌一例[J/CD]. 中华产科急救电子杂志, 2019,8(3): 188-190.
 妇产科在线APP下载
妇产科在线APP下载













